|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Хирургическое лечение. Вопрос о выборе консервативного или хирургического метода лечения, так же как и самих методов консервативного леченияВопрос о выборе консервативного или хирургического метода лечения, так же как и самих методов консервативного лечения, является до сих пор предметом споров отечественных и зарубежных авторов. Мы считаем, что на уровне современных знаний эти методы не должны быть альтернативой друг другу. Еще в 1982 г. T.Tanabe и соавт. сформулировали следующие проблемы лечения, актуальность которых сохраняется и в настоящее время: • предоперационные — выбор подходящей фазы заболевания, т.е. стабилизация воспаления, разработка строгих показаний к оперативному вмешательству; • интраоперационные — техника шва, укрепление восстанавливаемого участка, выбор протеза; • послеоперационные — стабилизация воспаления, тщательный мониторинг за прогрессированием заболевания. Данные литературы свидетельствуют о необходимости в пред- и послеоперационном периоде предпринимать различные противовоспалительные мероприятия. У больных, оперированных на фоне активности процесса, проходимость реконструированных артерий в сроки до 3 лет была значительно ниже, составив 53 %, в то время как у больных, оперированных в хронической стадии процесса, — 88 % [Ра-jari et al., 1986]. Т.А.Султаналиев (1979), изучая ближайшие и отдаленные результаты реконструкций почечных артерий, также отметил, что у оперированных в острой стадии у 33,3 % развился тромбоз, тогда как в хронической — у 6,7 % пациентов. Проведенные нами исследования показали, что морфологическая ремиссия наступает позже, чем клиническая. Так, 10 больных были оперированы непосредственно после завершения курса пульс-терапии. При гистологических исследованиях у 7 больных зафиксировано продолжающееся воспаление в стенке аорты. У всех 17 больных, оперированных в сроки через 3—4 мес после окончания курса пульс- терапии, морфологическая картина соответствовала хронической стадии воспаления. Данные, сопоставимые с проведенными нами ранее исследованиями, приводят другие авторы. Kerr и соавт. (1994), проанализировав образцы биопсии, взятой во время операции у 9 пациентов с клинически неактивной стадией заболевания, обнаружили в 4 случаях (44 %) воспалительную реакцию сосудов, хотя при исследовании только у 2 из 9 пациентов была повышена СОЭ (у 1 из 4 гистологически подтвержденных). P.Lagneau (1987), исследовав препараты, взятые у 12 пациентов, сообщает о гистологическом подтверждении активного воспаления в 5 интраоперационных биопсиях при исходно отсутствующих клинических и лабораторных признаках активности заболевания. По данным F.A.Weaver (1990), даже нормализация СОЭ в результате длительного применения ГК не привела к морфологической ремиссии заболевания. В интраоперационных образцах у всех 6 пациентов зарегистрирован артериит с изменениями от «мягкого воспаления до умеренного». Таким образом, морфологически воспаление продолжается дольше, нежели свидетельствуют лабораторные показатели. В связи с этим мы считаем чрезвычайно важными следующие положения: • больных неспецифическим аор-тоартериитом целесообразно оперировать после стихания острой и подострой стадии воспаления; • методом выбора в пред- и послеоперационной противовоспалительной терапии является пульс-терапия циклофосфаном и метил-преднизолоном; • операцию предпочтительнее выполнять через 3—4 мес после завершения эффективной пульс-терапии. На сегодняшний день основными показаниями к хирургическому ле-
I чению неспецифического аортоар-териита являются: ▲наличие стойкой артериальной гипертензии, обусловленной вазо-ренальным генезом или коарктаци-онным синдромом; ▲гемодинамически значимые поражения сонных артерий; ▲ишемия верхних или нижних конечностей; ▲ наличие аневризмы аорты. ветвей дуги аорты. Первые успешные операции на ветвях дуги аорты были выполнены в начале 50-х годов [Schimizu, Sano, 1951]. Тем не менее большинство сосудистых центров даже сегодня располагают опытом лишь единичных вмешательств на ветвях дуги аорты при НАА. Так, по данным Hirose, Inada (1983), имеющих весьма солидный опыт лечения больных неспецифическим аортоартериитом, за 20-летний период из 104 наблюдавшихся пациентов лишь 10 были выполнены реконструктивные вмешательства на брахиоцефальных артериях. В одной из наиболее солидных статистик индийских авторов [Ра-rulkar, 1982] сообщено только о 22 вмешательствах на ветвях дуги аорты при неспецифическом аортоар-териите. Из наблюдавшихся 107 пациентов E.Lupi-Herrera и соавт. (1977) оперативному лечению были подвергнуты лишь 22 пациента. К 1991 г. в ИССХ им. А.Н.Бакулева и с 1983 по 2000 г. в Институте хирургии им. А.В.Вишневского выполнено более 100 операций на ветвях дуги аорты [Покровский А.В., 1991]. Оперативное лечение на брахиоцефальных ветвях дуги аорты показано при: • преходящих нарушениях мозгового кровообращения при наличии гемодинамически значимых поражений; • гемодинамически значимых стенозах или окклюзиях общих сонных артерий;
• позвоночно-подключичном синдроме обкрадывания при клинических проявлениях; • субкомпенсированной и деком-пенсированной ишемии верхней конечности. Вопрос о вмешательствах при асимптомном течении заболевания до настоящего времени окончательно не решен. В отличие от атеросклероза при неспецифическом аор-тоартериите отсутствует механизм эмболизации из распадающейся бляшки. При анализе отдаленных результатов неоперированных больных с асимптомным течением лишь у 13 % больных развились преходящие нарушения мозгового кровообращения. В то же время некоторые исследователи указывают на возможность возникновения ишемическо-го инсульта у бессимптомных больных, минуя стадию преходящих нарушений мозгового кровообращения [Sano Aiba, 1986]. Г.А.Цицуашвили (1986), изучив анамнез заболевания у 212 пациентов с поражением брахиоцефальных артерий, обусловленным НАА, установил, что инсульт развивался более чем у 10 % пациентов, причем у 50 % из них на фоне дисцир-куляторной энцефалопатии без предшествующих ТИА. В подавляющем большинстве случаев он формировался в течение первых 4—5 лет от начала заболевания (85,7 %). По нашему мнению, оперативное вмешательство показано больным с множественными поражениями дуги аорты, при окклюзиях и гемодинамически значимых стенозах общих сонных артерий даже при асимптомном течении заболевания. На сегодняшний день большинство клиницистов предпочитают менее травматичные экстраторакальные вмешательства [Покровский А.В., 1991; Ванг Ж. и др., 1998], однако некоторые авторы считают нецелесообразным ис- пользовать подключичную или подмышечную артерии в качестве донорской. J.M.Giordano и соавт. (1991) отметили, что стенотические или окклюзионные поражения после первичных реконструкций развиваются в области анастомоза с подключичной артерией. В то же время стенотических поражений восходящей аорты не было зафиксировано. Авторы не рекомендуют использовать подключичные и подмышечные артерии в качестве артерии-донора даже в том случае, если они явно не вовлечены в процесс. Клинические вспышки заболевания, по мнению авторов, с высокой вероятностью вовлекают эти артерии в процесс. Мы считаем, что риск вовлечения в процесс артерий при экстраторакальных вмешательствах явно преувеличен и предпочитаем экстраторакальные вмешательства (сонно-подключичное или сонно-подмышечное шунтирование при поражении подключичной артерии или подключично-сонное шунтирование при поражении общих сонных артерий) в тех случаях, когда это возможно, в связи с распространенностью процесса. В ИССХ им. А.Н.Бакулева до 1983 г. и в Институте хирургии им. А.В.Вишневского с 1983 по 2000 г. проведено подключично-сонное шунтирование у 19; сонно-подключичное — у 15; подключично-подключичное шунтирование — у 11 больных. Для выполнения экстраторакальных вмешательств требуется пригодный, т.е. интактный, участок донорской артерии, которыми могут быть общая сонная артерия при сонно-подключичном шунтировании или подключичная артерия при подключично-сонном протезировании. К сожалению, это не всегда возможно при множественном характере поражения, что нередко просто не позволяет выполнить более щадящие вмешательства. Операции типа бедренно-сонного шун- тирования, предложенные Wang и соавт. (1987), на наш взгляд, представляются гемодинамически необоснованными. В этих случаях отдают предпочтение трансторакальным операциям [Покровский А.В., 1991; Ванг Ж., 1998; Kimoto et al., 1979], особенно одностороннему аортокаротидному, аортобикаро-тидному и аортосонно-подклю-чичному протезированию. Так, в ИССХ им. А.Н.Бакулева до 1983 г. и в Институте хирургии им. А.В.Вишневского с 1983 по 2000 г. аортобикаротидное протезирование выполнено у 30 больных; одностороннее протезирование сонных артерий — у 9; аорто-сонно-подключичное — у 18 и протезирование брахиоцефального ствола — у 5 больных [Покровский А.В., 1990]. Особенности техники выполнения вмешательств на сонных артериях заключаются в обязательном наложении дистального анастомоза по типу конец в конец. При распространении процесса на бифуркацию мы используем следующий технический прием. Внутреннюю сонную артерию рассекаем с переходом на стенку наружной сонной артерии, тем самым формируется длинный косой анастомоз между протезом и бифуркацией сонной артерии. При наложении проксимального анастомоза (техника подробнее изложена в разделе «хроническая мозговая недостаточность») в восходящей аорте выкраивают окно для наложения широкого проксимального анастомоза. Аортобикаротидные операции сопровождаются наибольшим числом осложнений, прежде всего возникновением геморрагического инсульта, обусловленного, по нашему мнению, несоответствием притока и оттока крови и повышением АД, которое наблюдается в первые часы и сутки после оперативного вмешательства. Высокую вероятность развития этого наиболее тяжелого, а в большинстве случаев фатального осложнения подтверждают Ж.Ванг и со-авт. (1998), которые наблюдали его у 6 пациентов. При этом 4 из них погибли. По данным Kimoto (1979), геморрагический инсульт развился у 4, а различные неврологические осложнения — у 15 из 18 больных, которым были выполнены аортобикаро-тидные реконструкции. Эти обстоятельства повлияли на пересмотр вопросов тактики при хирургическом лечении неспецифического аортоартериита брахио-цефальной локализации. В последние годы мы отказались от аортобикаротидного протезирования, предпочитая односторонние аортокаротидные реконструкции, при возможности дополняем их ре-васкуляризацией артерий верхней конечности. Реконструкцию другой сонной артерии мы считаем возможным выполнять не раньше 1— 2 мес после первой операции. Аналогичной тактики придерживаются сегодня и китайские авторы, которые также отказались от одновременной реваскуляризации обеих сонных артерий. Для профилактики отека мозга после аортобикаротидных реконструкций предложены ипсилатераль-ная височная краниотомия, мониторинг спинального давления с декомпрессией при повышенных цифрах. Однако при одновременной реваскуляризации обоих ка-ротидных бассейнов риск возникновения геморрагического инсульта остается высоким [Ванг Ж., 1998]. Мы являемся противниками баллонной ангиопластики у больных НАА. Панцирный характер поражения не только существенно уменьшает возможность баллонной дилатации у больных неспецифическим аортоартериитом, но и значительно повышает риск появле- ния инсультов при дилатации бра-хиоцефального ствола и тем более каротидных артерий. Ж.Ванг (1998) сообщает о тяжелейшем инсульте с фатальным исходом после баллонной ангиопластики брахиоцефаль-ного ствола у больного с множественным поражением ветвей дуги аорты. Выполнение одномоментных операций на экстракраниальных и почечных артериях не оправдано, так как тяжесть состояния больных, травматичность одномоментных реконструкций резко повышают риск развития интра- и послеоперационных осложнений. Целесообразны этапные реконструкции. Очередность коррекции того или иного артериального бассейна решается с учетом гипотензивной пробы, которая позволяет оценить толерантность головного мозга к искусственно создаваемой умеренной гипотензии. При положительных результатах гипотензивной пробы (появление неврологического дефицита или падение объемной скорости кровотока по интактной ОСА более чем на 30 %) прежде всего необходима реконструкция брахиоцефальных артерий, несмотря на реальную угрозу возникновения геморрагического инсульта в послеоперационном периоде. При отсутствии неврологического дефицита следует выполнить реконструкцию торакоабдоминального сегмента аорты. Одновременное сочетание ишемии головного мозга и вазоренальной гипертензии зафиксировано у 25 (37,3 %) больных. У 5 (4,6 %) проведены 2-этапные соче-танные реконструкции ветвей дуги и торакоабдоминального отдела аорты. При поэтапных сочетанных операциях на ветвях дуги аорты и тора-коабдоминальном ее сегменте в 3 наблюдениях первым этапом выполняли реконструкцию ветвей дуги аорты, учитывая низкую толерантность больных к гипотензив- ной пробе, а вторым — реконструкцию торакоабдоминального сегмента аорты и почечных артерий. В 2 наблюдениях последовательность была обратной. Ближайшая послеоперационная летальность после экстраторакальных вмешательств не превышает 1—2 %. В отдаленные сроки частота возникновения тромботических осложнений при НАА выше, чем при атеросклерозе этой же локализации. По данным Г.А.Цициашви-ли (1986), обобщившего опыт ИССХ им. А.Н.Бакулева за 24 года, хорошие отдаленные результаты после реваскуляризации каротид-ного бассейна зарегистрированы у 80 % больных. Хуже результаты после реконструкции подключичных артерий. Это прежде всего связано с пролонгированным характером поражения подключичных артерий. Подавляющее большинство тромботических осложнений наступает в первые 2 года после операций. При купировании воспаления проходимость шунтов, по нашим данным, более чем в 1,5 раза выше, чем у больных с продолжающимся воспалением и неадекватной противовоспалительной терапией, и приближается к отдаленным результатам у больных с хронической стадией процесса. Это подтверждают и результаты других хирургов [Pajari et al., 1986], по мнению которых возникновение тромбозов связано с обострением процесса. Хирургическое лечение неспецифического аортоартериита торако-абдоминальной локализации. Реконструкция торакоабдоминального сегмента аорты и почечных артерий показана при: • стойко высокой артериальной гипертензии; • гемодинамически значимом ко-арктационном синдроме с наличием градиента АД в аорте более 20 мм рт.ст.; • аневризмах грудной или брюшной аорты. Абсолютные противопоказания к операции — наличие острой стадии неспецифического аортоартериита, острого инсульта в срок до 3 мес. В Институте хирургии им. А.В.Вишневского 67 пациентам выполнена реконструкция торакоабдоминального сегмента аорты с висцеральными ветвями и почечными артериями. Кровоток по висцеральным ветвям и почечным артериям восстановлен у 48 (71,6 %) больных. В 12 (25,0 %) случаях проведена изолированная реконструкция почечных артерий. Во всех остальных 36 (75,0 %) наблюдениях коррекция кровотока по висцеральным ветвям и почечным артериям сопровождалась одновременным восстановлением кровотока и по самой аорте. Операцию на торако-абдоминальном отделе аорты выполняли в условиях умеренной гипотермии, при изолированной реконструкции почечных артерий — в условиях нормотермии. Методом выбора защиты почек и спинного мозга от тепловой ишемии мы считаем общую умеренную гипотермию больного, которую использовали при реконструктивных вмешательствах на торакоабдоми-нальном отделе аорты. При изолированной реконструкции почечных артерий операцию выполняли в условиях нормотермии. При соче-танных поражениях висцеральных и почечных артерий изолированная реконструкция только почечного кровотока не должна предприниматься, так как развивающаяся в послеоперационном периоде относительная нормотензия может привести к формированию недостаточности кровотока по висцеральным ветвям. Методы реконструкции торакоабдоминального отдела почечных и висцеральных артерий. Для реконструкции торакоабдоминального отдела аорты мы применяли следующие доступы:
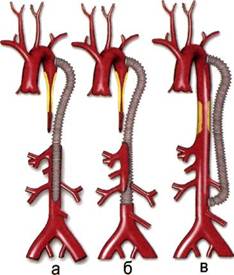
Рис. 5.76. Операции на торакоабдоми-нальном отделе аорты. а — протезирование с эндартерэктомией из висцеральных и почечных артерий; б — протезирование с раздельной имплантацией на единой площадке висцеральных и правой почечной артерий и имплантацией в протез левой почечной артерии; в — аорто-аортальное шунтирование. • торакотомию по шестому-седь-мому межреберью при локализации стеноза только в грудном отделе аорты; • торакофренолюмботомию по восьмому или девятому межреберью при локализации процесса в торакоабдоминальном отделе аорты или при необходимости реконструкции почечных или висцеральных артерий. Мы считаем, что применение широко пропагандируемого метода коррекции стеноза торакоабдомина-льной аорты аорто-аортальным шунтированием [Parulkar et al., 1992; Ванг Ж. и др., 1998], должно быть ограничено, так как восстановление только аортального кровотока при сочетанном стенозе устий висцеральных и почечных артерий созда- ет предпосылки для «обкрадывания» висцерального и почечного кровотока с реальным развитием цирку-ляторных расстройств в бассейнах указанных артерий. В связи с этим при сочетанных поражениях мы считаем целесообразной одномоментную реконструкцию торакоабдоминальной аорты и всех ее пораженных ветвей. Так, лишь в 1 (2,5 %) из 40 наблюдений мы использовали методику аорто-аортального шунтирования при гемодинамически незначимых поражениях висцеральных артерий и интактных почечных артерий. У 40 больных выполнены различные виды реконструкции самого торакоабдоминального сегмента аорты, при этом наиболее часто использовали протезирование торакоабдоминальной аорты — у 28 (70,0 %) из 40 больных. Независимо от возраста больного применяли протезы, по диаметру соответствующие размерам аорты взрослого человека (16—18 мм), а наложением косых анастомозов добивались соответствия диаметров протеза и аорты. При умеренном стенозе торакоабдоминальной аорты возможна реконструкция аорты с помощью боковой пластики аллозаплатой, но этот метод следует ограничивать ввиду опасности развития ложных аневризм в отдаленные сроки. При более распространенных окклюзи-рующих поражениях целесообразна комбинация методов протезирования аорты и ее боковой пластики наложением длинных косых анастомозов. Как правило, реконструкцию висцеральных и почечных артерий сочетали с коррекцией кровотока по торакоабдоминальной аорте у 33 (68,7 %) пациентов и при аортобед-ренных реконструкциях — лишь у 3 (6,3 %) пациентов. Показанием к эндартерэктомии из висцеральных и почечных артерий мы считаем локализацию патологического про-
Рис. 5.77. Операция про аорты. а — характер поражения аорты, висцеральных и почечных артерий; б — произведена резекция инфраренально-го отдела аорты, рассечены супра- и интерренальный отделы аорты; в — выполнение эндартерэктомии из висцеральных и почечных артерий; г — наложен дистальный анастомоз, протез выкроен в виде «язычка»; д — наложен длинный косой проксимальный анастомоз. цесса в проксимальных сегментах артерий (1,5— 2 см) ввиду возможности визуального контроля за полнотой эндартерэктомии. А.В.Покровский (1971) впервые в мире в ИССХ им. А.Н.Бакулева выполнил трансаортальную эндартер-эктомию из почечных и висцеральных артерий, которая открыла возможность ее широкого применения и позволила практически полностью отказаться от трудоемких методик протезирования висцеральных и почечных артерий во время реконструкции торакоабдоминаль-ной аорты (рис. 5.76). Данные литературы и наши наблюдения свидетельствуют о том, что для поражения торакоабдоми-нального сегмента аорты, как правило, была характерна склеротическая стадия заболевания, с редкими вспышками обострения воспалительного процесса именно в этом сегменте аорты, что не только допускало, но и обосновывало выполнение трансаортальной эндартерэктомии. При пролонгированных поражениях почечных артерий у 14 больных (28,6 %) проведена имплантация почечных артерий, а у 5 больных (10,2 %) — протезирование (рис. 5.77). В общей сложности отдаленные результаты реконструктивных операций на торакоабдоминальном сегменте аорты и почечных артериях нами были изучены у 48 больных (рис. 5.78). У 10 больных в различные сроки наблюдения выявлены осложнения, которые чаще всего были обусловлены реокклю-зиями или рестенозами дистальных анастомозов с почечными артериями. Это подтверждают также G.S.Kerr и соавт. (1994), которые в отдаленные сроки после 50 шунтирующих операций на почечных артериях и торакоабдоминальном сегменте аорты зафиксировали у 23 пациентов рестенозы (24 %), тромбозы (4 %), инфекцию протеза (2 %). Некоторые авторы считают весьма высоким риск возникновения в отдаленные сроки после этих вмешательств рестенозов анастомозов, ложных аневризм дистальных или проксимального анастомоза. Так, A.Takagi и соавт. (1989), проанализировав в отдаленном периоде (от 10 до 27 лет) результаты лечения 30 из 90 первично оперированных больных на брюшной аорте, почечных артериях и торакоабдоминальном сегменте аорты, сообщили, что у 5 пациентов (17 %) выявлены лож-
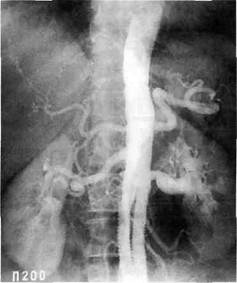
Рис. 5.78. Ангиограмма больной К. через 11 лет после протезирования тора-коабдоминального отдела аорты с имплантацией в протез висцеральных и правой почечной артерий. Раздельное протезирование протезом «Гортекс» левой почечной артерии. Аортобифемо-ральное протезирование. Все протезы полностью проходимы. ные аневризмы. Главную причину в развитии ложных аневризм авторы видят в отсутствии четких интра-операционных критериев определения воспаления стенки сосуда. В наших наблюдениях частота развития ложных аневризм составила лишь 2,2 %. Наши данные подтверждают результаты других авторов, которые также считают, что риск возникновения ложных аневризм после операций на тора-коабдоминальном и брюшном отделе аорты сильно преувеличен. Так, T.Miyata и соавт. (1998), изучившие отдаленные результаты у 91 пациента, установили, что частота развития ложных аневризм после протезирования брюшной и торакоаб-доминальной аорты у больных неспецифическим аортоартериитом составила 8,5 %. Интервал между первичной операцией и установленным диагнозом варьировал от 1,6 до 30 лет (9,8±1,8 года). Кумулятивная выявляемость аневризм анастомозов в течение 20 лет была 12 %. По мнению авторов, системное воспаление или назначение стероидов оказывало небольшое влияние на формирование аневризм анастомозов, однако имелась зависимость частоты возникновения ложных аневризм с исходным наличием аневризмы. По нашим данным, отдаленные результаты оказались хорошими в 35 (72,9 %) случаях, удовлетворительными — в 8 (16,7 %), неудовлетворительными — в 5 (10,4 %) случаях. В отдаленном периоде летальность среди данной группы больных составила 8,3 % (4 человека). С.Г.Амбатьелло (1989) при анализе отдаленных результатов кумулятивным методом у 29 больных (50,9 % от общего количества пациентов), оперированных по поводу стеноза торакоабдоминального сегмента аорты, выявил, что до 5 лет хорошие результаты зафиксированы у 73 % больных. Далее у ряда пациентов диагностирован возврат артериальной гипертензии к 10-му году наблюдения, хорошие результаты — отсутствие артериальной гипертензии — сохраняются у 45 %. Автор справедливо полагает, что это связано с отсутствием адекватного наблюдения и программного лечения таких больных по месту жительства. Данные литературы свидетельствуют о том, что оперативное лечение больных неспецифическим аортоартериитом необходимо также при выраженной аортальной недостаточности, поражении коронарных и легочной артерий. Однако число таких операций невелико. Первая операция на коронарных артериях у больного неспецифиче- ским аортоартериитом была выполнена Inokuchi и соавт. (1961), однако больной погиб в ближайшем послеоперационном периоде. Первая успешная операция была осуществлена в 1973 г. независимо Young и соавт. (1973), а также Lie и соавт. (1973). В 1991 г. Jun Amano сообщил, что к 1989 г. в мировой литературе имелись сведения о 63 пациентах с неспецифическим аортоартериитом, которым были выполнены операции на коронарных артериях (5 больных были оперированы автором). В связи с выраженными проявлениями стенокардии был прооперирован 71 % больных. В остальных случаях показанием к аортокоронарным шунтирующим операциям послужили изменения, выявленные при коронарографии. Особенностью аортокоронарного шунтирования больных неспецифическим аортоартериитом является необходимость пластики аорты в зоне наложения проксимального анастомоза в связи с риском поражения проксимального анастомоза вследствие активного воспаления восходящей аорты. Более чем в уъ случаев операцию на коронарных артериях сочетали с протезированием аортального клапана (16), операцией Бентала (3), митральной анну-лопликацией (1). Летальность после операций на коронарных артериях у больных НАА составила 7,9 % (5 из 60). Отдаленная проходимость аортокоронарных шунтов у больных неспецифическим аортоартериитом составила примерно 70 %. Следует помнить, что больные неспецифическим аортоартериитом требуют диспансерного наблюдения не реже 1 раза в год, включающего: • определение активности процесса; • дуплексное сканирование не только реконструированных сосудов, но и других артериальных бас- сейнов для своевременного выявления новых поражений; • противовоспалительные курсы пульс-терапии или поддерживающая терапия метотрексатом при определении высокой активности процесса. Литература Абугова СП. 27-летний опыт клинического изучения неспецифического аортоарте-риита/УУШ Всесоюзный симпозиум по клинической ангиологии. — М., 1984. — С. 50-52. Арабидзе Г.Г., Абугова СП., Матвеева JI.C Клинические аспекты болезни Такаясу (215 наблюдений)//Тер. арх. — 1980. — № 5. - С.24-29. Белова А.А., Архакова И.А., Оглоблжа О.Г. Лечение больных неспецифическим аортоартериитом с помощью методов экстракорпорального кровообращения//Тер. арх. - 1998. - Т.70, № 1. - С. 26-29. Гринштейн Ю.И. Васкулиты. — Красноярск, 2001. - С.221. Зотиков А.Е., Суслов А.П., Минкина А.Е. Иммунологические механизмы развития неспецифического аортоартериита//Тер. арх. - 1990. - № 4. - СЛ14—118. Насонов Е.Л., Баранов А.А., Шилкына Н.П. Васкулиты и васкулопатии.—М., 1999. Покровский А.В. Заболевания аорты и ее ветвей. — М., 1979. Покровский А. В. Опыт 303 операций при неспецифическом аортоартериите (болезни Такаясу)//Хирургия. — 1990. — № 11. - С.3-12. Покровский А.В., Варава Б.Н., Зотиков А. Е., Юдин В. И. Первый опыт применения пульс-терапии циклофосфаном и 6-метилпреднизолоном у больных с острой и подострой стадией неспецифического аортоартериита//Тер. арх.— 1990.— № 1. - С.43-46. Спиридонов А.А., Амбатьелло С Г., Самуи-лова Д.Ш., Хургес И.С, Иванова Л.С, Дмитриева В.А. Иммунологические нарушения гомеостаза и методы их коррекции для программного предоперационного лечения больных неспецифическим аорто-артериитом//Хирургия. — 1992. — № 5— 6. - С. 23-29. Юдин В. И. Ошибки в диагностике и результаты лечения больных неспецифиче- ским аортоартериитом: Автореф. дис.... д-ра мед. паук. — М., 1993. Bacon P.A., Moots R.J., Exley A.R. et al. Vital assesment of vasculitis//Clin.Exper.Rheumatol. - 1995. - Vol. 13. - P. 275-278. Castaneda G, Zuniga W.R., Formanek A. et al. Nonsurgical treatment of Takayasu's dise-ase//Cardiovasc. Intervent. Radiol.— 1981.— Vol. 4, N 4. - P.245-248. Hoffman G.S., Leavitt R.Y., Kerr G.S. et al. Treatment of glucocorticoid-resistant of relapsing Takayasu arteritis with merthotrexa-te//Arthritis-Rheum. - 1994. - Vol. 37, N 4. - P.578-582. Hoffman G.S. Treatment of resistant Takayasu's arteritis//Rheum-Dis-Clin-North-Am.— 1995. - Vol.21, N 1. - P.73-80. Ishikawa K, Maetani S. Long-term outcome for 120 Japanese patients with Takayasu's disease. Clinical and statistical analyses of related prognostic factors//Circulation. — 1994. - Vol. 90, N 4. - P. 1855-60. Judge R.D., Currier R., Grade W.A., Fing-ley M.M. Takayasu's arteritis and the aortic arch syndrom//Amer.J.Med. — 1962. — Vol. 32, N 3. - P.379-392. Kerr G.S., Hallahan C.W., Giordano J. et al. Takayasu Arteritis//Annals of Internal Medi- cine.- 1994.- Vol. 120, N П.- Р. 919-929. Langford С.A., Sneller M.C., Hoffman G.S. Methotrexate use in systemic vasculitis// Rheum-Dis-Clin-North-Am. - 1997. -Vol. 23, N 4.- P. 841-853. Liu L.S., Zheng D.Y. Aortoarteritis a report of 480 cases//J.Hum Hypertens. — 1990. — Vol. 4, N 2. - P. 135-137. Lupi-Herrera E., Sanches G, Marcushamur J. et al. Takayasus arteritis/Clinical study of 107 cases//Am.Heartl.J. - 1977. - Vol.93, N 1. - P. 94-103. Sen P.K. Non specific aortoarteritis//Sen P.K. Non specific aortoarteritis.—Bombay-New Delhi, 1973. Mevorach D., Leibowitz G., Brezis M., Raz E. Induction of remission in patient with Takayasu's arteritis by low dose pulses of met-hotrexate//Ann. Rheum. Dis. — 1992. — Vol. 51. - P. 904-905. Shelhamer J.H., Volkman D.J., Parrillo J.E. et al. Takayasu's arteritis and its therapy// Annals of Internal Medicine. — 1985. — Vol. 103, N 1. - P. 121-126. Talwar K.K., Vasan R.S., Sharma S. et al. Non-specific aortoarteritis: long-term follow-up on immunosupressive therapy//Int. J. Cardiol.- 1993.- Vol. 39, N 1.- P. 79-84. Дата добавления: 2015-02-06 | Просмотры: 997 | Нарушение авторских прав |