|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Аутоиммунные механизмыС момента первого предположения о роли иммунных нарушений в ге-незе неспецифического аортоартериита прошло более 40 лет [Judge, 1962]. Какие же доказательства роли аутоиммунной агрессии в развитии болезни Такаясу получены наукой сегодня? Еще в середине 30-х годов было Точка зрения о роли иммунопатологических процессов в развитии НАА подтверждается имеющимся, хотя и редким сочетанием этой патологии с другими аутоиммунными заболеваниями: болезнью Крона, неспецифическим язвенным колитом, системной красной волчанкой, ревматоидным артритом, узелко- вым периартериитом, гломеруло-нефритом. Имеются наблюдения неспецифического аортоартериита при иммунодефицитных состояниях [Насонов Е.Л. и др., 1999]. Установлено, что у 25—41 % больных выявляют антитела к кардио-липину, причем увеличение уровня антител ассоциируется, по данным Е.Л.Насонова (1999), с окклюзион-ным поражением сосудов, развитием артериальной гипертензии и поражением аортального клапана. В последние годы было доказано, что в сыворотках больных неспецифическим аортоартериитом в 38— 95 % случаев присутствуют антитела к эндотелиальным клеткам [Насонов Е.Л. и др., 1999; J.Eichhorn et al., 1996]. При этом частота их обнаружения и уровень существенно выше, чем при других заболеваниях с участием аутоиммунного компонента (системная красная волчанка, склеродермия, облитерирующий тромбангиит). Роль иммунных комплексов в развитии НАА обсуждается на протяжении не одного десятилетия. В.Л.Крылов (1992) указал на корреляцию между уровнем циркулирующих иммунных комплексов и воспалительной активностью. Однако другие авторы достоверной разницы между выявлением ЦИК, их концентрацией и изменением лабораторных показателей, отражающих активность воспаления (СРВ, СОЭ), а также стадией НАА не зафиксировали. Имеются единичные сообщения, свидетельствующие об увеличении концентрации отдельных классов иммуноглобулинов, диссеминиро-ванном отложении IgG в стенке аорты. Кроме того, в активной стадии заболевания зафиксированы отложения ЦИК и IgM в зонах разрушения эластического каркаса крупных артерий. При изучении белков системы комплемента выявляют сниженную концентрацию СЗ и С4 компонентов системы компле- мента, что, вероятно, сближает НАА с другими формами иммуно-комплексных васкулитов. Franclin и соавт. (1987), обнару протеина, считают, что воспалительные клетки своими энзимами могут разрушать соседние хрупкие эластические волокна. О.Г.Оглоби-на и соавт. (1996) установили увеличение в сыворотке крови больных эластин-пептидов и активности эластазы, а также катепсина. В качестве предполагаемого механизма возникновения аутоиммунной агрессии авторы выдвигают предположение об изменении проницаемости сосудистой стенки под влиянием каких-либо факторов. Y.Guotoku и соавт. (1981) на основании литературных данных и собственных полученных результатов приходят к выводу, что повреждение сосудистой стенки при НАА имеет гетерогенное происхождение. Постоянно образующиеся в норме ИК элиминируются из сосудистого русла, не вызывая болезни. Нарушение элиминации ИК может привести к их фиксации в тканях и началу патологического процесса. Имеются данные, что ИК при НАА фиксированы на Fc-рецепторах Т-лимфоцитов, что, по мнению некоторых авторов, способствует запуску аутоиммунного процесса. Предполагают, что образование иммунных комплексов происходит на фоне дефицита Т-клеточного звена иммунодефицита в ответ на хроническую инфекцию. Это подтверждает ряд исследований, в которых удалось обнаружить фиксированные комплексы в стенке пораженных артерий с помощью иммунофлюорес-центного метода. А.В.Серкина и др. (1984), Ueda и соавт. (1971), Numano и соавт. (1974) считают, что неизвестный антиген в составе ИК при НАА может иметь высокое сродство к компонентам стенки аорты или последняя под действием каких-либо агентов приобретает аутоантигенные свойства. По данным H.Ueda и соавт. (1969), у кроликов воспалительный процесс в аорте может быть индуцирован при иммунизации животных экстрактом, полученным из аорты больных неспецифическим аортоартериитом. Uedo и соавт. (1969), Ito и соавт. (1975) сообщили о повышении титра антиаортальных и антимедиальных антител, особенно в стадии обострения. В.А.Чопяк (1985) выявил, что титр антител к медиальному антигену повышен, а к интимальному антигену — ниже. В то же время другие исследователи не обнаружили достоверных различий между контрольной группой и больными неспецифическим аортоартериитом и не подтвердили возможности индуцирования НАА экспериментальным путем [Hirsch M. et al., 1964; Acher-son R. et al., 1968]. На наш взгляд, причины таких расхождений и невоспроизводимости результатов следующие: во-первых, высокая неспецифичность серологических методик и, во-вторых, использование для этих исследований, так же как и для изучения клеточных механизмов, той или иной совокупности белков, приготовленных гомогенизацией ткани, т.е. исключалась возможность идентификации и стандартизации антигенов, применяемых в качестве антигенов. Особое значение в патогенезе неспецифического аортоартериита придают нарушениям клеточного иммунитета. S.Sadar и соавт. (1992) сообщили о нарушении соотношения иммунорегуляторных субпопуляций лимфоцитов, в частности об увеличении СD4-Т-лимфоцитов и снижении CD8-T-лимфоцитов. Клинические особенности заболевания, сопровождающиеся выраженным кальцинозом и развитием фиброза вокруг аорты, побудили нас исследовать участие коллагена в развитии аутоиммунного процесса. При обследовании 28 больных неспецифическим аортоартериитом мы использовали методику торможения миграции лейкоцитов и им-муноферментный анализ определения антител на коллаген I, II, IV, V типов, у всех пациентов диагноз был подтвержден ангиографией. При исследовании было зафиксировано торможение миграции лейкоцитов на коллаген I и III типа у больных с высокой активностью процесса. А.Е.Зотиков и соавт. (1990) у больных с хронической стадией процесса не выявили статистически достоверной разницы по сравнению с контрольной группой и больными с облитерирую-щим атеросклерозом артерий нижних конечностей. Мы считаем, что у больных с острой и подострой стадией неспецифического аортоартериита имеется гиперчувствительность замедленного типа действия на I и III тип коллагена, т.е. именно тех типов коллагена, которые преимущественно располагаются в адвенти-ции, и их содержание убывает по направлению к интиме [Шехо-нин Б.В., 1984]. Такой характер изменений согласуется с представлениями, согласно которым повреждения адвентиции предшествуют повреждениям, возникающим в интиме. Положительная реакция только на эти 2 типа коллагена свидетельствовала если не о специфичности, то по крайней мере об избирательности этой реакции. Прогрессиро-вание заболевания и вовлечение в процесс новых артериальных бассейнов в первую очередь были связаны с остротой процесса. Выявленная сенсибилизация к коллагену I и III типа позволяет предположить аутоиммунный механизм, в основе которого лежит опосредованная Т-лимфоцитами активация макрофагов, приводящая к разрушению коллагеновых волокон с компенсаторным перераспределением коллагена и возникновением стенотического процесса. Возможен и второй механизм, связанный с нарушением связи лимфоцит—фибробласт. Полученные в эксперименте результаты доказали возможность стимуляции и подавления лимфоцитами выработки фибробластами коллагена I и III типа [Postletwait et al., 1984]. Гиперпродукция коллагена, стимулированная лимфоцитами, может вызывать формирование стеноза. Однако являются ли эти результаты следствием уже имеющейся болезни и именно этот ли механизм лежит в разрушении коллагеновой и эластической стромы артериальной стенки с последующим фиброзом, пока остается неясным. Таким образом, не вызывает сомнения, что неспецифический аор-тоартериит сопровождается выраженными иммунными нарушениями. Однако эффекторное звено иммунного дефекта остается неясным. Более того, спорен и тот факт, является ли иммунный дефект первичным или он возникает в ответ на остро или подостро текущее воспаление. Патологическая анатомия. Установлено, что при неспецифическом аортоартериите патологический процесс в основном поражает аорту, а также крупные отходящие от нее магистрали (артерии эластического и мышечно-эластического типов). При этом характерной особенностью заболевания является преимущественное поражение проксимальных сегментов, отходящих от аорты ветвей, в то время как ди-стальные отделы пораженных артерий, как правило, остаются интакт-ными (рис. 5.65). Наиболее часто в процесс при неспецифическом аортоартериите вовлекаются брахиоце-фальные артерии и торакоабдоми-нальный сегмент аорты с почечными и висцеральными артериями. Характерно вовлечение в процесс нескольких артериальных сегментов. Принципиально важная особенность неспецифического аор-тоартериита — внутриорганные сосуды и дистальные отделы артерий конечности не поражаются. По данным А.В.Покровского (1979), только у 10 % больных НАА в процесс вовлекаются магистральные артерии конечности. Патологический процесс при не-специфическом аортоартериите весьма вариабелен в зависимости от стадии воспалительного процесса. В результате выраженных воспалительных или аутоиммунных процессов разрушаются все эластические структуры в медии и адвентиции, с последующим образованием грану-лематозной, а в конечном итоге фиброзной и рубцовой тканей. С переходом же воспалительного процесса на интиму артерии последняя резко утолщается, склеро-зируется (рис. 5.66) и, таким образом, обусловливает сужение просвета пораженной артерии [Голо-совская М.А., 1984; Nasu, 1975; Edwards et al., 1989]. Изменения интимы при неспецифическом аортоартериите имеют вторичный характер и напоминают гранулематозные и фиброзные нарушения в адвентиции и медии. Однако явлений деструкции и некроза в этом слое не наблюдают. Характер пролиферативных изменений наиболее выражен в местах максимального сужения сосуда и в радиальной проекции они соответствуют очагам клеточной инфильтрации в медии и распада эластики [Голосовская М.А., 1972; Kinare, 1975; Nasu, 1975]. Для ранних инфильтративно-вос-палительных нарушений характерна пестрая клиническая картина [Sai-to et al, 1972; Kinare, 1975]. Выражена гранулематозная воспалительная реакция с обильными клеточ-
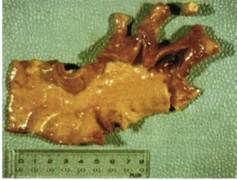
Рис. 5.65. Макропрепарат части восходящей и дуги аорты; окклюзия брахио-цефального ствола, левой сонной и левой подключичной артерий, выраженное утолщение и отечность восходящего отдела аорты. ными инфильтратами, состоящими из лимфоидных, фибробластиче-ских элементов, плазматических клеток. Эти деструктивные изменения возникают исключительно в адвентиции и медии, но их не наблюдают в интиме пораженной артерии [Nasu, 1975]. Нередко фиксируют очаговые фокусы деструкции и некроза, локализующиеся в основном в медии пораженной артерии. Описано также наличие гигантских многоядерных клеток [Голосовская М.А., 1972; Inoue et al., 1972; Nasu, 1975; Sunghal et al., 1978], которые, по мнению большинства авторов, яв-
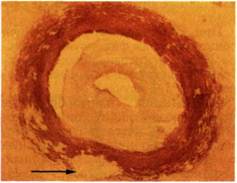
Рис. 5.66. Макропрепарат грудной аорты (поперечный разрез). Просвет аорты пропускает спичечную головку. ляются следствием разрушения эластического каркаса медии. По мере прогрессирования заболевания гранулематозные изменения превращаются в фиброзные, возникает фрагментация и деструкция эластических волокон в адвен-тиции и медии. Аналогичное изменение происходит и с мышечными элементами. В конечном итоге наступает хроническая стадия заболевания, результат которой — выраженный склероз и фиброз всех слоев стенки пораженного сосуда. На основании патогистологиче-ской картины Nasu (1963) предложил классификацию, выделив 3 последовательные стадии: • гранулематозно-воспалительную, для которой характерно формирование гранулем, микроабсцессов и локальных некрозов (клинически она, как правило, соответствует острой стадии заболевания); • диффузно-пролиферативную (продуктивную), характеризующуюся обильной клеточной инфильтрацией и пролиферацией вновь образованных тканей (соответствует подострой стадии заболевания); • фиброзная стадия воспалительного процесса и включающая выраженные фиброзные изменения. Вместе с тем в практической деятельности столь строгое выделение стадий весьма затруднительно, ибо при неспецифическом аортоартери-ите, как правило, в разных сегментах аорты и артерии можно видеть развитие различных фаз патологического процесса в отдельных сегментах артерии одновременно. Каждое повреждение состоит из комбинированной гистологической картины, но с преимущественным преобладанием одной из них [Голо-совская М.А., 1972; Покровский А.В. и др., 1979; Lupi-Herrera et al., 1977]. В.И.Юдин (1993) анализировал изменения, характерные для неспецифического аортоартериита у больных с различными клиническими стадиями и в процессе противовоспалительного лечения. Адвентиция в острой стадии представляла собой резко утолщенную муфту из соединительной ткани в виде гиализированных пучков коллагена. Вокруг vasa vasorum большое количество лимфоидных клеток и нейтрофильных лейкоцитов. Клеточные скопления имели тенденцию к расположению на границе адвентиции и медии. Наиболее ярко воспаление наблюдали в медии (рис. 5.67), причем более вы-раженым этот процесс был в наружных слоях медии. Медия не имела правильного строения, мышечный и эластический слой разрушены. Имелись участки отсутствия эластики. Такое явление, по меткому выражению М.А.Голосовс-кой, напоминало «плешины» (рис. 5.68). Внутренняя эластическая мембрана не имела равномерного волнистого строения и принимала причудливые формы и изгибы. Vasa vasorum были с утолщенными стенками и нередко с тромбированным просветом. Интима пораженной артерии представляла собой рыхлую резкогиперплазированную соединительную ткань. В отдельных сегментах она равномерно утолщена, в других беспорядочные выпячивания. Причем участки гиперплазии, как правило, соответствовали участкам деструкции эластического каркаса в медии и адвентиции. В интиме редко наблюдали крупные участки скопления лимфоцитов. Во второй пролиферативной стадии уменьшалось количество клеточных инфильтратов. Появлялись разрастания капилляров. В адвентиции и медии вокруг vasa vasorum клеточные скопления. Адвентиция оставалась резко утолщенной. В медии также уменьшалось количество лимфоидных инфильтратов, мышечные и эластические волокна местами замещались фиброзной тканью. Выявлены элементы фиброза. Интима выглядела неравно- мерно утолщенной, местами скле-розированной. Для поздней склеротической, или артериоцирротической, стадии были характерны единичные клеточные инфильтраты, которые локализовались преимущественно вокруг vasa vasorum. Участки деструкции эластики замещались фиброзной тканью. Имелись участки полной потери эластики. В утолщенной интиме также наблюдали склероз. Интерес представляют гистологические находки в коронарных артериях. М.А.Голосовская на основании патологоанатомических данных выделяет 2 типа поражения коронарных артерий за счет утолщения интимы в аорте и распространение утолщенной интимы с аорты в коронарную артерию. В большинстве случаев в коронарных артериях налицо продуктивное воспаление [Amano J., 1991]. Особенностью поражения легочной артерии является возможность поражения мелких ветвей, поскольку легочная артерия содержит эластические волокна на всем протяжении. Говоря о причинах развития того или иного варианта поражения, следует отметить, что развитие аневризматических расширений при неспецифическом аортоартери-ите, по-видимому, обусловлено преобладанием процесса разрушения эластики, особенно в медиальном слое над продукцией коллагена. Напротив, гиперпроцукция коллагена приводит к быстроформиру-ющемуся стенозу с образованием коллагеновой и фиброзной муфты в зоне пораженного сегмента сосуда [Покровский А.В. и др., 1990]. Патологическая физиология не-специфического аортоартериита соответствует заболеваниям, которые характеризуются нарушением кровообращения в различных артериальных бассейнах. При этом ни одно из сосудистых заболеваний не име-
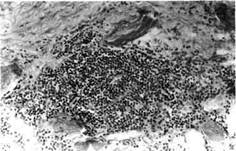
Рис. 5.67. Микропрепарат левой общей сонной артерии. Воспалительная реакция с обильными клеточными лимфо-идными элементамии в медии. Окраска гематоксилином и эозином. 100. ет столь необычного характера изменений патофизиологии кровообращения, которые происходят при неспецифическом аортоартери-ите. Длительность развития патологического процесса, безусловно, способствует развитию как коллатеральных путей кровообращения, так и развитию других компенсаторных механизмов. По данным Lupi-Herrera и соавт. (1977), развитие коллатерального кровооб-
Рис. 5.68. Микропрепарат общей сонной артерии. Стрелкой обозначен участок отсутствия эластического каркаса медии с образованием «плешин». Резко выраженная вторичная гиперплазия интимы с сужением просвета. Окраска фуксилином. 15. ращения у 94 % больных неспецифическим аортоартериитом хорошее. Варианты нарушения гемодинамики обусловлены ишемией различных органов. Принципиальным механизмом компенсации кровообращения различных бассейнов является артериальная гипертензия системного характера, обусловленная вазоренальным, коарктацион-ным, цереброишемическим или смешанным генезом. Вместе с тем не вызывает сомнения, что формирование и прогрес-сирование артериальной гипертен-зии любого генеза способствуют снижению компенсаторных возможностей миокарда, угрозе развития геморрагического инсульта и нефроангиосклероза. Рассмотрим варианты компенсации кровообращения при различных типах неспецифического аор-тоартериита. При поражении ветвей дуги аорты нарушается нормальное кровообращение головного мозга и верхних конечностей. Характерной особенностью неспецифического аортоартериита этой локализации является поражение общих сонных артерий и подключичных артерий во II и III сегменте. При этом окклюзию внутренней сонной артерии фиксируют довольно редко, а интракраниальные артерии вовлекаются в процесс не более чем в 3 % случаев. Компенсация кровообращения при окклюзии общих сонных артерий осуществляется за счет анастомозов подключичных и наружных сонных артерий (тиреокаротидный, каротидно-подключичный, тирео-окципито-каротидный, вертебро-окципито-каротидный анастомозы). Анастомозы осуществляют кровоток как в том, так и в другом направлении в зависимости от локализации окклюзии [Зингерман Л.С. и др., 1968; Takao et al., 1980]. При множественном характере окклюзирующего процесса с одновременным поражением общих, наружных сонных и окклюзии подключичной артерии коллатеральное кровообращение головного мозга и верхних конечностей осуществляется через межреберные и внутренние грудные артерии. Далее кровь поступает в щитошейный ствол и по указанным выше анастомозам попадает через перетоки в наружную (при ее проходимости), а затем во внутреннюю сонную артерию. Этот путь компенсации мозгового кровотока при неспецифическом аортоартериите играет важную роль, поскольку эти же пути коллатерального кровообращения, только в другом направлении, могут функционировать при сочетан-ных поражениях сонных, подключичных артерий и стенозирующем аортите. При стенозе нисходящей аорты кровоток через анастомозы сонных артерий с подключичными направляется не в сторону головного мозга, а в каудальном направлении в нисходящий отдел грудной аорты. Другим механизмом компенсации мозгового кровотока является артериальная гипертензия церебрального генеза. Установлено, что у больных с ок-клюзиями общих сонных артерий компенсация происходит за счет компенсаторного расширения и повышения объемного кровотока по позвоночным артериям. По нашим данным, объем кровотока по позвоночным артериям возрастает почти в 3 раза у больных с двусторонними окклюзиями общих сонных артерий. Нарушение кровообращения при стенозирующем типе аортита напоминает коарктационный синдром: регионарная гипертензия в верхних отделах туловища и нормо- или ги-потензия в нижней половине туловища. Как правило, генез гипертен-зии имеет смешанный характер и обусловлен коарктационным вазо-ренальным синдромом. Поражение почечных артерий приводит к более высокой гипертензии, чем при ко-арктационном синдроме. При сочетанных поражениях бра-хиоцефальных артерий и торакоаб-доминального отдела аорты коллатеральное кровообращение осуществляется в основном через внутренние грудные и эпигастральные артерии, а также через нижние межреберные и поясничные артерии. Однако в отличие от истинной коарктации последние расширены значительно меньше. Компенсация кровообращения по висцеральным артериям при поражении брюшного отдела аорты и висцеральных артерий осуществляется за счет анастомозов между висцеральными ветвями, в частности между верхней и нижней брыжеечной артерией за счет толстокишечных ветвей; между чревной артерией и верхней брыжеечной артерией за счет панкреатодуоденаль-ных ветвей и между нижней брыжеечной артерией и внутренней подвздошной артерией через прямокишечные ветви. Изменение кровотока по артериям кишечника может полностью компенсировать кровообращение внутренних органов. При окклюзии чревного ствола и верхней брыжеечной артерии компенсация кровообращения происходит через расширенную нижнюю брыжеечную артерию, затем кровь по дуге Риолана попадает в бассейн верхней брыжеечной артерии и чревного ствола. Дуга Риолана участвует и в кровообращении нижних конечностей в тех случаях, когда у больных неспецифическим аортоартериитом имеется окклюзия инфраренально-го отдела аорты. Через дугу Риолана кровь попадает в прямокишечные артерии, а далее через анастомозы с внутренними подвздошными артериями — в артерии нижних конечностей. Дата добавления: 2015-02-06 | Просмотры: 930 | Нарушение авторских прав |