|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Классификация сосудисто-мозговой недостаточностиМы пользуемся классификацией СМН по степени выраженности ишемического повреждения головного мозга, предложенной А.В.Покровским в 1978 г.: • I степень — асимптомное течение или отсутствие признаков ишемии мозга на фоне доказанного клинически значимого поражения сосудов головного мозга;
• II степень — преходящие нарушения мозгового кровообращения (ПНМК) или ТИА, т.е. возникновение очагового неврологического дефицита с полным регрессом неврологической симптоматики в сроки до 24 ч; • III степень — так называемое хроническое течение СМН, т.е. присутствие общемозговой неврологической симптоматики или хронической вертебробазилярной недостаточности без перенесенного очагового дефицита в анамнезе или его последствий. В неврологических систематизациях этой степени соответствует в том числе термин «дисциркуляторная энцефалопатия»; • IV — перенесенный завершенный или полный инсульт, т.е. существование очаговой неврологической симптоматики в сроки более 24 ч вне зависимости от степени регресса неврологического дефицита (от полного до отсутствия регресса). Среди инсультов невропатологи выделяют малый инсульт или полностью обратимый неврологический дефицит в сроки от 24 ч до 3 нед, а завершенные инсульты подразделяют по характеру сохранившегося умеренного или грубого неврологического дефицита. В принципе подобные классификации применяют повсеместно, только нередко авторы при описании поражений каротидных бассейнов объединяют I и III степени недостаточности, рассматривая таких пациентов как асимптомных. С современных позиций для такой точки зрения есть два существенных обоснования: во-первых, тактические подходы к лечению этих групп больных идентичны, как и результаты лечения, и, во-вторых, дифференцировать хроническое течение СМН от общемозговых симптомов при дисциркуляторной или посттравматической энцефалопатии, дегенеративных заболеваниях центральной нервной системы, тяжелой артериальной гипертензии, мигрени в ряде случаев затруднительно. Клиническая картина СМН складывается из трех групп симптомов: общемозговых, окулярных и/или полушарных при поражениях каро-тидного бассейна и симптомов нарушения кровоснабжения ВББ. К общемозговым симптомам относят головную боль, снижение памяти и интеллектуальных способностей. Окулярным проявлением поражения каротидного бассейна служит гомолатеральная стойкая или преходящая слепота, вызываемая эмболией в центральную артерию сетчатки и известная в литературе как amaurosis fugax, начало которой описывается пациентом как вспышка в глазу. Полушарные проявления СМН очень многообразны по проявлению и определяются локализацией ишемического повреждения мозга. Наиболее частыми полушарными очаговыми симптомами являются двигательные (гемипарезы) и чувствительные (гемианестезии) нарушения в симметричных конечностях и реже лица на стороне, противоположной локализации ишемического очага, а также расстройства речи при поражении левого полушария. Длительность присутствия неврологического дефицита определяет клиническую форму СМН: при ТИА — до 24 ч, при малых инсультах — от 24 ч до 3 нед, а если полного регресса очаговой симптоматики не происходит, то следует вести речь о завершенном инсульте. В зависимости от локализации зоны нарушения кровотока в головном мозге клиника СМН может значительно варьировать. При возникновении непроходимости ВСА с отсутствием достаточной компенсации кровообращения в одноименном полушарии через систему вил-лизиевого круга происходит развитие обширного инфаркта мозга, часто захватывающего все полушарие. Клинически это проявляется развитием контралатеральной гемипле-гии и выраженным угнетением сознания. Если есть возможность оценить сенсорную функцию, то выявляют контралатеральную геми-анестезию и гомонимную гемиа-нопсию (дефект правых или левых половин полей зрения). В случае сохранения адекватного коллатерального притока по ПМА и ЗМА на стороне поражения в вышеуказанной ситуации двигательные и чувствительные нарушения лица, руки и ноги имеют меньшую выраженность (парезы). При вовлечении доминантного полушария развивается глобальная афазия, при поражении недоминантного правого полушария — анозогнозия (отсутствие критической оценки своего дефекта: паралича, снижения зрения, слуха и т.д.). Острая окклюзия основного ствола СМА сопровождается аналогичными описанными выше очаговыми симптомами, а также угнетением сознания приблизительно у 1/4больных. При вовлечении более дистальной порции СМА происходит повреждение только кортикальных слоев лобной и передней частей теменной областей, что проявляется в первую очередь нарушениями в нижних 2/3лица и руке и менее выраженными — в ноге. Поражение доминантного полушария проявляется афазией, носящей преимущественно моторный характер (афазия Брока: нарушение активной речи при сохранении понимания устной и письменной речи); анозогнозия при НМК в недоминантном правом полушарии характеризуется меньшей выраженностью, чем при более проксимальных вовлечениях СМА. Более дис-тальные поражения СМА сопровождаются еще менее выраженными моторными и сенсорными нарушениями, сохраняется визуальный дефицит. При вовлечении доминантного полушария возникает сенсорная транскортикальная афазия Вернике (нарушение понимания устной речи при возможности повторения сказанного другим, списывания и письма под диктовку). Изолированное поражение недоминантной теменной доли вызывает нарушения стереогнозиса (тактильное распознавание объектов) и графестезии (распознавание объектов, нарисованных на коже). Поражение теменно-затылочной области доминантного полушария приводит к возникновению синдрома Герст-манна, включающего пальцевую агнозию (неспособность различать собственные пальцы), акалькулию (неспособность считать), аграфию (неспособность писать) и праволе-вую дезориентацию (неспособность различать правую и левую половины тела). Острая окклюзия ПМА сопровождается контралатеральным ге-мипарезом и гемианестезией с более частым присутствием моторных нарушений. Менее обширные инфаркты могут сопровождаться двигательно-чувствительными расстройствами только в контралате-ральной нижней конечности с нарастанием мышечной слабости в дистальном направлении. Двусторонние инсульты в бассейнах ПМА могут вызывать нижний парапарез, расстройства функции тазовых органов, чаще мочевого пузыря, реже акинетический мутизм, т.е. отсутствие речевого общения больного с окружающими при сохранности речевого аппарата на фоне торможения всех моторных функций, кроме фиксирующих движений глазных яблок, при сохранении сознания. Симптомы нарушения кровообращения в ВББ. Инфаркт в заднеполу-шарных отделах мозга в бассейне ЗМА приводит к контралатераль-ной гемианопсии с сохранением желтого пятна за счет смешанного кровоснабжения области последнего из бассейнов СМА и ЗМА. При затылочной гемианопсии больные ощущают дефицит поля зрения в отличие от среднемозговой гемианопсии, где пациент может не подозревать о дефекте зрения до проведения тестов. Кроме того, при затылочной гемианопсии могут в различной степени вовлекаться верхний и нижний квадранты и сохраняется оптокинетический нистагм, т.е. возникающий при фиксации взора на быстро сменяющихся, движущихся в одну сторону предметах. При двустороннем НМК в бассейнах ЗМА может возникать двусторонняя гомонимная геми-анопсия с сохранением или без сохранения желтого пятна (кортикальная слепота). Кроме того, для поражения затылочных долей больших полушарий характерны мета-морфопсии (искажение формы и размеров видимых предметов), па-линопсии (сохранение или повторное возникновение объекта после его исчезновения из поля зрения), фотопсии (возникновение пелены и сетки перед глазами), мерцательные скотомы (гемианоптические дефекты полей зрения, сопровождающиеся ощущением мерцания и мигре-неподобными болями), амнезии и контралатеральные гемианестезии. Очаговые нарушения кровоснабжения мозжечка и ствола мозга сопровождаются сочетанием нарушения функции гомолатеральных черепных нервов и мозжечковых расстройств с контралатеральными моторными и сенсорными нарушениями конечностей и туловища. Для указанной локализации поражений описано множество синдромов, связанных с нарушением проходимости конкретной ветви ОА. Одним из наиболее часто встречающихся симптомокомплексов является латеральный синдром продолговатого мозга, развивающийся, как правило, при окклюзии интрак-раниального сегмента позвоночной артерии, реже при возникновении непроходимости задней нижней ар- терии мозжечка. Характерными проявлениями последнего синдрома являются гомолатеральная пле-гия лицевой мускулатуры, паралич голосовой связки, атаксия, синдром Горнера и контралатеральная потеря болевой и температурной чувствительности половины тела, часто сопровождающиеся тошнотой, рвотой, головокружением и лицевой болью. При мозжечковых инфарктах возможна как изолированная атаксия, так и нередко в сочетании с головокружением, рвотой, нистагмом, диплопией, головной болью и угнетением сознания. Окклюзия ОА вызывает кому, тетрапарез и офтальмоплегию. Следует помнить, что обмороки или потери сознания (дроп-атаки), системные и несистемные головокружения не могут рассматриваться в качестве очаговых проявлений ВБН в отсутствие других очаговых проявлений нарушения кровообращения в ВББ. При поражении БЦС и проксимальном вовлечении ПКА, помимо клиники СМИ, может наблюдаться брахиальная ишемия, чаще возникающая при нагрузке. Критическая ишемия верхних конечностей отмечается редко и, как правило, связана с эмболией в дистальное русло руки из проксимальных артериальных сегментов. Для лакунарных инсультов характерны изолированный без сенсорных нарушений гемипарез с дефектами полей зрения или дисфазией при поражении внутренней капсулы или основания моста, изолированное нарушение чувствительности лица, руки и ноги без других очаговых поражений при поражении таламуса. Из других синдромов встречаются атаксический гемипарез (парез бедра с гомолатеральной атаксией) и синдром «дизартрия/ неловкая кисть». Реже выявляют сенсомоторные нарушения и другие очаговые дефициты в зависимости от локализации НМК. Учитывая многообразие клинических проявлений СМИ, больные с заболеваниями БЦА должны в обязательном порядке осматриваться невропатологами и окулистами. Физикальная оценка антологического статуса больных с СМИ складывается из пальпации и ауску-льтации. Пальпации доступны общие сонные, височные, подмышечные, плечевые, лучевые и локтевые сосуды. Стандартными точками для аускультации являются правое гру-диноключичное сочленение (проекция БЦС), углы нижней челюсти (бифуркации сонных артерий), надключичные ямки (устья позвоночных и подключичные артерии). При необходимости пальпацию и аускультацию проводят в проекции доступных БЦА на протяжении. Обязательным является измерение артериального давления на руках. Разница более 20 мм рт.ст. между плечевыми артериями свидетельствует о гемодинамически значимом поражении брахиоцефального ствола или подключичных артерий, если только нет симметричного поражения с обеих сторон. В последнем случае помощь может оказать измерение АД на ногах. Если не сужен торакоабдоминальный отдел аорты и нет поражения артерий нижних конечностей, АД на подколенных артериях в норме на 10— 20 мм рт.ст. должно превышать АД на руках, а АД на лодыжке соответствовать АД на верхних конечностях. Учитывая большую распространенность больных с СМН и огромную социальную и медицинскую значимость данной проблемы, можно выделить группы больных, которым в обязательном порядке должно проводиться комплексное инструментальное обследование для выявления поражений БЦА: • все пациенты, перенесшие инсульт, ТИА или страдающие ВБН; • больные, у которых выслушивается систолический шум на БЦА, особенно над бифуркациями сонных артерий, имеется асимметрия пульсации БЦА, градиент АД между руками свыше 20 мм рт.ст.; • все пациенты старше 50 лет с прочими сосудистыми поражениями (ИБС, аневризмы аорты, вазо-ренальная гипертензия, хроническая артериальная недостаточность н/к). При подтверждении диагноза СМН такие больные должны быть обязательно осмотрены сосудистым хирургом для решения вопроса о тактике лечения. Принципиальными задачами инструментальной диагностики у больных с хронической СМН являются: оценка степени и характера нарушений кровотока в экстра- и инт-ракраниальных отделах сосудов головного мозга, морфологическое изучение характера изменений сосудистой стенки (локализация, протяженность, структура и состояние внутренней поверхности), выявление ишемического повреждения головного мозга и описание его локализации и объема. На сегодняшний день среди различных диагностических методик наибольшее клиническое значение имеют и повседневно применяются: ▲ ультразвуковые методы исследования: непрерывно-волновая ультразвуковая допплерография, цветное дуплексное сканирование с цветным и энергетическим доппле-ровским картированием, транскраниальные допплерография и дуплексное сканирование; ▲ компьютерная томография; ▲ магнитно-резонансная томография и ангиография; ▲рентгено-контрастная ангиография. Все перечисленные методики, за исключением последней, являются неинвазивными (в некоторых ситуациях контрастное усиление требуется при КТ). Ультразвуковая допплерография (УЗДГ), до начала 90-х годов являвшаяся единственным ультразвуковым методом изучения кровотока, сегодня используется достаточно ограниченно — только для оценки функционального состояния вилли-зиева круга с помощью компрессионных проб и для определения направления кровотока в поверхностных артериях орбиты с целью выявления обкрадывания мозга через систему НСА при окклюзии гомо-латеральной ВСА. В настоящее время основным ультразвуковым методом исследования БЦА является цветное дуплексное сканирование (ЦДС). Его принципиальным преимуществом в сравнении с ранее использовавшимися ультразвуковыми методиками (УЗДГ, серошкальное дуплексное сканирование) явилась возможность исследования структуры и поверхности атеросклеротической бляшки, что позволило значительно расширить знания о патогенезе СМН (в основном это утверждение относится к поражениям каротид-ной бифуркации) и уточнить показания к оперативному лечению при стенозах ВСА. ЦДС БЦА (сонных, подключичных, позвоночных артерий) до и после хирургических реконструкций проводится линейным датчиком с частотой сканирования 5—10 МГц. Для визуализации дуги аорты и проксимальных отделов ее ветвей используют секторный датчик 3,5— 5 МГц. Ультразвуковое исследование проводят в следующих режимах: двумерного сканирования, цветного допплеровского картирования (ЦДК), энергетического допплеровского картирования (ЭДК), импу-льсно-волновой допплерографии. Все исследования выполняют в положении пациента лежа на спине. При сканировании сонных и подключичных артерий голова больного откинута назад и повернута в сторону, противоположную исследуемой. При изучении позвоночных артерий его голова расположена прямо и умеренно откинута назад. Для оптимальной визуализации дуги аорты и проксимальных отделов БЦА шея пациента по возможности должна быть максимально разогнута. Дугу аорты с проксимальными отделами ее ветвей исследуют из супрастернальной позиции (секторным датчиком), датчик осторожно заводят за грудину, плоскость сканирования направлена вниз. БЦС с устьями правых ОСА и ПКА исследуют из правого медиального надключичного доступа (датчик за грудиноключичным сочленением); плоскость сканирования направлена вниз и вправо (рис. 5.81). Интраторакальные отделы левых ОСА и ПКА исследуют из левого медиального надключичного доступа, датчик располагают параллельно ключице, сканирующая поверхность направлена вниз. Для достоверной визуализации всех стенок сонных артерий необходимо проводить сканирование в двух плоскостях — продольной и поперечной (по отношению к ходу сосуда) из различных доступов. При продольном сканировании сонных артерий используют следующие ультразвуковые доступы: • передний (переднемедиаль-ный) — датчик расположен параллельно проекции СА по переднему краю грудиноключично-сосцевид-ной мышцы (между мышцей и трахеей) под углом 30—60° к поверхности шеи, ультразвуковой луч направлен латерально и кзади; • средний (латеральный) — датчик расположен параллельно проекции СА на грудиноключично-со-сцевидной мышце (сканирование проводят через мышцу) под углом 60—90° к поверхности шеи, ультразвуковой луч направлен медиально; • задний (заднелатеральный) — датчик расположен параллельно
Рис. 5.81. ЦДС БЦС в ЭДК-режиме. Через 8 лет после баллонной дилатации БЦС. 1 - ОСА; 2 - ПКА; 3 - БЦС. проекции СА кзади от грудиноклю-чично-сосцевидной мышцы под углом 30—60° к поверхности шеи, ультразвуковой луч направлен медиально и кпереди. При сканировании в поперечной плоскости используют те же доступы, но датчик расположен перпендикулярно ходу СА и под углом, близким к 90° к поверхности шеи. Вначале датчик целесообразно расположить на грудиноключично-со-сцевидной мышце, а затем плавно смещать его кпереди и кзади от указанной мышцы для достижения оптимальной визуализации исследуемой СА. Исследование начинают с проксимального отдела ОСА, которую прослеживают в дистальном направлении до бифуркации. Затем идентифицируют устье ВСА и НСА и исследуют каждую из этих артерий (рис. 5.82). Для визуализации ВСА верхний край датчика необходимо сместить латеральнее, для исследования НСА — медиальнее. Продольное сканирование ОСА, ВСА и НСА проводят из трех указанных доступов.
Рис. 5.82. ЦДС бифуркации сонной артерии в продольном сечении. Затем исследуют сонные артерии в поперечной плоскости, перемещая датчик от проксимального отдела ОСА к ее бифуркации и до- ступным визуализации отделам ВСА и НСА (рис. 5.83). После этого возвращаются к продольному сканированию и проводят цветное допплеровское картирование и анализ спектра допплеровского сдвига частот. Для исследования подключичной артерии датчик располагают параллельно ключице в надключичной области, плоскость сканирования направлена вниз. Реже подключичную артерию удается оптимально лоцировать, располагая датчик вдоль проекции сосуда под ключицей, плоскость сканирования при этом направляется вверх. При исследовании плечевой, локтевой и лучевой артерий датчик располагают вдоль анатомического хода артерии под углом, близким к 90° к по-
Рис. 5.83. ЦДС бифуркации сонной артерии в поперечном сечении. 750 верхности кожи. Магистральные артерии верхних конечностей доступны для ультразвукового исследования практически на всем протяжении, начиная с нижней трети плеча. Ультразвуковое исследование дополняют измерением систолического АД на магистральных артериях обеих верхних конечностей. При исследовании позвоночных артерий пациент лежит на спине, голова расположена прямо и умеренно откинута назад. Датчик ставят параллельно проекции ПА спереди от грудиноключично-сосце-видной мышцы под углом, близким к 90° к поверхности шеи, ультразвуковой луч направлен кзади. Такое расположение датчика непосредственно над ключицей (перпендикулярно ключице) позволяет получить изображение подключичной артерии в поперечной плоскости, продольное изображение позвоночной артерии в устье и на протяжении I сегмента. Постепенное перемещение датчика вверх (не теряя изображение ПА на экране) позволяет визуализировать ПА в межкостных промежутках на протяжении II сегмента. Исследование подключично-сон-ного анастомоза проводят из медиального надключичного доступа. Для поиска указанного анастомоза пользуются двумя приемами: • вначале получают поперечный срез ОСА проксимальнее ее бифуркации, затем, не теряя изображения ОСА на экране, перемещают датчик вниз по направлению к ключице до визуализации анастомоза; • из надключичного доступа получают продольное изображение ПКА, затем перемещают датчик медиально вдоль ПКА до визуализации анастомоза (рис. 5.84). Оптимальная визуализация анастомоза, ПКА и ОСА достигается незначительными изменениями положения датчика под контролем изображения.
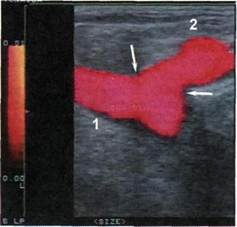
Рис. 5.84. ЦДС подключично-сонного анастомоза в ЭДК-режиме. Больной С. через 12 лет после операции реплантации ПКА в ОСА слева. 1 — ОСА; 2 — ПКА, стрелками указана область анастомоза. Поиск и исследование анастомозов (проксимального и дистально-го) подключично-подключичного шунта проводятся из надключичного, подмышечно-подмышечного шунта — из подключичного доступа. Подмышечно-подмышечный шунт, расположенный антестерна-льно, визуализируется на всем протяжении при перемещении датчика от анастомоза вдоль шунта под контролем изображения шунта на экране монитора. Проксимальный анастомоз под-ключично-наружносонного шунта лоцируется из надключичного доступа при перемещении датчика вдоль ПКА. После исследования области проксимального анастомоза необходимо переместить датчик вдоль шунта под контролем изображения до дистального анастомоза. При описании бляшек с помощью ЦДС классифицируют три группы морфологических признаков: ▲ в зависимости от структуры бляшки разделяют на три типа по прозрачности для ультразвукового излучения: эхонегативные (эхо-прозрачные, гипоэхогенные), эхо-позитивные (эхоплотные, изоэхо-генные) и гиперэхогенные (кальцинированные); ▲по соотношению представленных выше компонентов в бляшке последние разделяют на гомогенные (однородная эхоструктура) и гетерогенные (разнородная эхоструктура); ▲по характеру поверхности бляшки выделяют гладкую, неровную и изъязвленную поверхности. Все бляшки по первым двум критериям были разделены на 4 типа (классификация Gray-Weale): 1) гипоэхогенные гомогенные, так называемые мягкие бляшки (морфологически представлены ли-поидозом с участками геморрагии); 2) гетерогенные бляшки, включающие гипо- и изоэхогенные участки с преобладанием первых (липои-доз с участками геморрагии преобладает над фиброзными участками); 3) гетерогенные бляшки, включающие гипо- и изоэхогенные участки с преобладанием последних (зоны фиброза преобладают над участками липоидоза и геморрагии); 4) гомогенные изоэхогенные бляшки (сплошь фиброзные) с включениями Са или без таковых (гиперэхогенных участков), в повседневной практике называемые просто гомогенными, хотя к последним терминологически правильно относить и мягкие бляшки. Бляшки 1-го и 2-го типов были отнесены к нестабильным, т.е. склонным к быстрому росту, в том числе за счет массивного кровоизлияния в бляшку (особенно мягкие); бляшки 3-го и 4-го типов — к стабильным, имеющим тенденцию к более медленному росту. Клинически к нестабильным бляшкам можно причислять и изъязвленные бляшки из-за высокого риска эмбо-лизации мозга. Мы придерживаемся следующего протокола ЦДС при поражениях БЦА. Протокол ЦДС БЦА у больных до и после реконструкций ветвей дуги аорты. Доступы. 1. Супрастернальный доступ (сектор • продольное изображение дуги аорты и проксимальных отделов ее ветвей; • продольное изображение БЦС и его бифуркации, проксимальных отделов правых ОСА и ПКА.
2. Исследование сонных артерий в продольной и поперечной плоскости из переднего, среднего и заднего доступов (по отношению к грудиноключично-сосцевидной мышце). 3. Исследование позвоночных артерий из переднего доступа. 4. Надключичный доступ по длинной оси ПКА: а) медиальный: • бифуркация БЦС (справа), проксимальные отделы ОСА и ПКА; • подключично-сонный анастомоз; б) срединный и латеральный: • I, II, III сегменты ПКА; • проксимальный анастомоз подключично-наружносонного шунта. 5. Надключичный доступ по корот • поперечный срез ПКА, устье и I сегмент позвоночной артерии; • анастомозы подключично-наружносонного и подключично-подключичного шунтов. 6. Подключичный доступ по длин • продольное и поперечное изображение ПКА в I, II, III сегментах; • анастомозы подключично-под-ключичного шунта.
7. Исследование кровотока по плечевым,"локтевым и лучевым артериям (в проекции анатомического хода сосудов), измерение АД с обеих сторон. 8. Исследования шунтов на протяжении. Режимы. 1. Двухмерное сканирование: • анатомический ход исследуемых сосудов; • строение и толщина стенки артерии; • наличие, характер и протяженность атеросклеротических бляшек; • степень (процент) стенозирова-ния просвета; • однородность просвета, наличие тромбов. 2. Цветные допплеровские режимы. • поиск сосудов, анастомозов и шунтов и получение наиболее информативных сечений; • достоверное определение наличия либо отсутствия кровотока; • визуализация гипо- и изоэхоген-ных бляшек, определение состояния бляшек и тромбов в просвете; • определение степени стенозиро-вания; • точное направление сканирующего луча и коррекция угла при регистрации спектра допплеров-ского сдвига частот. ДДК: • достоверное определение направления кровотока; • оценка характера кровотока и выявление участков турбулентности. ЭДК: • адекватное прокрашивание просвета труднодоступных сосудов (проксимальные отделы ветвей дуги аорты, позвоночная артерия); • визуализация кровотока при неблагоприятном угле сканирования (БЦС, бифуркация БЦС, ПКА, разветвления и извитости сосудов, все анастомозы); • выявление низкоскоростных потоков. 3. Импульсно-волновая допплеро- • качественный и количественный Транскраниальная допплерография (ТКД) позволяет в зависимости от доступа лоцировать СМА, ПМА, ПСА и ЗСА (темпоральное окно), глазничную артерию и сифон ВСА (орбитальное окно), ОА и внутричерепные сегменты ПА (субокци-питальное окно), т.е. большую часть внутричерепных артерий. Основными параметрами, выявляе- мыми при ТКД, являются определение проходимости сосуда и наличие асимметрии кровотока между одноименными парными внутричерепными артериями. ТКД позволяет заподозрить поражение интрак-раниальных сегментов БЦА на этапе неинвазивного обследования, что невозможно при ЦДС. К недостаткам метода следует отнести выраженную оператор-зависимость, плохую повторяемость. Нередко при полной или частичной непроницаемости окон для ультразвуковых лучей из-за индивидуальных особенностей строения костей черепа ТКД неинформативна, а из-за трудностей при локации вследствие варианта расположения сосуда можно сделать ложный вывод о непроходимости исследуемой артерии. Наибольшее значение ТКД имеет для мониторирования мозгового кровотока во время оперативных вмешательств на БЦА (см. ниже). Транскраниалъное дуплексное сканирование (ТДС), особенно в режиме ЭДК, обладает большей чувствительностью, чем ТКД, и позволяет визуализировать интракраниальные артерии на некотором протяжении. В связи с фрагментарностью лоци-руемых сегментов составить целостную картину о кровотоке и состоянии просвета внутричерепных сосудов при ТДС затруднительно. Компьютерная томография (КТ) является одним из основных методов оценки локализации и объема ишемического повреждения головного мозга. На основании данных КТ оценивают достоверность анамнестических сведений о проявлениях СМН, при множественных поражениях БЦА уточняют тактику оперативного лечения путем определения клинически наиболее значимого бассейна кровоснабжения мозга, сведения о размерах ишемического очага (кисты) влияют на решение вопроса о возможности хирургического вмешательства
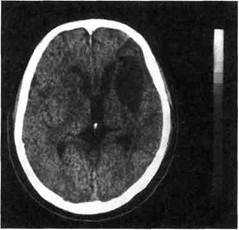
Рис. 5.85. КТ головного мозга. Слева в области височной доли имеется ишеми-ческая киста размерами 4,03; 55,0 см, сообщающаяся с передним рогом левого бокового желудочка. (рис. 5.85). Преимуществами КТ являются доступность и быстрота проведения исследования, при необходимости неоднократного в динамике, в том числе у больных, находящихся в критическом состоянии, требующих постоянной инфу-зионной и вентиляционной поддержки. Тем не менее метод имеет некоторые ограничения. Так, в остром периоде инсульта, за исключением кровоизлияний и обширных ишемических повреждений, в первые часы и дни очаг небольшого размера не визуализируется. Использование в такой ситуации контрастного усиления эффективно только через несколько дней после острого эпизода, когда происходит пропитывание очага контрастным веществом за счет экстравазации крови или плазморрагии. Кроме того, при КТ могут быть пропущены небольшие хронические инфаркты на основании мозга и в задней черепной ямке. Преимуществами магнитно-резонансной томографии (МРТ) в сравнении с КТ являются возможность более раннего, в тече- ние 24 ч, выявления остро развившихся ишемических очагов, более высокая чувствительность в определении как свежих, так и хронических участков ишемического повреждения, возможность получения срезов мозга в трех проекциях, что облегчает интерпретацию данных и делает их более наглядными. МРТ в отличие от КТ занимает больше времени на проведение исследования, которое к тому же невозможно у больных с инкорпорированными металлическими предметами (кардиостимулятор) и у пациентов, состояние которых нестабильно. Очень важным преимуществом магнитно-резонансных методов исследования является возможность одновременного проведения на том же аппарате, что и для МРТ, MP-ангиографии (МРА), т.е. неин-вазивной визуализации сосудов на протяжении за счет различия магнитных характеристик (интенсивности сигнала) у движущейся среды (яркий сигнал от крови) и неподвижных образований (темный сигнал). Семиотика получаемых данных при МРА аналогична таковым при контрастной ангиографии: окклюзия сосуда визуализируется как полное исчезновение сигнала, его «обрыв», а стеноз проявляется ослаблением интенсивности сигнала, сужением изображения артерии или даже локальным исчезновением сигнала. Так же как и дигиталь-ная субтракционная ангиография, МРА позволяет вычитать на изображении окружающие ткани и венозный кровоток. Получение изображения БЦА при МРА в зависимости от выбранного режима возможно на всем протяжении от дуги аорты до интракраниальных сегментов, что дает преимущество данному методу в сравнении с ультразвуковым. С учетом того что подавляющее количество пациентов с СМН составляют больные с поражением каротидной бифуркации, значение МРА как единственного метода неинвазивного выявления дистальных стенозов и высоких из-витостей ВСА (недоступных при ЦДС, особенно у пациентов с короткой шеей, высоким расположением бифуркации ОСА) неизмеримо возрастает (рис. 5.86). Чувствительность и специфичность МРА в диагностике поражений ВСА составляют 90—100 %, что не уступает возможностям ЦДС, а по мнению некоторых авторов, даже превосходит последние. При интерпретации двухмерных изображений при МРА возможна переоценка степени стеноза из-за того, что турбулентный кровоток на протяжении дистальнее участка даже умеренного стеноза может приводить к значительному падению интенсивности сигнала. В указанном режиме возможно также ар-тефициальное сужение сонных артерий при прохождении через кости основания черепа. Предотвратить указанные недостатки частично возможно в режиме трехмерного изображения. Сосудистая анатомия при МРА может изменяться во время глотания, кашля, дыхания и вследствие пульсации артерий. TOF-методика МРА не позволяет полностью проводить субстракцию, из-за чего сигналы от прилежащих тканей могут маскировать изображение сосудов. Последнее затруднение частично преодолевается с помощью РС-ме-тодики МРА, при которой вычитание осуществляется лучше. При МРА в отличие от ЦДС невозможно получение сведений о структуре и состоянии поверхности атеросклеротических бляшек. В целом на настоящий момент МРА можно оценить как единственный неинвазивный способ получения изображения БЦА на всем протяжении и как крайне важный метод для амбулаторного скрининга, не требующий госпитализации пациента. В тех случаях, когда необходимо максимально точное и детальное
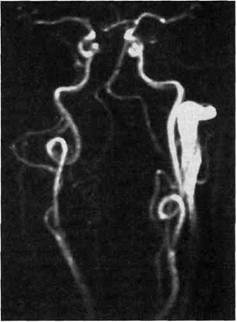
Рис. 5.86. МРА БЦА. Двусторонние петли ВСА. представление о соотношении БЦА между собой и/или окружающими тканями (особенно костными структурами), о морфологии сосудистого поражения, то до сегодняшнего дня золотым стандартом такой диагностики остается рентге-ноконтрастная ангиография в диги-тальном субтракционном варианте. Данная методика позволяет получить информацию о состоянии БЦА на всем протяжении от дуги аорты до корковых внутримозговых ветвей, выявить пути обкрадывания мозгового кровотока, а также оценить состоятельность коллатеральных связей БЦА. Для получения полноценной информации контрастирование сосудов проводят в двух проекциях. Для дуги аорты и начальных отделов ее ветвей базовой проекцией служит левая косая, в качестве второй возможно использование прямой или боковой. Для лучшего контрастиро- вания БЦА на шее применяют селективную катетеризацию сосудов; при использовании техники суб-тракции выбор проекций непринципиален. Внутричерепной кровоток оценивают в прямой и боковой проекциях раздельно для каждого из полушарий при поступлении контрастного вещества через ВСА и затем через ПА. Главным недостатком рентгено-контрастной ангиографии является ее инвазивность, что сопровождается риском развития осложнений, связанных с местом пункции (кровотечение, тромбоз), возможностью повреждения сосудистой стенки или эмболии при проведении катетеров и проводников, вероятностью возникновения неврологического дефицита вследствие стойкого спазма мозговых сосудов на введение контрастного вещества, а также системных осложнений вследствие циркуляции контрастного вещества (аллергические реакции, возникновение или прогрессирование почечной недостаточности и т.д.). В связи со сказанным проведение стандартной ангиографии допустимо только у тех больных, которым предполагается хирургическое вмешательство. Показания к рентгеноконтраст-ной ангиографии постепенно сужаются, а частота ее использования в диагностике СМН с каждым годом уменьшается на фоне совершенствования уже существующих и появления новых методов неинвазивной инструментальной диагностики. Тем не менее значение указанного метода в ряде диагностических ситуаций остается существенным, а с учетом развития эндоваскулярной хирургии и удельным ростом внут-рипросветных вмешательств в лечении поражений БЦА — очень большим. Дифференциальная диагностика СМН должна проводиться с дегенеративными и онкологическими заболеваниями головного мозга, ги- пертонической энцефалопатией, истерией, функциональными расстройствами на микроциркулятор-ном уровне (вегетативные нарушения, мигрень и т.д.). Главным дифференциальным критерием является отсутствие или наличие признаков клинически значимого поражения магистральных артерий головного мозга, а диагностическим методом выбора в решении этой задачи являются УЗ-методы диагностики и в первую очередь цветное дуплексное сканирование. Показания к хирургическому лечению и результаты исследований по сравнению эффективности каротид-ной ЭАЭ и медикаментозного лечения при стенозах ВСА. С середины 60-х до середины 80-х годов в мире был проведен ряд ретроспективных исследований по сопоставлению результатов хирургического лечения и консервативной терапии при каротидных стенозах. Оказалось, что у больных с ТИА в течение года после появления первых симптомов без оперативного лечения риск развития инсульта составляет 10 %, снижаясь далее до годового уровня 6 % и падая еще ниже после 3 лет [55]. Выполнение каротидной ЭАЭ уменьшало риск развития ОНМК в заинтересованной гемисфере менее чем до 1 % в год [56]. У больных после инсультов годовая частота повторных ОНМК составляла 9 % [41] и далее снижалась до 2 % в год после каротидной ЭАЭ [57]. Во второй половине 80-х годов и начале 90-х аналогичные исследования были посвящены изучению судьбы пациентов с асимптомными поражениями ВСА. Оказалось, что при стенозах более 75 % риск развития инсульта составляет от 3 до 5 % в год, причем в подавляющем большинстве случаев ОНМК возникает без предшествующих симптомов [58]. Частота возникновения инсультов после каротидной ЭАЭ падала до 0,3 % в год [59]. Полученные результаты позволили сформулировать требования к качеству оперативного лечения при стенозах ВСА, которые делали бы его эффективным в любом случае в сравнении с медикаментозной терапией. Так, сочетанный показатель летальность + осложнения от инсульта при каротидной эндартерэкто-мии не должен превышать 3 % у асимптомных больных, 5 % при ТИА, 7 % после перенесенного инсульта, 10 % при рестенозах сонных артерий, а летальность для всех групп не должна быть выше 2 % в каждой [60]. Тем не менее, несмотря на внешнюю убедительность приведенных выше данных в пользу оперативного лечения при каротид-ных стенозах, полученные результаты подверглись критике прежде всего со стороны невропатологов на следующих основаниях: • выводы были сделаны ретроспективно по группам больных, оперированных и наблюдаемых в различных клиниках, с различным хирургическим опытом, диагностическими возможностями и тактическими подходами; • из-за отсутствия единого протокола оценивались неодинаковые показатели и по различным принципам, поэтому результаты исследований статистически недостоверны и несравнимы; • отсутствовали или не соблюдались строгие принципы рандомизации (более легких больных оперировали, более тяжелых лечили консервативно или наоборот). С целью преодолеть полученные разногласия были проведены проспективные корпоративные рандомизированные исследования по окончательному сравнению результатов оперативного и консервативного лечения при стенозах ВСА. В 1991 г. были опубликованы результаты завершившихся исследований по стенозам ВСА от 70 % и более у симптомных больных: NASCET (North American Sympto- matic Carotid Endarterectomy Trial) и ECST (European Carotid Surgery Trial) [105, 106]. В первом исследовании было рандомизировано 659 больных в 50 центрах США и Канады. Через 2 года после включения в исследование у оперированных больных частота ипсилатеральных инсультов была равна 9 % (включая периоперационные), у получавших консервативное лечение (дезагре-ганты) — 26 %. Среди них частота летальных и инвалидизирующих инсультов составила 2,5 и 13,1 % соответственно, т.е. при медикаментозной терапии на долю таких инсультов приходилась половина. Исследование было прекращено по этическим соображениям. В Европейском исследовании было рандомизировано 778 симптомных пациентов, и через 3 года после рандомизации частота ипсилатеральных инсультов у оперированных и неоперированных больных составляла 12,3 % (включая периоперационные) и 21,9 %. Полученные данные окончательно разрешили вопрос о необходимости хирургического лечения при стенозах ВСА свыше 70 %. Первое исследование, в котором было проведено сравнение консервативной терапии и оперативных вмешательств у больных с асимп-томными стенозами, — ACAS (Asymptomatic Carotid Atherosclerotic Study) — завершено в 1995 г. [107]. Оно показало, что в течение 5 лет риск развития инсульта у неоперированных пациентов составляет 11 %, а после операции за тот же срок — 5,1 %, т.е. в абсолютных цифрах преимущество за год оказывалось и не столь велико в отличие от исследований симптомных поражений. Критикам хирургических вмешательств при асимптомных поражениях следует ответить, что указанное различие эффективности двух методик лечения не совсем достоверно. Асимптомные больные со стенозами ВСА появляются в по- давляющем большинстве случаев не сами по себе, а попадают в поле зрения врача по поводу заболевания других сосудистых бассейнов: коронарного, почечного, артерий нижних конечностей, аневризм аорты и т.д., причем заболевания в такой стадии, которое, как правило, уже требует оперативного лечения само по себе. Оценка же пери-операционного риска инсульта на фоне асимптомных клинически значимых поражений ветвей дуги аорты у пациентов во время рева-скуляризации прочих артериальных бассейнов никогда не проводилась и не рассматривалась сторонниками консервативных мероприятий вообще. Хирургическим коллективам хорошо известно клиническое значение данной проблемы, в связи с чем необходимо учитывать то обстоятельство, что огромное количество таких асимптомных больных оперируется по поводу поражений БЦА превентивно, в качестве первого этапа перед реконструкцией других магистральных сосудов. Для того чтобы объяснить и более точно оценить результаты ACAS, в настоящее время начаты и продолжаются новые исследования с попыткой выявить группы риска среди пациентов с асимптомными поражениями, в том числе исходя из структурных особенностей ате-росклеротических бляшек в каро-тидной бифуркации, что ранее не учитывалось. С учетом вышеизложенного показания к каротидной эндартерэкто-мии сегодня строятся на 4 критериях, приведенных ниже в порядке убывания по значимости: клинические проявления СМН, степень стеноза ВСА, структурная характеристика атеросклеротической бляшки и состояние ее поверхности. Мы определяем показания к каротидной эндартерэктомии при стенозах ВСА следующим образом: ▲ при симптомных поражениях (больные с ТИА или после инсуль- та) операция показана при всех типах бляшек (гипоэхогенные, гетерогенные и гомогенные), суживающих просвет сосуда на 60 % и более, а также при изъязвленных бляшках от 50 % и более; • у пациентов с асимптомными поражениями или хроническим течением СМН операция показана при гомогенных бляшках, суживающих просвет сосуда на 70 % и более, при гетерогенных и гипоэхо-генных, а также изъязвленных бляшках — от 60 % и более. Каротидная ЭАЭ противопоказана больным в сроки до 6 нед после перенесенного инсульта, пациентам с сохраняющимся грубым неврологическим дефицитом после ОНМК в анамнезе с размерами кисты головного мозга от 3—4 см и более. В первом случае имеется высокий риск трансформации ишемического инсульта в геморрагический, а во втором — восстановление нормальной проходимости ВСА не приводит к какому-либо регрессу очаговой симптоматики и сопровождается большой вероятностью кровоизлияния в кисту. Общие противопоказания к операции типичны: 2—3 мес после инфаркта миокарда, печеночная и почечная недостаточность. Принципы выполнения каротидной эндартерэктомии. Указанное хирургическое вмешательство является вторым по частоте среди операций на сердечно-сосудистой системе после аортокоронарного шунтирования. Так, в США в 1971 г. было выполнено 17 000 каротидных эндартерэктомии, в 1979 г. — 54 000, в 1984 г. их количество составило 100 000, а к началу 90-х годов в США была выполнена миллионная каротидная ЭАЭ. Сегодня в этой стране ежегодно проводится около 130 000 каротидных эндартерэктомии. Принципиальной задачей, требующей разрешения во время каротидной эндартерэктомии, является защита головного мозга от ишеми-ческого повреждения на момент пережатия ВСА. Среди пациентов с каротидными стенозами большинство хорошо толерирует пережатие ВСА в течение безопасного срока (в среднем до 60 мин), но 10—15 % больных вследствие функциональной или анатомической несостоятельности виллизиевого круга и/или на фоне нарушения кровотока по нескольким магистральным артериям головного мозга не способны компенсировать прекращение кровотока по пережимаемой ВСА. В последнем случае через 2—5 мин после пережатия ВСА начинает развиваться ишемическое повреждение соответствующего полушария. Предотвращение подобного осложнения каротидной ЭАЭ требует определения толерантности головного мозга больного к пережатию ВСА и защиты головного мозга от ишемии во время пережатия ВСА у нетолерантных больных. Способы определения толерантности головного мозга к пережатию ВСА делятся на дооперационные (проба с пережатием сонной артерии под ТКД-контролем) и интраопера-ционные (операция под местной анестезией с сохраненным сознанием больного, измерение индекса ретроградного давления и ТКД-мо-ниторинг). В первом случае больному проводят пробу Матаса (3-минутное придавливание общей сонной артерии к поперечным отросткам позвонков в средней трети шеи) с мониторированием кровотока по гомолатеральной СМА при ТКД. Падение средней скорости кровотока ниже 20 см/с является критическим, после чего перфузия заинтересованного полушария становится неадекватной и больной рассматривается как нетолерантный. Следует отметить, что через 20—30 с после падения скорости ниже 20 см/с может начаться медленный подъем скорости кровотока до стабильно нормальных значе- ний. Если во время пробы появляются спутанность сознания, очаговые неврологические симптомы, то исследование немедленно прекращают и пациента также считают не-толерантным. Необходимо учитывать, что чрескожное пережатие сонной артерии может сопровождаться сдавлением гломуса, проявляющегося тошнотой, возникновением пелены перед глазами, головокружением, что может быть расценено как возникновение неврологического дефицита, но в действительности не является таковым. Для предупреждения эффекта раздражения каротидного тельца сонную артерию следует пережимать как можно ниже угла нижней челюсти. Интраоперационное ТКД-монито- внутреннего шунта в сонной артерии (другими методами сделать это невозможно или очень сложно), оценивать эффективность реконструкции немедленно после восстановления кровотока по ВСА (по приросту скорости кровотока в СМА), учитывать вероятность развития гиперперфузии мозга в послеоперационном периоде (при значительном приросте скорости кровотока после снятия зажима с ВСА) и принимать меры по предупреждению указанного синдрома, выявлять материальные эмболы, попадающие в интракраниальные сосуды из зоны реконструкции. Применение местной анестезии во время каротидной ЭАЭ позволяет быстро выявить нарушения сознания и/или развитие очагового дефицита у больного за счет постоянного контакта последнего с анестезиологом и операционной бригадой и начать мероприятия по защите мозга. Подробнее особенности местной анестезии при данном вмешательстве будут освещены ниже. Индекс ретроградного АД в сонной артерии отражает степень коллатеральной компенсации кровотока в выбранном полушарии. Если отношение ретроградного АД к ан-теградному АД при прямом измерении в общей сонной артерии составляет не меньше 1/3но при этом абсолютное значение ретроградного АД выше 40 мм рт.ст. и кривая его изображения на экране монитора имеет отчетливый пульсовой характер, а не выглядит в виде изолинии, то считается, что больной толери-рует пережатие ВСА. Подробнее методика указанного измерения будет рассмотрена ниже. Существует 6 методов защиты мозга при его нетолерантности к пережатию ВСА: общая и кранио-церебральная (местная) гипотермия, фармакозащита (барбитураты и др.), общая анестезия, искусственная гипертензия и внутреннее шунтирование. Первые четыре метода снижают метаболические потребности мозга и/или повышают устойчивость клеточных мембран к ишемическому повреждению, последние два обеспечивают приток крови к мозгу коллатеральным или магистральным путем. Оба вида гипотермии и лекарственная защита сегодня имеют больше исторический интерес и рутинно не используются в каротидной хирургии по различным причинам: из-за трудоемкости, малой или недоказанной эффективности. С помощью проведения искусственной гипертензии возможно улучшение коллатеральной компенсации во время пережатия ВСА при индексе ретроградного давления, близком к 1/3или его абсолютном значении около 40 мм рт.ст. Оптимальным методом повышения АД в данной ситуации является введение следов мезатона, а оптимальным уровнем повышения АД служит показатель, на 20 % превышающий исходное («рабочее») АД больного. Такое повышение в большинстве ситуаций достаточно для достижения адекватной коллатеральной компенсации без использования внутреннего шунтирования и в то же время не настолько значительно, чтобы способствовать развитию кардиальных осложнений. Наиболее адекватным методом защиты головного мозга от ишеми-ческого повреждения является использование временного внутрипрос-ветного (внутреннего) шунтирования на момент пережатия ВСА, позволяющего добиться антеградного поступления крови в соответствующее полушарие. Сущность метода заключается в том, что после пережатия сонных артерий и выполнения артериотомии в просвет внутренней и общей сонной артерии вводят специальную силиконовую трубку, через которую в мозг поступает кровь на этапе реконструкции ВСА. Перед пуском кровотока по ВСА по завершении реконструкции шунт удаляют. Существует несколько типов внутренних шунтов для каротидной ЭАЭ (мягкие и жесткие, прямые и петлеобразные, с концевыми внутрипросветными фиксато- рами и без таковых, с боковым отводом и без него), но мы предпочитаем прямые жесткие непережимае-мые шунты без фиксаторов по соображениям, изложенным ниже. Несмотря на заманчивость применения внутреннего шунтирования в каротидной хирургии из-за соображений безопасности вмешательства, само по себе введение шунта несет риск развития осложнений, а также ограничивает экспозицию внутренней поверхности артерии, перекрываемой самим шунтом. Основные осложнения, связанные с применением внутреннего шунтирования, возникают на этапе введения шунта: • материальная эмболия головного мозга продуктами дезорганизации бляшки при введении дисталь-ной порции шунта во ВСА; • воздушная эмболия головного мозга; • расслоение дистальным концом шунта внутренней сонной артерии с перфузией ложного канала, отсутствием перфузии головного мозга и возможным распространением расслоения в интракраниальные отделы ВСА и ее ветвей. Для предотвращения указанных осложнений мы придерживаемся следующих принципов внутреннего шунтирования во время каротидной ЭАЭ. На держалку ОСА надевают турникет, сонные артерии пережимают и вскрывают просвет ОСА с переходом на ВСА. Протяженность артериотомии должна быть такова, чтобы разрез артерии начинался на 0,5—1 см проксима-льнее и заканчивался на 0,5—1 см дистальнее бляшки. Хирург должен видеть полностью свободный просвет артерии при введении шунта, что значительно снижает возможность материальной эмболии и расслоения ВСА. Введение шунта через участок артериотомии, содержащий атеросклеротическую бляшку, недопустимо и очень опасно из-за возможности ее фрагментации. Вторым принципиальным моментом является то, что сначала шунт вводят во ВСА, и через проксимальный конец шунта начинает ретроградно поступать кровь из мозга, вымывая возможные воздушные и материальные эмболы. Далее турникет на ОСА аккуратно частично распускают и шунт на ретроградной струе крови вводят в ОСА, а турникет затягивают окончательно. Такая последовательность полностью исключает возможность попадания материальных и воздушных эмболов в мозг, что весьма вероятно при первоначальном введении шунта в ОСА, когда мощная центральная струя крови способна смыть в дис-тальное русло как воздух из вскрытого артериального сегмента, так и частицы бляшки. К осложнениям со стороны уже установленного шунта относятся его тромбоз и выпадение. Для выявления закупорки шунта мы пользуемся данными ТКД-мониторин-га — единственного метода, позволяющего своевременно принять решение о смене шунта. Последнее осложнение, связанное с внутренним шунтированием, относится к моменту удаления шунта. Если оставить непрошитым значительный участок линии шва артерии, то удалить шунт любого типа достаточно легко. Но в такой ситуации на дошивание артериотомии может понадобиться продолжительное время, тогда как абсолютно безопасный период времени на введение или удаление шунта составляет 2 мин. В случае крупных размеров сонных артерий возможно наложение пристеночного зажима на непрошитый участок линии шва для завершения последнего, но это технический прием далеко не всегда доступен. Если оставить непрошитым короткий участок линии шва, который может быть быстро дошит, то удаление шунта с усилием через маленькое отверстие чревато разрывом нити или ее проре- зыванием. Для профилактики указанного осложнения мы используем следующий технический прием. Линию шва прошивают полностью до точки завязывания обеих нитей, которую намечают в ОСА (ее больший диаметр позволяет легче удалить шунт, чем из ВСА). Далее на расстоянии, достаточном для беспрепятственного удаления шунта (обычно по 1 см для каждой из нитей), обе нити распускают в такой мере, чтобы образовать свободное отверстие в линии шва. После удаления шунта обе нити полностью затягивают и связывают, после чего можно пускать кровоток. Если в такой ситуации использовать не прямой, а петлеобразный шунт или шунт с боковым отводом, то максимально сблизить обе сшивающие нити становится труднее, так как у этих типов шунтов из просвета артерии выступают либо оба колена петли, либо боковой отвод, которые гораздо больше по размеру, чем лигатура, удерживающая прямой шунт. Очередность удаления шунта из ВСА или ОСА не имеет значения, так как в любом случае либо через шунт, либо через ВСА ретроградно отмываются возможные эмболы и воздух, иногда оба конца шунта могут быть удалены одномоментно. Мы считаем, что внутреннее шунтирование при каротидной ЭАЭ должно применяться только выборочно, у больных, не толерантных к пережатию ВСА. Несмотря на то что при строгом соблюдении описанных мер предосторожности угроза связанных с использованием внутреннего шунта осложнений минимальна, расширение показаний к этому способу защиты мозга до рутинного применения повышает суммарный риск каротидной ЭАЭ в общей группе пациентов со стенозами ВСА. Методика местной анестезии при каротидной ЭАЭ, представляющая собой сочетание проводниковой и инфильтрационной анестезии, была внедрена A.Imparato. Концентрация используемого анестетика составляет 0,5 %, с позиций длительности эффекта предпочтительнее использовать лидокаин. Проводниковый компонент анестезии направлен на блокаду шейного сплетения на уровне Ci—Civ, чем обеспечивается обезболивание тканей шеи на стороне операции. Шприцем вместимостью 2 мл через подкожную иглу вводят анестетик на стороне операции в 4 точках в проекции линии, соединяющей поперечные отростки четырех первых позвонков. Расстояние между точками на коже составляет приблизительно 1 — 1,5 см. Недоступный пальпации поперечный отросток I позвонка проецируется сразу под нижней точкой сосцевидного отростка. В каждую точку вводят по 2 мл анестетика. Далее 10-милли-литровым шприцем через точки на коже иглу проводят до упора в поперечный отросток каждого из четырех указанных позвонков, предваряя движение введением анестетика в незначительном количестве. Далее иглу несколько подтягивают и направляют вглубь на 1—1,5 см по передней поверхности поперечного отростка в том же направлении, также предваряя движение введением анестетика. Поршень подтягивают на себя для исключения попадания иглы в одну из вен позвоночного сплетения. Введение анестетика в эти вены способно приводить к серьезным неврологическим нарушениям вплоть до потери сознания и появления очаговой симптоматики. Далее на достигнутой глубине в каждую точку вводят 10—15 мл анестетика. Инфильтрацию анестетика по линии кожного разреза выполняют во вторую очередь. При выделении сонных артерий анестетик вводят периадвентициально в ОСА в нижнем углу раны и в каротидное тельце для предупреждения рефлектор- ной брадикардии. Следует помнить, что проводниковая анестезия на уровне CI—CIV не приводит к полному обезболиванию верхних отделов кивательной мышцы, мышц диафрагмы рта и двубрюшной мышцы. При необходимости проведения манипуляций в этой зоне (тракция крючками и ранорасши-рителями, рассечение мышц) требуется дополнительная инфильтраци-онная анестезия. При отсутствии толерантности к пробному пережатию ОСА или исчезновению исходной толерантности на основном этапе операции под местной анестезией больному вводят внутренний шунт, интубиру-ют его и вмешательство продолжают под общим обезболиванием. Необходимость экстренного проведения указанных мероприятий в достаточной мере затрудняет работу коллектива операционной, так как и анестезиологи, и хирурги вынуждены одновременно манипулировать практически в единой анатомической области. К преимуществам местной анестезии при каротидной ЭАЭ относятся наиболее точный контроль за состоянием сознания и неврологическим статусом пациента и возможность сохранения самостоятельного дыхания у больных с тяжелыми респираторными заболеваниями. Самым главным недостатком этой методики обезболивания служит выраженное психоэмоциональное угнетение пациента, которое заставило нас ограничить показания к местной анестезии из-за значительной частоты кардиальных осложнений в сравнении с теми же операциями под общей анестезией. Кроме того, современные ингаляционные анестетики снижают кислородную потребность нейронов и повышают мозговой кровоток, что способствует защите мозга от ишемии (см. выше). При удлинении времени операции более 1,5—2 ч действие местного анестетика осла- бевает или может заканчиваться, что требует повторной инфильтрации тканей. В настоящее время мы определяем показания к каротидной ЭАЭ под местной анестезией при отсутствии других (инструментальных) возможностей определения толерантности головного мозга к пережатию ВСА и у больных с тяжелыми дыхательными расстройствами, которые могут усугубиться во время искусственной вентиляции легких и потребовать продолженной респираторной поддержки. Техника каротидной эндартерэк-томии. Больной находится на операционном столе в положении на спине с несколько приподнятым головным концом (полусидячее положение). Под лопатки пациента подкладывают валик и голову максимально отворачивают в сторону, противоположную стороне операции. Операционное поле обклеивают 4 простынями: верхняя — по нижнему краю нижней челюсти так, чтобы угол челюсти выступал в качестве ориентира в операционное поле; внутренняя — по средней линии шеи от подбородка до яремной вырезки; нижняя — по нижнему краю ключицы на всем протяжении и наружная — от сосцевидного отростка по переднему краю трапециевидной мышцы до плечеключичного сочленения так, чтобы мочка уха в качестве ориентира выступала в операционное поле между верхней и латеральной простынями. Разрез кожи начинают от нижнего края сосцевидного отростка (только сзади ушной раковины, так как спереди возможно повреждение ветвей лицевого нерва) параллельно и на 1—2 см ниже нижней челюсти; достигнув проекции внутреннего края кивательной мышцы под углом нижней челюсти, плавно поворачивают и продлевают разрез книзу по проекции указанного края до границы сред-
Рис. 5.87. Выделена бифуркация ОСА. ней и нижней трети шеи. Следует учитывать возможность повреждения ветвей лицевого нерва (краевой нижнечелюстной нерв), из-за чего разрез не должен достигать границ нижней челюсти. Одномоментно с кожей рассекают подкожную клетчатку и подкожную мышцу (m.platysma). В верхнем углу через рану может проходить чувствительный большой ушной нерв, ин-нервирующий нижнюю и заднюю части ушной раковины и околоушную область сзади. При возможности следует сохранять его целость, так как пересечение указанного нерва сопровождается развитием стойкого онемения в этой зоне. Если ушной нерв ограничивает экспозицию, то его коагулируют и рассекают. Для доступа к ОСА требуется пересечение крупной лицевой вены, впадающей во внутреннюю яремную. Оба конца пересеченной вены прошивают, так как простое завязывание лигатур из-за крупных размеров лицевой вены часто приводит к негерметичности ее культей и чревато развитием обильного кровотечения в послеоперационном периоде. Периад-вентициально в ОСА вводят 1 мл 0,5 % раствора лидокаина (позднее такое же количество инъецируют в гломус для предупреждения рефлекторной брадикардии), на арте- рию накладывают держалку и после рассечения клетчатки кверху по ходу сосуда выделяют каротид-ную бифуркацию. До начала манипуляций на бифуркации ОСА необходимо составить точное представление о местоположении и направлении хода подъязычного нерва, обычно расположенного по нижнему краю заднего брюшка двубрюшной мышцы на 1—2 см выше бифуркации, косо перекидывающегося снаружи кнутри и сверху вниз через начальные отделы ВСА и НСА. По латеральному краю ВСА от подъязычного нерва отходит ветвь верхнего корешка (radix superior), направляющаяся вниз по ходу сосудисто-нервного пучка шеи и образующая шейную петлю (ansa cervicalis). Далее выделяют верхнюю щитовидную артерию, отходящую в начальном отделе НСА, и последнюю берут на держалку. Ствол НСА обычно выделяют до уровня отхождения язычной артерии, но если атероск-леротическое поражение НСА распространяется выше, то проводят мобилизацию артерии на протяжении (рис. 5.87). Самым главным условием выделения непосредственно ВСА является минимальный контакт с артерией. Мы не обходим ВСА держалкой, а перемещение артерии в ране во время мобилизации осуществляем с помощью держалок на НСА, в меньшей степени на ОСА. Если этих приемов недостаточно, то допустима фиксация ВСА только за адвентицию. После выделения начального отдела ВСА (2—3 см) оценивают ее проходимость и локализацию бляшки путем осторожной пальцевой ревизии, слегка проводя пальцем по поверхности артерии. Недопустимо сжимание артерии пинцетом, грубое надавливание и т.д., так как это может привести к фрагментации атероматозной бляшки и дистальной эмболии. Именно на этапе выделения ВСА отмечается наибольшее число инт-раоперационных нарушений мозгового кровообращения. Если поражение ВСА распространяется выше, то дальнейшее выделение сосу Дата добавления: 2015-02-06 | Просмотры: 4535 | Нарушение авторских прав |