|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
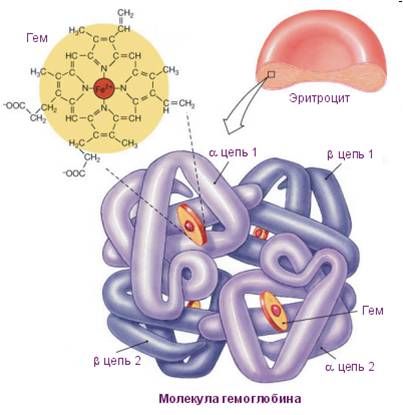
Строение и функции гемоглобинаГемоглобин – главный компонент эритроцита и основной дыхательный пигмент, обеспечивает перенос кислорода (О2) из легких в ткани и углекислого газа (СО2) из тканей в легкие. Кроме того, он играет существенную роль в поддержании кислотно-основного равновесия крови. Подсчитано, что в одном эритроците содержится ~340 000 000 молекул гемоглобина, каждая из которых состоит примерно из 103 атомов. В крови человека в среднем содержится ~750 г гемоглобина. Гемоглобин представляет собой сложный белок, относящийся к группе гемопротеинов белковый компонент в котором представлен глобином, небелковый – четырьмя одинаковыми железопорфириновыми соединениями, которые называются гемами. Атом железа (II), расположенный в центре гема, придает крови характерный красный цвет (см. рис. 1). Наиболее характерным свойством гемоглобина является обратимое присоединение газов О2, СО2 и др.
Рис. 1. Структура гемоглобина Было установлено, что гем приобретает способность переносить О2 лишь при условии, что его окружает и защищает специфический белок – глобин (сам по себе гем не связывает кислород). Обычно при соединении О2 с железом (Fe) один или более электронов необратимо переходят с атомов Fe на атомы О2. Иными словами, происходит химическая реакция. Экспериментально было доказано, что миоглобин и гемоглобин обладают уникальной способностью обратимо связывать O2 без окисления гемового Fe2+ в Fe3+. Таким образом, процесс дыхания, который на первый взгляд кажется столь простым, на самом деле осуществляется благодаря взаимодействию многих видов атомов в гигантских молекулах чрезвычайной сложности. В крови гемоглобин существует, по крайней мере, в четырех формах: оксигемоглобин, дезоксигемоглобин, карбоксигемоглобин, метгемоглобин. В эритроцитах молекулярные формы гемоглобина способны к взаимопревращению, их соотношение определено индивидуальными особенностями организма. Как и любой другой белок, гемоглобин имеет определенный набор характеристик, по которым его можно отличить от других белковых и небелковых веществ в растворе. К таким характеристикам относятся молекулярная масса, аминокислотный состав, электрический заряд, химические свойства. На практике чаще всего используются электролитные свойства гемоглобина (на этом основаны кондуктивные методы его исследования) и способность гема присоединять различные химические группы, приводящие к изменению валентности Fe и окраски раствора (калориметрические методы). Однако в многочисленных исследованиях показано, что результат кондуктивных методов определения гемоглобина зависит от электролитного состава крови, это делает затруднительным применение такого исследования в неотложной медицине. Дата добавления: 2014-12-12 | Просмотры: 1162 | Нарушение авторских прав |