|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ИММУННЫЙ ОТВЕТ ГУМОРАЛЬНОГО ТИПАИммунные реакции подразделяют на два типа: гуморальные и клеточные. Первый тип основан на наличии антител, а второй — на действии активированных тимусзависимых лимфоцитов. Для иммунного ответа гуморального типа характерна выработка антител, которые одновременно являются эффекторами В-системы иммунитета. Различают два типа гуморального иммунного ответа: Т-зависимый и Т-независимый. Формирование иммунного ответа происходит в несколько этапов. Первый этап — распознавание антигена лимфоцитами. Поступивший в организм Т-независимый антиген связывается с рецепторами лимфоцита, представляющими собой IgM, встроенные в мембрану В-лимфоцита. Это служит сигналом к дальнейшей пролиферации и дифференцировке. Важную роль в процессе распознавания антигена играют и другие рецепторы, например рецептор к Fc-фрагменту Ig. В зависимости от природы антигена происходят характерные изменения антигенных рецепторов: связывающийся мультивалентный антиген или комплекс «антиген — антитело» вызывают в течение нескольких минут перегруппировку рецепторов, равномерно распределенных на поверхности клетки, на одном из полюсов клетки (образуются так называемые «шапочки»). Затем лимфоцит освобождает свою мембрану от этих «шапочек», содержащих антигенсвязывающие рецепторы, либо отторгая их, либо поглощая путем пиноцитоза. Спустя несколько часов утраченные мембраной лимфоцита антигенсвязывающие рецепторы вновь синтезируются и встраиваются в мембрану. На втором этапе происходит межклеточная кооперация — к индукции иммунного ответа подключаются антигенпре-зентирующие клетки (А-клетки): макрофаги, моноциты, дендро-циты, интерстициальные клетки, клетки Лангерганса, эпидермис, эндотелий, а также Т-лимфоциты. Поскольку не все антигены после связывания с рецепторами В-лимфоцитов могут индуцировать их пролиферацию и дифференцировку, в большинстве случаев для индукции иммунного ответа необходима межклеточная кооперация. Антиген поглощают и перерабатывают преимущественно клетки, способные к фагоцитозу и пиноцитозу. А-клетки с помощью лизосомальных гидролаз расщепляют антиген, а затем выводят на свою поверхность продукты этого расщепления (антигенные детерминанты, которые значительно более иммуногенны, чем на-тивный антиген) и соединяют их с белками антигенной природы главного комплекса гистосовместимости МНС (англ. major hysto-compatibility complex) класса II в пределах одного вида. Затем А-клетка осуществляет презентацию этого комплекса Г-лимфоциту. Субпопуляции Т-лимфоцитов (Т-хелперов и Т-ин- дукторов) имеют специализированные рецепторы для антигенов МНС класса П. Презентация антигена А-клеткой приводит к межклеточной кооперации и формированию двойного сигнала. А-клетки несут антигены и белок МНС класса II, а Т-лимфоциты имеют рецепторы для обеих структур, благодаря чему А-клетки и Т-лимфоциты связываются рецепторами двух типов. В кооперации А-клеток и Т-лимфоцитов участвуют медиаторы — IL-1 и интерферон. IL-1 вырабатывается макрофагами (А-клетки) и выступает в роли дополнительного сигнала для Т-индукторов и Т-хелперов, а интерферон, вырабатываемый Т-лимфоцитами, активируют макрофаги. Таким образом, большинство антигенов становятся иммуно-генными только после переработки макрофагами и представления лимфоцитами. Иммунный ответ на Т-зависимые антигены начинается с активации Т-индукторов. После переработки Т-зависимого антигена А-клетка осуществляет его презентацию Т-индуктору, который вслед за этим начинает вырабатывать и секретировать IL-2 — универсальный стимул для активации эффекторных Т-лимфоцитов независимо от их типа (Т-хелпер, цитотоксическая Т-клетка). Действие IL-2 направлено в основном на клетки-предшественники соответствующих эффекторных лимфоцитов, вызывая диф-ференцировку и пролиферацию антигенстимулированного клона. Презентация антигена приводит к стимуляции индукторных клеток и экспрессии рецепторов для IL-2, а продукция IL-2, в свою очередь, способствует их собственной активации. Презентирующие антиген А-клетки взаимодействуют с анти-генспецифическими лимфоцитами через их рецепторы и стимулируют Т-индукторы и предшественники эффекторных Т-лимфоцитов. Стимулированные индукторы начинают продуцировать IL-2, активируя таким образом кооперирующихся с ними через А-клетку антигенстимулированных предшественников других типов Т-клеток (покоящиеся, не стимулированные лимфоциты не несут на своей поверхности рецепторов к IL-2 и не могут быть им активированы). Оптимальный иммунный ответ реализуется только при взаимодействии Т- и В-клеток: В-лимфоциты распознают детерминанты гаптена, а Т-клетки — носителя. Вторичная иммунная реакция на гаптен возможна только в случае, если после контакта с антигеном образуются клетки памяти, специфичные как к гаптену, так и к носителю (к носителю специфичны Т-хелперные клетки). Взаимодействие Т-хелпера с В-лимфоцитом осуществляется следующим образом. Известно, что Т- и В-лимфоциты связаны друг с другом антигенным мостиком. При этом определенную роль может играть особое представление антигена через Т-клетку, что служит стимулом для В-клетки. По аналогии с А-клетками В-клетки тоже могут осуществлять презентацию антигена в комп- лексе с белками МНС класса II, а поскольку Т-лимфоциты (индукторы и хелперы) несут эти структурные рецепторы, то между Т- и В-лимфоцитами возникает достаточно прочная связь, а такая кооперация служит сигналом для В-клетки. Кроме того, на В-клетки действуют также растворимые медиаторы Т-хелперов — антигенспецифические и антигеннеспецифичес-кие хелперные факторы. Антигеннеспецифические хелперные факторы вырабатываются и секретируются стимулированными антигеном и активированными IL-2 Т-лимфоцитами. Фактор действует непосредственно на В-лимфоциты, стимулированные антигеном. Его действие облегчается благодаря формирующемуся антигеном мостику, соединяющему В-лимфоцит с Т-лимфоцитом. Активация В-лимфоцитов Т-клетками может происходить и при участии макрофагов, осуществляющих презентацию антигена, в частности, антигенспецифические В- и Т-лимфоциты посредством рецепторов связываются с одним и тем же макрофагом, что обеспечивает оптимальные условия для межклеточной кооперации. Аналогичная ситуация возникает и в том случае, когда макрофаги с помощью собственных Fc-рецепторов связывают антитела. Это происходит прежде всего при вторичном иммунном ответе, поскольку при первичном антитела еще отсутствуют. На третьем этапе благодаря клеточной кооперации начинается биосинтез антител: активируются структурные гены, кодирующие синтез константного и вариабельного фрагментов иммуноглобулинов. Биосинтез тяжелых (Н) и легких (L) цепей иммуноглобулинов происходит на полисомах. Вся полипептидная цепь сразу синтезируется в соответствии со структурой мРНК. L-цепь синтезируется в течение 30...45 с, а Н-цепь в два раза дольше. Н- и L- цепи выделяются в эндоплазматический ретикулум, где они быстро объединяются в полную молекулу иммуноглобулина. Сначала образуются мономерные молекулы, это справедливо и для IgM, и IgA. Если синтез отдельных цепей и их соединение в целую молекулу протекают довольно быстро, то транспортировка этой молекулы к мембране клетки и встраивание углеводородов продолжается полчаса, причем последние углеводороды могут встраиваться непосредственно перед секрецией иммуноглобулина или во время транспортировки молекулы через мембрану. Антителообразующие клетки вырабатывают также и J-цепи, которые необходимы только для полимерных иммуноглобулинов. Образование полимера, например IgM, происходит непосредственно перед началом секреции и сопровождается встраиванием J-цепи. Регуляция выработки антител. Первичный иммунный ответ. Как правило, иммунный ответ складывается из трех этапов.
В латентной фазе циркулируют в крови лишь свободные антигены, а антитела отсутствуют, поскольку все образующиеся в эту фазу антитела связываются с антигенами в иммунные комплексы, которые элиминируются (выводятся) организмом. Эта фаза длится около недели. Далее следует log-фаза. Она характеризуется синтезом специфических антител и нарастанием их количества в сыворотке крови. По достижении максимального уровня (пик-фаза) синтез антител может прекратиться, а вследствие катаболизма Ig их общая концентрация начинает снижаться. Вторичный иммунный ответ возникает при повторном контакте организма с антигеном. По сравнению с первичным он отличается более короткой латентной фазой, интенсивным антителообразованием и более высоким максимальным уровнем антител, который сохраняется в крови несколько месяцев. Это явление имеет важное значение для клиники, так как достигнутый высокий уровень иммунитета обеспечивает организму лучшую защиту. Во многом это обусловлено образованием долго-живущих клеток памяти (малые лимфоциты), которые вовлекаются в пролиферацию и синтез антител при повторном контакте с антигеном. Дальнейшее введение антигена после вторичных реакций также повышает титр антител. Продолжительность этого процесса зависит и от самого антигена, то есть от того, какое количество таких гипериммунизаций необходимо провести, чтобы достичь максимального титра антител. После достижения максимальной концентрации дальнейшее введение антигена может привести к снижению титра антител, что связано либо с механизмом регуляции по типу обратной связи, либо с выработкой клеток-супрессоров. В процессе иммунного ответа меняется уровень антител. Тимус-независимые антигены стимулируют синтез только IgM. Тимусза-висимые антигены сначала индуцируют выработку преимущественно высокомолекулярных антител (IgM), а затем низкомолекулярных Ig (IgG и IgA), причем при первичном иммунном ответе выработка IgM значительно опережает по времени синтез IgG, а фаза выработки IgG оказывается более продолжительной. При вторичном иммунном ответе синтез IgM и IgG начинается почти одновременно, причем IgG синтезируются более активно. Эти различия обусловлены разной степенью диффе-ренцировки В-лимфоцитов к началу реакции. До контакта с антигеном в крови присутствуют клетки, которые первоначально могут синтезировать только /gM-антитела. Под действием Т-лимфоцитов происходит переключение синтеза с IgM на IgG и IgA. Параллельно в ходе первичного иммунного ответа появляются классоспецифические клетки памяти для IgM, IgG, IgA, IgE, но не для IgD. При повторном контакте с антигеном Морфофшиологи- Дифференциация Клетки Функциональные ческие изменения В-лимфоцитов «памяти» особенности плазмоцитов Рис. 4.4. Схема антитело-образования активируются эти клетки памяти, усиливается их пролиферация с последующим биосинтезом определенного класса Ig (рис. 4.4). АНТИТЕЛА Антителам присущи следующие основные биологические свойства. 1. Специфичность — способность Ig реагировать только с определенным антигеном, что обусловлено наличием у них антидетерминант, контактирующих с соответствующими детерминантами. 2 Валентность — количество антидетерминант в молекуле антитела. Чаще всего антитела бивалентны, но существуют 5- и даже 10-валентные. 3. Аффинность, аффинитет — прочность соединения между детерминантами (эпитопом) антигена и антидетерминантами (пара-топом) антигена. 4 Авидность — прочность связи антигена с антителом, ълаго-даря поливалентности антигена связь между двумя антигенами осуществляется при помощи нескольких антител. 5. Гетерогенность — неоднородность, обусловленная наличием трех видов антигенных детерминант: A. Изотипические, характеризующие принадлежность Ig к оп Б. Аллотипические, соответствующие аллельным вариантам иммуноглобулина; B. Идиотипические, отражающие индивидуальные особеннос Организм способен реагировать на поступление чужеродных антигенов синтезом белков, обладающих специфическим срод- ством с антигеном, вызвавшим этот синтез. Эти белки получили название антител. Хотя антитела отличаются друг от друга не только по способности связывать разные антигены, но и по своим физико-химическим свойствам, структурно все они сходны. Эта высокоспециализированная группа белков, построенных из поли-пептидных цепей двух основных типов (легких и тяжелых), получила название иммуноглобулинов. Иммуноглобулины синтезируются в пузырьках пластинчатого аппарата (Гольджи) В-лимфоцитов. По мере созревания пузырек подходит к поверхности клетки, при контакте с ней происходит разрыв наружной мембраны клетки и мембраны пузырька. Свободные иммуноглобулины поступают в плазму, а связанные с мембраной остаются на поверхности клетки. Таким образом, итоговой фазой В-клеточного иммунитета является продукция /g-антител, которая происходит постоянно. Одновременно в организме синтезируются до 105... 107 антител различной специфичности. Интактный В-лимфоцит синтезирует в один час примерно 250...500 молекул IgM и большую часть их отдает в экстрацеллю-лярную жидкость. После специфической антигенной стимуляции и трансформации лимфоцитов в плазматические клетки этот синтез возрастает в тысячи раз. Наиболее полно изучено строение антител, представленных иммуноглобулинами класса G (рис. 4.5). На схеме видно, что молекула IgG под действием протеолити-ческого фермента папаина расщепляется на три больших фрагмента. Два из них идентичны и обладают свойством взаимодействовать с одной молекулой антигена. Они были обозначены как Fab-фрагменты (Fragment antigen binding), связывающие антиген.
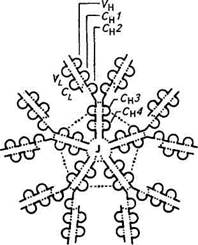
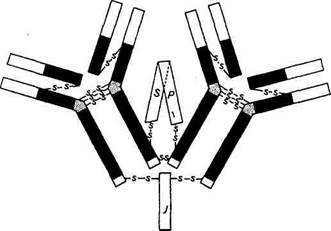
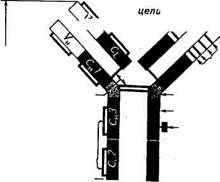
Тяжёлая цепь v*v /^Тяжелая цепь Третий фрагмент, содержащий углеводный компонент, был получен при изучении его свойств в кристаллическом состоянии, за что и назван Fc-фрагментом (Fragment cristalline). В дальнейшем было показано, что Fc-фрагмент взаимодействует с мембранами клеток, выполняя транспортную функцию, фиксацию Cql компонента комплемента и т. д. Все иммуноглобулины — это тетрамеры, состоящие из четырех полипептидных цепей. Две из них представлены длинными (около 450 аминокислотных остатков), или тяжелыми (heavy), Н-цепями, а две другие — короткими (около 220 аминокислотных остатков), или легкими (light), L-цепями. Легкие цепи являются общими для всех классов и подклассов иммуноглобулинов и могут произвольно сочетаться с любой тяжелой цепью. У большинства позвоночных легкие цепи разделяются по антигенным свойствам на два типа — «каппа» (с-тип) и «лямбда» (1-тип). Изучение первичной структуры полипептидных цепей иммуноглобулинов показало, что N-концевые участки тяжелых и легких цепей, включающие около 100 аминокислотных остатков, обладают уникальной структурой и аминокислотной последовательностью. Они представляют собой вариабельные области (V-область) тяжелых (VH) и легких (VL) цепей. Указанные вариабельные области, с одной стороны, образуют антигенсвязывающие центры антител, а с другой — определяют их многообразие. Остальная (С-концевая) последовательность тяжелой и легкой цепей идентична у всех молекул данного класса или подкласса, но различна у молекул, относящихся к разным классам и подклассам. Она носит название константная область (С-область). В зависимости от структуры константной области тяжелых цепей молекулы иммуноглобулинов делят на классы. В настоящее время известно пять классов иммуноглобулинов, обозначаемые как IgA, IgM, IgG, IgD и IgE. Тяжелые цепи иммуноглобулинов каждого класса различаются по своим фи-шко-химическим, антигенным и иммунологическим свойствам. Эти цепи обозначаются греческими буквами в соответствии с латинским обозначением класса иммуноглобулинов: IgA (а-цепь), IgM (m-цепь), IgG (g-цепь), IgD (d-цепь) и IgE (е-цепь). В N-концевой части Н- и L-цепей иммуноглобулинов имеются участки, отличающиеся чрезвычайно высокой вариабельностью (гипервариабельные участки): HI; Н2; НЗ; LI; L2; L3. Каждый из них содержит около шести аминокислотных остатков. Вместе эти участки образуют антигенсвязывающий центр. Цепи иммуноглобулинов состоят из доменов — структурных единиц, содержащих около 110 остатков аминокислот. Тяжелые цепи образуют четыре домена: один вариабельный и три константных, обозначаемые Сн1; Сц2; СцЗ. Легкие цепи содержат но два домена — вариабельному (VL) и константному (Q,). Каждый домен представляет собой плотно упакованную глобулу, так как аминокислотные последовательности обладают определенным
Каждый из Fab-фрагментов состоит из одной L-цепи (VL- и CL-домены) и половины одной Н-цепи (VH- и Сн-Домены), а Fc-фрагмент образован остатками двух Н-цепей, включающих Сн2 и Сн3 домены. Классы иммуноглобулинов различаются по своим химическим и биологическим свойствам. Так, их различная скорость полимеризации выражается в том, что /gG существуют в виде мономера с молекулярной массой 160 000, тогда как IgA состоит из одной или двух, а IgM, как правило, из пяти соответствующих субъединиц. Биологические и иммунологические различия между классами иммуноглобулинов имеют большое практическое значение, так как они обусловливают характер реакции, следующей за образованием комплекса антиген — антитело. Защитное действие антител может выражаться в прямом повреждении микроорганизмов или в нейтрализации синтезируемого ими токсина. Нейтрализация токсина состоит в прямой блокаде токсофорной группы антителами (антигенные и токсинные детерминанты идентичны). Однако связывание токсина и антитела может вызывать и пространственные изменения конфигурации, которые делают невозможной адсорбцию токсина на субстрате — клетке, чувствительной к токсину. Иммуноглобулины класса G оказывают сильное нейтрализующее действие на токсины и вирусы, а также способны к преципитации, обладают опсонизирующим действием (опсонины — греч. Opsonion — снабжение пищей — антитела, в присутствии комплемента стимулирующие поглощение чужеродных частиц, бактерий, вирусов и их разрушение лейкоцитами), усиливая фагоцитоз. При умеренном нагревании IgG может связываться с антителом, т. е. начинается реакция, названная связыванием комплемента, ответственность за которую несет Fc-фрагмент. При этом кроме непосредственной нейтрализации вирусов и токсинов IgG способствуют также зависящему от комплемента фагоцитозу и внутриклеточной инактивации микроорганизмов. На долю IgG приходится около 80 % всех иммуноглобулинов. Более сложной, чем при нейтрализации токсинов, представляется роль антител в разрушении и устранении самого возбудителя. У некоторых грамотрицательных бактерий антитела в связи с неспецифически реагирующими факторами комплемента сыворотки могут вызывать бактериолиз. Антитела и комплемент, однако, не вызывают цитолиз непосредственно, а лишь изменяют вначале поверхность бактериальной клетки таким образом, что она становится доступной действию имеющегося в организме фермента лизоцима. Лизоцим реагирует с мурамилпептидом клеточной стенки и вызывает разрыв в одном или нескольких местах поверхности. Повышение давления внутри клетки, дохо- дящее до 20 ати, приводит к тому, что микроорганизм с поврежденной стенкой лопается. Другой путь возможного действия антител — опсонизация заключается в изменении поверхности микробной клетки таким образом, что она становится более удобной для поглощения ее фагоцитами. Как и бактериолиз, опсонизация протекает на фоне активации комплемента, вызванной реакцией антиген — антитело. В отличие от цитолиза, требующего для своего осуществления присутствия на бактериальной клетке всех девяти факторов комплемента, в опсонизации участвуют только четыре компонента комплемента Q...C4. Особенно выражено опсонизирующее действие антител при колиинфекции новорожденных домашних животных. Большое значение имеют опсонизирующие антитела и для защиты против диплококков и стрептококков. Гладкая поверхность капсулы у диплококков мешает их поглощению фагоцитами. Лишь когда под действием антител их поверхность меняется, т. е. становится шероховатой, они могут быть фагоцитированы и затем уничтожены внутри клетки. Стрептококки поддаются фагоцитозу даже при отсутствии специфических антител, но из-за присутствия особого белка, названного М-антигеном, инактивируются не полностью. Часть их снова выходит из фагоцитов и продолжает размножаться дальше. Антитела, направленные против М-антигена патогенного типа стрептококков, способствуют внутриклеточной инактивации этих микроорганизмов.
Ведущее место в реакциях бактериолиза и опсонизации принадлежит IgM. Этот класс иммуноглобулинов является самым «древним» в филогенетическом отношении. В ходе иммунного ответа вначале также появляются антитела /gM-клас-са. У новорожденных первые антитела принадлежат к IgM. В сыворотке молекулы IgM существуют в виде пентамера с молекулярной массой 950000. Пять мономерных субъединиц расположены радиально, причем Fc-фрагменты направлены к центру круга, а Fab-фрагменты — кнаружи (рис. 4.6). Поскольку IgM в полной мере не способны к нейтрализации токсинов, то животные раннего p„c 4.6. Строение пентамерной структу-
11 — 3389 лее подвержены токсикоинфекциям. IgM составляют примерно 3...10 % иммуноглобулинов сыворотки крови. Характерная особенность структуры IgM определяется тем, что она призвана оказывать особое защитное действие против микроорганизмов и других крупных антигенов, имеющих на своей поверхности антигенную мозаику из повторяющихся детерминантов. Антитела IgM связывают соответствующий антиген каждым из своих пяти участков связывания. Такие повторы антигенных детерминантов характерны для О-антигенов из клеточной стенки грамот-рицательных бактерий, жгутиков бактерий и вирусов, имеющих капсиды. Даже если каждый отдельный участок связывания проявляет лишь небольшую авидность, общая авидность всей молекулы повышается из-за суммирования нескольких таких связей. Если антитела IgM реагируют таким образом с антигеном, то при нахождении антигена близко к поверхности клетки комплемент настолько активируется, что вызывает локализованное повреждение нижележащей клеточной мембраны. Так, единственная молекула IgM в силу активирования комплемента может вызвать лизис клетки (например, бактерии или эритроцита). Антитела класса IgG, напротив, могут вызвать клеточный лизис путем активирования комплемента только в том случае, когда две молекулы антитела вступают в реакцию на поверхности клетки очень близко друг от друга, но для этого необходимо очень много (тысячи) молекул IgG. Если антиген не связан с поверхностью клетки, а существует в свободном виде с множеством детерминантов, то антитела IgM не имеют никаких преимуществ перед IgG- Напротив, их участки связывания, характеризующиеся низкой авидностью, не могут все связываться с одной и той же молекулой антитела и легко диссоциируют. Поэтому антитела IgG более эффективны при нейтрализации бактериальных токсинов и при защите клеток от адсорбирования на них вируса. Сравнение активности антител IgG и IgM по отношению к одному и тому же поверхностному антигену сальмонелл показало, что на основе соотношения масс последние в 20 раз активнее при агглютинации [лат. agglutinatio — склеивание в глыбки (комочки) микробов, эритроцитов или других клеток и выпадение их в осадок в присутствии электролитов] сальмонелл, более чем в 100 раз активнее в инактивации микробной клетки с участием комплемента и более чем в 1000 раз эффективнее в опсонизации микроорганизмов и других клеток. Сывороточные антитела IgA в отличие от IgM и IgG не способны к связыванию комплемента и поэтому не могут вызывать ни иммуноприлипания, ни цитолиза или конглютинации. Считают, что этому классу иммуноглобулинов принадлежит функция защиты организма от проникновения возбудителя и развития инфекции. Этот класс иммуноглобулинов участвует в элиминации пи- щевых и других чужеродных антигенов, которые могут проникнуть в организм через слизистые оболочки, а также в регуляции иммунного ответа на эти антигены. Иммуноглобулины А составляют лишь 10...15 % всех иммуноглобулинов сыворотки. Однако они преобладают в экстра-васкулярных секретах. Большая часть IgA в слюне, слезах, пищеварительных соках, секретах слизистой носа находится в виде секреторного IgA (SIgA), т. е. полимерной формы, состоящей из двух /gA-мономеров, соединяющей молекулы гликопротеина, называемого секреторным компонентом. Биологическая роль секреторного компонента сводится к повышению устойчивости IgA от разрушения протеолитическими ферментами (рис. 4.7).
Иммуноглобулин ыЕ — это мономеры, содержание которых в сыворотке крови ничтожно мало — 0,00005...0,0003 г/л, или 0,002 % общего количества Ig. За сутки их синтезируется 0,02 мг/кг; период полураспада в сыворотке крови составляет 2...3 сут, а в коже — 9...14сут. К классу IgE относится основная масса аллергических антител-реагинов. Уровень их значительно повышается у организмов, страдающих аллергией и зараженных гельминтами. IgE связываются с Fc-рецепторами тучных клеток и базофилов. При контакте с аллергеном образуются мостики IgE — антиген — IgE, что сопровождается поступлением ионов кальция в клетку-мишень, активацией в ней биохимических процессов и выделением биологически активных веществ, вызывающих аллергические реакции немедленного типа. Эозинофильный хемотаксический фактор, выделяемый тучными клетками, способствует аккумуляции
эозинофилов и деструкции гельминтов. Предполагается также, что IgE, покрывая паразита, аккумулирует макрофаги благодаря Fc-рецепторам этих клеток. Иммуноглобулины D — это мономеры; их содержание в крови составляет 0,03...0,04 г/л, или до 1 % общего количества иммуноглобулинов. В сутки их синтезируется от 1 до 5 мг/кг, а период полураспада колеблется в пределах 2...8 сут. IgD участвуют в развитии местного иммунитета, обладают антивирусной активностью, в редких случаях активируют комплемент. Плазматические клетки, секретирующие IgD, локализуются преимущественно в миндалинах и аденоидной ткани. IgD выявляются на В-клетках, отсутствуют на моноцитах, нейтрофилах и Т-лимфоцитах. Полагают, что IgD участвуют в дифференцировке В-клеток, способствуют развитию антиидиотипического ответа, участвуют в аутоиммунных процессах. Основная масса IgM и IgD находится в плазме, a IgG и IgA распределяются примерно в одинаковых соотношениях между плазмой и межсосудистой тканью. Дата добавления: 2015-12-15 | Просмотры: 1267 | Нарушение авторских прав |

 Гипервариабельные участки легкой цепи Лёгкая м цепь
Гипервариабельные участки легкой цепи Лёгкая м цепь сходством друг с другом. И эти участки полипептидной цепи замыкаются внутрицепочной дисульфидной связью.
сходством друг с другом. И эти участки полипептидной цепи замыкаются внутрицепочной дисульфидной связью.