|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
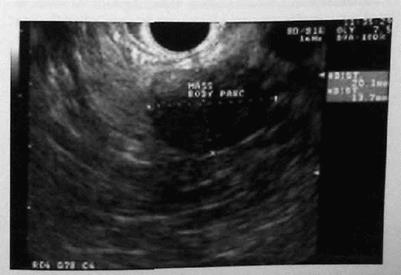
Диагностика и определение локализацииТрадиционно, триада Виппля [Whipple] подводила итог клинической картины и диагноза у пациента с инсулиномой. Эта триада состоит из индукции признаков и симптомов гипогликемии после ограничения приема пищи или физических упражнений, характерного снижения уровня глюкозы плазмы крови меньше 50 мг/дл, и уменьшения симптомов после перорального или внутривенного введения глюкозы. Эта триада имеет недостатки в точности и надежности, которые необходимы для современного диагноза. Сегодня диагноз инсулиномы требует проведения радиоиммунологического исследования инсулина сыворотки крови и демонстрации того, что циркулирующий инсулин неадекватно увеличен по сравнению с уровнем глюкозы крови. После мониторируемого голода до развития симптомов гипогликемии или немногим ранее, чем через 72 часа, обычно измеряются концентрации инсулина и глюкозы плазмы крови. Примерно у 3/4 пациентов развивается гипогликемия и ее симптомы в течение 24 часов, а практически у всех пациентов (90-95%) – в течение 48 часов. Соотношение инсулин-глюкоза, составляющее больше 0,4, говорит о наличии инсулиномы. Уровни C-пептида и проинсулина также повышены у пациентов с инсулиномой. Провокационные тесты с толбутамидом, глюкагоном или внутривенным введением кальция редко требуются для диагностики инсулиномы. Эти исследования должны использоваться с осторожностью, поскольку они могут вызвать опасную гипогликемию. Дифференциальная диагностика инсулиномы проводится с реактивной гипогликемией, хронической надпочечниковой недостаточностью, гипопитуитаризмом, печеночной недостаточностью, патомимической (искусственно вызванной) гипогликемией, ферментативными дефектами и незидиобластозом. Гипогликемия при инсулиноме обычно встречается при голодании или после физических упражнений, тогда как реактивная гипогликемия возникает после еды. Измерение уровней циркулирующего проинсулина и C-пептида может помочь исключить патомимическую гипогликемию, поскольку эти вещества не присутствуют при введении коммерчески доступных препаратов инсулина. Скрининг сыворотки крови и мочи на выявление метаболитов сульфонилмочевины может исключить их тайное употребление. Незидиобластоз или первичная гиперплазия островковых клеток может потребовать взятия биопсии во время операции для дифференциальной диагностики с инсулиномой. У большинства пациентов с инсулиномой имеет место солитарная доброкачественная аденома. Эти аденомы встречаются с одинаковой частотой в головке, теле и хвосте поджелудочной железы. Множественные аденомы встречаются у 10% пациентов, чаще у больных с MEN I. Кроме того, у 10% пациентов имеют место злокачественные инсулиномы, представленные либо локальным распространением, либо метастазами. Большинство инсулинóм меньше 1,5 см в диаметре. Многие из них полностью окружены тканью поджелудочной железы и не видны на ее экспонированной поверхности. До появления возможности предоперационных исследований определения локализации и интраоперационного УЗИ 25% инсулинóм не выявлялись во время операции, несмотря на полное хирургическое обследование поджелудочной железы. Предоперационное определение локализации опухоли может быть чрезвычайно полезным для хирурга и уменьшить число безрезультатных ревизий. Трансабдоминальное УЗИ, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) не всегда могут определить локализацию инсулинóм, вследствие их малых размеров. Из-за широкого распространения, однако, КТ обычно является первым из выполняемых исследований по определению локализации опухоли, обнаруживая как минимум две трети поражений. При наличии возможности использование двухфазной спиральной КТ-технологии более чувствительно для выявления небольших инсулинóм. КТ и МРТ полезны при идентификации наличия или отсутствия метастазов в перипанкреатических лимфатических узлах или в печени. Поскольку только 30% инсулинóм обладают рецепторами к соматостатину II типа, значение сцинтиграфии рецепторов соматостатина (СРС) ограничено. Исторически сложилось, что селективная ангиография поджелудочной железы была исследованием выбора для выявления инсулинóм, которые обычно очень хорошо васкуляризированы. Чрескожный чреспеченочный порто-венозный сэмплинг и внутриартериальная стимуляция кальцием с печено-венозным сэмплингом еще более чувствительны. При чрескожном чреспеченочном порто-венозном сэмплинге, забор инсулина из вен поджелудочной железы может помочь идентифицировать локализацию инсулиномы. Печеночно-венозный сэмплинг включает селективную инфузию кальция в ветви чревного ствола и верхней брыжеечной артерии с осуществлением забора крови из печеночных вен для выявления инсулина. Это инвазивные, дорогие, отнимающие много времени и технически сложные процедуры должны быть предназначены для персистирующего или рецидивирующего заболевания или при безуспешности другие исследований. Эндоскопическое УЗИ (ЭУЗИ) предлагает другой подход для предоперационного определения локализации инсулинóм (рис. 19). Опухоли в головке поджелудочной железы легко визуализируются, тогда как опухоли в дистальной части железы менее подходят для оценки с помощью ЭУЗИ. Качество ЭУЗИ зависит от оператора и требует седации пациента. Сообщается, что чувствительность и специфичность этой методики при обнаружении эндокринных опухолей поджелудочной железы составляет больше 90%. Комбинация ЭУЗИ и двухфазного КТ-сканирования должна выявлять почти все инсулиномы.
Рис. 19. ЭУЗИ инсулиномы.
Развитие интраоперационного УЗИ значительно улучшило идентификацию инсулинóм во время интраоперационной ревизии. Польза интраоперационного УЗИ подчеркивается тем фактом, что некоторые хирурги подвергают сомнению необходимость предоперационных исследований по определению локализации опухоли. Хирургическая ревизия и пальпация в комбинации с интраоперационным УЗИ могут помочь локализовать 95-100% инсулинóм.
Лечение Медикаментозное лечение инсулинóм состоит из диетических мероприятий, минимизирующих опасность возникновения опасной гипогликемии. Разумный интервал между приемами пищи является решающим в устранении гипогликемии. Диазоксид ингибирует секрецию инсулина и может использоваться для предупреждения гипогликемии во время подготовки пациента к операции. Его негативные побочные эффекты включают выраженный отек и гирсутизм. Аналоги соматостатина, типа октреотида, также могут контролировать симптомы инсулиномы. Адекватное лечение при инсулиноме – оперативное удаление опухоли. Большинство аденом можно энуклеировать независимо от их локализации. Должна быть проявлена осторожность, чтобы не повредить панкреатический проток, выполняя энуклеацию. Для удаления опухолей, расположенных рядом с главным панкреатическим протоком, может потребоваться дистальная резекция поджелудочной железы, если они находятся в хвосте. Интраоперационное УЗИ полезно для идентификации расположения панкреатического протока при локализации опухоли, требующей энуклеации, в головке железы. При наличии больших опухолей в головке поджелудочной железы может потребоваться панкреатодуоденальная резекция (ПДР), поскольку высока возможность малигнизации; однако, это не является обычной практикой. Пациенты могут быть радикально излечены при идентификации аденомы и удалении ее при операции. Если после предоперационной визуализации при интраоперационной ревизии с полной мобилизацией поджелудочной железы, включая прием Кохера для возможности бимануальной пальпации всей железы, а также при интраоперационном УЗИ не возможно идентифицировать опухоль, не рекомендуется производить слепую резекцию. Если опухоль не выявлена, должен быть получен образец ткани поджелудочной железы путем биопсии, чтобы исключить незидиобластоз взрослых, который вообще может быть успешно излечен с помощью субтотальной резекции поджелудочной железы. Образец ткани получают при биопсии, удаляя небольшую часть самого дистального участка хвоста железы. Инсулиномы встречаются с равной частотой по всей поджелудочной железе, и есть небольшая причина полагать, что они более вероятно будут удалены при дистальной резекции поджелудочной железы. Лапароскопическая резекция выполнима, особенно при наличии интраоперационного УЗИ. Поскольку большинство инсулинóм являются одиночными, небольшими, хорошо инкапсулированными и доброкачественными, эти опухоли идеально подходят для лапароскопической резекции. Невозможность для хирурга пропальпировать опухоль пальцами во время лапароскопической операции и 10%-ный шанс наличия более чем одной опухоли является основанием для беспокойства. Хирург во время операции полагается на лапароскопическое интраоперационное УЗИ и предоперационные исследования по определению локализации опухоли. Если опухоль не может быть идентифицирована, нужно рассмотреть возможность конверсии до открытой операции, чтобы пропальпировать всю поджелудочную железу. Частота конверсии до открытой операции может уменьшиться с улучшением технологии и ростом хирургического опыта. У больных с метастатической болезнью должна быть рассмотрена возможность хирургической резекции опухоли и метастатических поражений, чтобы уменьшить симптомы гипогликемии. Часто, из-за безболезненной природы злокачественных инсулинóм, возможна продолжительная выживаемость. Средняя продолжительность жизни без симптомов заболевания, как было сообщено, составляет примерно 4 года у больных, подвергшихся радикальной резекции при злокачественном заболевании. Химиотерапия при злокачественных инсулиномах включает стрептозоцин в комбинации с другими средствами, включая 5-фторурацил или доксорубицин.
Дата добавления: 2015-12-16 | Просмотры: 680 | Нарушение авторских прав |