|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Практические аспекты генетики человека 165мой, полученной от здоровых доноров) довольно часто применяется в тех случаях, когда женщина не может забеременеть из-за бесплодия мужа. Врачи, которые осуществляют искусственное оплодотворение, как правило, не проводят генетического исследования донора. Учитывая важность проблемы, недавно были изданы директивы, касающиеся генетического скрининга среди доноров для искусственного оплодотворения [2295]; их выполнение обеспечивается в нескольких центрах. Такой генетический скрининг основан в значительной мере на тщательном сборе семейного анамнеза путем опроса. Исследование хромосом обычно не проводится, а выявление гетерозигот осуществляется только по признакам, встречающимся с высокой частотой в определенных этнических группах (т. е. скрининг болезни Тея-Сакса среди евреев ашкенази; скрининг серповидноклеточной аномалии эритроцитов среди негров и т. д.). С определением критериев непригодности спермы по данным семейного анамнеза о четких моногенных заболеваниях практически нет проблем, но установить такие критерии для широко распространенных мультифакториальных полигенных заболеваний труднее. По результатам скрининга потенциальный донор может быть отвергнут по генетическим причинам. В некоторых крупных городах США организованы банки спермы, в особенности для хранения спермы тех мужчин, которые подверглись вазэктомии в связи с нежеланием иметь детей, но хотят обеспечить себе такую возможность на случай, если их взгляд на эту проблему изменится. Такие банки спермы могут также помочь иметь потомство мужчинам, страдающим неопластическими заболеваниями и подвергающимся лечению высокими дозами цитостатических агентов или облучения, что приводит к бесплодию или повреждению генетического аппарата. Банк спермы в Калифорнии был учрежден промышленником-миллионером, который сумел получить образцы спермы от признанных лидеров в области точных наук (например, от лауреатов Нобелевской премии и других знаменитостей) для искусственного оплодотворения женщин, выразивших на это
добровольное согласие. В результате такой процедуры родилось несколько младенцев. Предполагали, что дети доноров с большой вероятностью будут проявлять высокие умственные способности. Однако трудно себе представить, что у такого ребенка генетические и средовые детерминанты окажутся аналогичными тем, которые сделали его отца выдающейся творческой личностью. Это начинание справедливо получило довольно неблагоприятную оценку в массовой печати. Банки спермы в США рассылают врачам список потенциальных доноров с их социальными и профессиональными характеристиками и этнической принадлежностью. В соответствии с выбором супружеской пары образец спермы отправляется врачу для проведения процедуры искусственного оплодотворения. Искусственное оплодотворение возможно также и in vitro. Яйцеклетки извлекают из яичников с помощью лапароскопии. Заметим, однако, что оплодотворение in vitro осуществляется труднее. Правда, в последние годы в этой области достигнуты большие успехи [2369]. Родилось много детей, зачатых таким способом. После медикаментозной и гормональной стимуляции яичника с помощью лапароскопии собирают множество яйцеклеток и оплодотворяют их спермой in vitro. В матку помещают несколько яйце- 166 9. Практические аспекты генетики человека клеток, прошедших несколько делений, в надежде на то, что по крайней мере одна из них имплантируется и разовьется в плод [2259]. В результате такой методологии часто рождается несколько детей. Ряд клиник в разных частях света теперь предлагает этот метод супружеским парам, в которых женщина до сих пор была бесплодна из-за непроходимости фаллопиевых труб. Технически процедура очень сложна и требует тщательного соблюдения всех тонкостей. В результате искусственного оплодотворения in vitro беременность часто не развивается, но по мере развития этого метода вероятность успеха растет. Описанная методика дает возможность вынашивать ребенка не биологической матери, а «подставной» [2299]. По поводу такой практики и возникающих в связи с этим проблем было много дискуссий так же, как относительно правомочности замораживания и хранения оплодотворенных яйцеклеток [2257; 2259]. Некоторые исследователи критиковали практику имплантации нескольких зигот в одну матку, поскольку каждая отдельная зигота при этом подвергается высокому риску ранней гибели. С другой стороны, эта практика привела к относительно частым случаям рождения нескольких детей со всеми сопутствующими дополнительными осложнениями (разд. 3.8.4). Итак, воспроизведение человека теперь может подвергаться манипуляциям на разных уровнях. Трудно предсказать, как это скажется на будущих поколениях. Не придется ли нам столкнуться с крупномасштабными попытками размножения людей такими методами? В намерении Мёллера входило не только предотвращение редких наследственных заболеваний с помощью искусственного оплодотворения, но и улучшение человеческой природы путем селективного размножения. Придется ли нам столкнуться с такими попытками в будущем? Будут ли они успешными? Невозможно представить, чтобы селективное размножение стало когда-нибудь популярным в открытом демократическом обществе. Оно ограничится, вероятно, незначительным меньшинством населения. Высказывалось предположение, что какой- нибудь диктаторский режим может вознамериться размножить, например, физиковядерщиков, используя сперму лауреатов Нобелевской премии в этой области. Вполне возможно, что многие дети, произведенные таким способом, достигнут в науках уровня выше среднего, а некоторые при соответствующих обстоятельствах смогут даже стать выдающимися учеными. И все же опасность того, что такой проект попытаются реализовать, относительно мала. Даже у диктаторов есть более насущные заботы; вряд ли такие государства станут вкладывать свои неизбежно ограниченные ресурсы в предприятие, которое не даст результатов в течение по крайней мере 20-30 лет. Молекулярная биология и будущее генной инженерии. Будущее генной инженерии зиждется на следующих достижениях молекулярной биологии: а) мутагенную активность определенных химических соединений (разд. 5.2.2) можно использовать для того, чтобы вызывать специфические мутации в определенных генных локусах; б) у микроорганизмов возможен перенос генетической информации неполовым путем (трансформация или трансдукция). Аналогичные попытки можно предпринять для эукариот, включая человека; в) дефектные гены можно заменить, используя вирусные гены в качестве переносчиков; г) в геном человека можно включить искусственно синтезированные гены. Индукция специфических мутаций. Большинство генных мутаций состоит в замене одного основания в последовательности ДНК на другое. Такое замещение нуклеотида может привести к замене аминокислоты в специфическом белке, который в результате может утратить функциональное значение (разд. 5.1.4). Некоторые химические мутагены избирательно атакуют определенные основания и вызывают такие же точковые мутации. Еще несколько лет назад попытки воздействовать на определенные единичные специфические участки с помощью мутагена казались обреченными 9. Практические аспекты генетики человека 167 на неудачу: в человеческом геноме присутствует слишком много идентичных участков. Однако недавно удалось решить эту задачу, при этом ДНК сначала обрабатывали специфической рестрицирующей эндонуклеазой (разд. 2.3), затем некоторые основания удаляли энзиматическим способом и, наконец, воздействовали мутагеном, который в уникальной последовательности ДНК реагирует лишь с одним определенным основанием [117]. Следовательно, проблема направленного (локального) мутагенеза теперь в принципе разрешима, хотя практические трудности еще велики. Перенос и экспрессия генов у эукариот. Для микроорганизмов известны два основных способа введения чужеродного генетического материала в клетку. При трансформации чистая ДНК при некоторых, не до конца ясных условиях проникает в микробную клетку и встраивается в генетический материал. При трансдукции генетическая информация от одной бактериальной клетки к другой передается с помощью бактериофага. Эксперименты по трансформации бактерий сыграли важную роль в истории генетики: с их помощью установили, что именно ДНК является генетически активным материалом [220]. В литературе имеются сообщения о трансформации и трансдукции у эукариот. Такие примеры есть как для растений [2315], так и для культивируемых клеток животных. В некоторых случаях удавалось достигнуть экспрессии генов прокариот в клетках эукариот. ДНК прокариот в большинстве случаев принадлежала вирусам, но иногда была бактериального происхождения. Наиболее известный пример - перенос и экспрессия Gal-оперона Е. coli в фибробласты человека, осуществленный в 1971 г. [2341]. У человека галактоза метаболизируется так же, как у E. coli, и известны мутации, связанные с недостаточностью каждого из трех участвующих в метаболизме ферментов. Самой распространенной является галактоземия (23040), обусловленная дефектом P-gal-уридилтрансферазы. Инкубация таких клеток in vitro с лямбда-фагами, несущими Gal-one- рон E. coli, приводила к образованию трансферазы в этих клетках. Однако попытки воспроизвести этот результат в последующие годы оказались неудачными. Лишь разработка новых методов встраивания ДНК (разд. 2.3) позволила сильно продвинуться в этом направлении. Теперь можно считать, что практическое применение переноса генов для генной терапии соматических заболеваний вполне реально. Искусственные гены [114]. Синтез генов in vitro представляет собой одну из самых захватывающих страниц в истории молекулярной биологии. Группа Кораны синтезировала ген транспортной РНК для аланина. Точная последовательность нуклеотидов была известна заранее, ген синтезировали чисто химическими методами, начиная с отдельных фрагментов. Через несколько лет после того, как ген был синтезирован, группе Кораны удалось заставить его работать в синтезе тРНК. Следовательно, был создан не только сам ген, но и все соседние регуляторные области, необходимые для его активации(рис. 9.4). До недавних пор создание искусственного гена химическими методами было очень трудным делом. В настоящее время синтез искусственных олигонуклеотидов вполне обычен. Таким образом, технология для конструирования человеческих генов у нас в руках, и можно считать вполне реальным в будущем синтез генов с любой желаемой последовательностью нуклеотидов и информационным содержанием. С помощью упоминавшихся выше ферментов-рестриктаз такие гены можно затем встраивать по желанию в любой геном. Перспективы генной терапии у человека. Состояние дел на 1984 год было рассмотрено в обзоре Френч-Андерсена [2296]. Необходимо четко различать две разные цели генной терапии-коррекцию генетических дефектов в соматических клетках и коррекцию в зародышевых клетках или на самых ранних стадиях развития зиготы. До сих пор первая цель практически не вызывала сомнений, тогда как вторую большинство исследователей либо отвергают, либо 168 9 Практические аспекты генетики человека
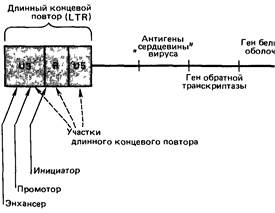
относятся к ней весьма скептически. Однако и соматическую генную терапию стоит применять только при определенных условиях. Они не отличаются от условий для любого другого лечения. Вслед за Френч-Андерсеном [2296] мы коротко их обсудим под тремя заголовками: доставка, экспрессия и меры безопасности. Доставка и экспрессия. В настоящее время единственными клетками человека, кото- рые можно использовать для переноса генов, являются клетки костного мозга или фибробласты. Никакие другие клетки нельзя извлечь из тела, вырастить в культуре для того, чтобы перенести ген и снова ввести пациенту. Для переноса клонированных генов в такие клетки существуют четыре метода: а) вирусный (с помощью РНК-ретровирусов и ДНК-вирусов) (рис. 9.5); б) химический (с помощью фосфата кальция); в) метод слияния (с помощью слияния клеток с нагруженными
|
При использовании материала ссылка на сайт medlec.org обязательна! (0.126 сек.) |