|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
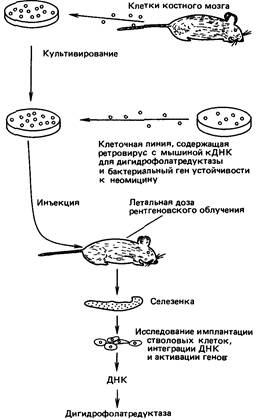
Практические аспекты генетики человека 169ДНК липосомами, тенями эритроцитов или протопластами); г) физический (с помощью микроинъекций или электропорации). Метод слияния развит в настоящее время недостаточно хорошо. Микроинъекции ДНК использовали во многих экспериментах в биологии развития позвоночных [535], но при этом, как правило, нужно вводить очень большое и трудно контролируемое количество материала. В настоящее время наиболее перспективным представляется перенос, связанный с использованием ретровирусов: единичные копии можно включить в один (хотя и случайный участок почти в 100% клеток-мишеней. Кроме того, в этом случае известна структура встраиваемой последовательности. На рис. 9.5 показана одна из используемых систем-вирус Молони (вирус лейкемии мышей). На рис. 9.6 представлена схема эксперимента. Ген устойчивости к неомицину вводили в кроветворные клетки взрослых мышей [2402], и человеческий ген фермента гипоксантин-гуанин—фосфорибозилтрансферазы (HPRT) (см. разд. 4.2.2.6) переносили и активировали в клетках линии с недостаточностью этого фермента [2343]. Эксперимент вселяет надежду на возможность генной терапии при синдроме Леша-Найхана (30800; см. разд. 4.2.2.6). Все другие способы лечения данной болезни не эффективны. Почему именно в этом случае генная инженерия может принести успех? Потому что ген HPRT, по-видимому, работает по принципу «всегда включен»; даже небольшое количество продуцируемого фермента могло бы дать улучшение, а небольшое перепроизводство не было бы особенно вредным. С другой стороны, есть сомнения в том, что введением генов HPRT в клетки костного мозга можно будет повлиять на тяжелые нарушения поведения при этом синдроме, вызванные недостаточностью фермента в клетках головного мозга. Однако in vitro наблюдали метаболические взаимодействия: продуцирующие фермент клетки могут «питать» им или его предшественниками те, в которых он отсутствует (разд. 4.2.2.6). Это могло бы происходить и in vivo и улучшать работу нервных клеток. Еще лучшим кандидатом для ген-
ной терапии является недостаточность адениндезаминазы, ведущая к дефектам иммунной системы (разд. 4.2.2.6; см. [2363]). В этом случае, по-видимому, функциональный дефект локализован преимущественно или исключительно в костном мозге, и на него, следовательно, можно воздействовать in vitro, a затем ввести клетки обратно в ткань. Меры безопасности. Чтобы применять на практике методы генной инженерии, нужно быть уверенным в их безопасности. Например, человеческие онкогены (разд. 5.1.6.5) 170 9. Практические аспекты генетики человека по структуре отчасти гомологичны ретровирусам. При заражении таким вирусом, который может модифицироваться путем, например, рекомбинации, необходимо иметь гарантии, что это не произойдет. Существуют опасности, связанные и с другими системами переноса. Устранить их (насколько это возможно) помогут эксперименты, проводимые на нескольких уровнях - на клетках костного мозга человека in vitro и на мышах и приматах in vivo. Для очень тяжелых и до сих пор не поддававшихся лечению болезней требования к безопасности менее строги, чем для более легких заболеваний или заболеваний, для которых существуют другие виды терапии. Ситуация, следовательно, не слишком отличается от той, с которой мы сталкиваемся в других, более традиционных областях медицинской терапии. Перенос генов в яйцеклетки или зиготы на ранних стадиях. Общественность обеспокоена не столько переносом генов в соматические клетки, сколько манипуляцией ими в зародышевых клетках и зиготах с целью изменения генетической конституции будущих поколений. Безответственные спекуляции некоторых молекулярных биологов и журналистов вызвали в обществе тревогу относительно мотивации и намерений ученых. Многие люди опасаются, что честолюбие молекулярных биологов не остановит их перед жестокими экспериментами на человеке. Тем временем «генная терапия» на уровне зародышевых клеток была осуществлена у мышей: введение генов гормона роста крыс в оплодотворенные яйцеклетки мышей приводило к поразительному росту некоторых из подвергшихся воздействию животных. Из экспериментальных яйцеклеток развилась 21 мышь; слияние генов произошло в семи случаях, из них в шести размер животных существенно превышал размер остальных мышей в помете [2365]. В последующих экспериментах этой группы [2304] использовались карликовые мыши линии little (lit). Причина карликовости у них заключена в недостаточности гормона роста. Эта линия используется в качестве модели при изучении аутосомно-рецессив- ной недостаточности гормона роста (тип I) у человека (26240). При введении с помощью микроинъекции генов гормона роста в яйцеклетки мышей карликовой линии удалось получить 41 животное, 7 мышей оказались носителями чужеродных генов и 6 из них продемонстрировали поразительное увеличение размеров тела; размер не просто восстановился - карликовый фенотип изменился на гигантский. Терапия оплодотворенных яйцеклеток у людей. Из результатов опытов на мышах следует, что генная терапия увенчалась успехом лишь у некоторого числа животных. В большинстве случаев она оказалась неудачной. Можно, однако, ожидать, что эффективность переноса генов со временем возрастет. Больше беспокоит чрезмерный эффект воздействия у тех животных, у которых перенос удался. Представьте себе человека, который в результате такой терапии достигает роста, скажем, в три метра! Очевидно, что вновь встроенные гены не подвергались нормальной регуляции. Возможно, использование регуляторных последовательностей поможет решить эти проблемы. Однако до сих пор не удавалось внедрить гены в места их обычной локализации в хромосоме. Встраивание происходит в случайном порядке, в некоторых случаях это вызывало у мышей-реципиентов серьезное нарушение (в результате мутации) работы нормальных генов в участках встраивания. По мнению медицинских генетиков, метод генной терапии не следует в обозримом будущем применять к оплодотворенным яйцеклеткам человека. Опасность слишком велика и долго останется таковой. Кроме того, существуют другие способы достижения той же цели. Например, карликовость гипофизарного происхождения можно с успехом лечить гормоном роста человека, продуцируемым клонируемыми в бактериях генами. Еще важнее то, что для генной терапии нет медицинских показаний: большинство метаболических заболеваний наследуется по рецессивному типу. Соотношение между пораженными и непораженными детьми гетерозиготной пары составляет 1:3. Конечно, яйцеклетку сразу после 9. Практические аспекты генетики человека 171 оплодотворения (которое должно было бы происходить in vitro) можно было бы обработать. Но прежде следовало бы установить гомозиготность мутантного аллеля. Поскольку гены еще неактивны, это невозможно сделать на уровне продукта и нужно выполнить на уровне ДНК. Однако клетка не переживет диагностической процедуры, пока не разделится на две: тогда на одной проводится диагностика, а другая сохраняется для переноса гена. Очень сложная и опасная процедура! Если гомозиготное состояние в самом деле могло бы быть диагностировано на такой ранней стадии, не лучше ли было бы отказаться от этой зиготы и посоветовать паре попробовать еще раз? В заключение заметим, что, по нашему мнению, нет никаких оснований для генной терапии яйцеклеток или ранних зигот и следует воздерживаться от попыток ее применения. Реакция общества на новые достижения и перспективы молекулярной биологии. Достижения молекулярной биологии в последнее десятилетие и в еще большей мере ее перспективы вызвали чрезвычайно сильную реакцию общественности и в особенности тех кругов, которые формируют общественное мнение (теологи, философы, журналисты). Генетики и врачи подверглись яростным нападкам. Их благие намерения истолковывались многими совершенно неправильно. В массовой печати был сформирован образ честолюбивого и жестокого ученого, который вскоре, если не будет остановлен общественностью, начнет со злым умыслом производить манипуляции над человеческим родом. Однако мы не должны забывать о том, что именно ученые одними из первых «забили тревогу», когда обнаружилась опасность экспериментов с рекомбинантными ДНК. Правда, эта тревога оказалась напрасной, опасности вполне можно избежать при продуманных действиях. Молекулярные биологи, которые участвовали в начальных этапах исследования рестриктаз, были обеспокоены потенциальной опасностью этих ферментов, позволяющих случайным образом расщеплять и объединять гены от различных организмов и использовать вездесущую Е. coll для их передачи. Они созвали конференцию для обсуждения предполагаемой опасности неконтролируемых инфекций и распространения рака в связи с использованием рекомбинантных ДНК [2264]. Общественность была сильно встревожена создавшимся положением. В Соединенных Штатах были быстро приняты законы, регулирующие работу с новыми методами. Вскоре, однако, выяснилось, что опасность сильно преувеличена. Штаммы Е. coli, которые использовались в этих опытах, имели настолько низкую жизнеспособность, что не могли вызвать эпидемий. Стало ясно и другое: перенос ДНК между видами в природе происходил в течение тысячелетий. Данные лабораторных экспериментов, а также столетний опыт клинической микробиологии и эпидемиологии убеждают нас в том, что выраженные ранее опасения неоправданны. Тем не менее ряд видных ученых продолжают беспокоиться по поводу возможных опасностей, связанных с межвидовым переносом ДНК. Спекулятивные гипотезы относительно будущего генной инженерии. Некоторые биологи выдвигали претенциозные цели манипуляции генами. По их мнению, следовало бы создать людей с новыми свойствами. Если, например, заменить кожу головы или спины тканью, содержащей хлорофилл, это дало бы индивиду способность к фотосинтезу и частично решило бы проблему нехватки пищи в мире с нарастающим перенаселением. Путем введения в энуклеированные яйцеклетки лягушек ядер кишечных клеток удалось добиться вегетативного размножения животных. Генетическая информация ядра оказалась способна обеспечить нормальное развитие лягушки при соответствующих условиях. Возможность на основе аналогичных принципов клонировать человека увлекла некоторых ученых. Хотя, насколько нам известно, исследовательская работа в этом направлении не проводится, очень многих увлекла такая фантазия. В книге, изданной в 1978 г. [2375], авторы утверждали, что вегетативное размножение чело- 172 9. Практические аспекты генетики человека века достигнуто. Никаких доказательств приведено не было, но это утверждение способствовало популяризации книги, и средства массовой информации заполонили рассказы о возможностях вегетативного размножения. Одни писали, что вегетативное размножение людей позволит воспроизводить выдающихся творческих личностей типа Эйнштейна или Моцарта, забывая при этом, что генетический материал одного Эйнштейна вовсе не гарантирует развития другого Эйнштейна. Другие фантазировали, что диктаторские режимы будут клонировать военных ученых или жестоких солдат. Если бы это даже стало возможным, маловероятно, что какая-либо страна согласилась на подобное предприятие. Чтобы клоны полностью реализовали свой потенциал, требуется целое поколение; скорее всего диктаторы будут искать более быстрые способы достижения политического и военного успеха. Еще один план подразумевал создание человекоподобных существ путем введения в энуклеированные яйцеклетки генетического материала, полученного при слиянии клеток человека и человекообразной обезьяны. Такие гуманоиды предназначались для выполнения скучной однообразной работы, не представляющей интереса для нормальных людей. Мы далеки от возможности реализации и таких планов тоже. В рамках более «традиционных» направлений Ледерберг [2330] предложил воздействие на центральную нервную систему с помощью несуществующих пока химических или ростовых факторов с целью повышения эффективности работы человеческого мозга. В таком проекте генетический материал, конечно, не подвергается изменениям, и в отличие от евгеники это направление назвали «эвфеникой». Конечно, высказывание различных гипотез и обсуждение «отдаленных» планов [2303] полезно для выявления возможных новых путей исследования. Но еще важнее то, что они предупреждают нас об опасности возможных злоупотреблений достижениями науки [2329]. Необходимость диалога по этическим вопросам. В различных областях медицинской генетики - от цитогенетическои диагностики до генетического консультирования - уже используется феномен полиморфизма длины рестрикционных фрагментов ДНК. Почти на пороге перенос генов в соматические клетки. Мы уже упоминали и о более претенциозных целях некоторых мечтателей; создавать людей по генетическим инструкциям, увеличить эффективность работы человеческого мозга, улучшить здоровье и продлить жизнь человека. Учитывая несовершенство наших сегодняшних знаний молекулярной биологии высших организмов и генетики нормальной изменчивости морфологии человека, эти идеи аналогичны идее о том, что мальчик, впервые получивший в подарок к Рождеству электронный прибор, мог бы усовершенствовать компьютер фирмы IBM последней модели. Можно также утверждать, что даже если технические условия для реализации некоторых из этих фантазий станут доступными, практическое воплощение будет невозможным по социологическим причинам. Однако полностью отбрасывать возможность злоупотреблений нельзя. Поэтому мы должны приветствовать широкое обсуждение этих проблем, даже если большая часть участников дискуссии не разбирается в технических тонкостях, а имеет лишь общие представления. Мы должны вступать в открытый диалог с общественностью и пытаться поднять уровень ее научных и этических знаний. Это поможет и нам стать более критичными по отношению к себе и своим идеям. Новые методы ставят множество новых этических проблем. Один пример: при хорее Гентингтона (14310) можно провести пренатальную диагностику в некоторых семьях с использованием ДНК-маркера. При этом иногда будет выявляться наличие заболевания у родителя, который прежде знал только, что он может заболеть с вероятностью 50%. Некоторые медицинские генетики считают, что нужно обязательно сообщить об этом пациенту при условии, что он был прежде информирован о возможных последствиях. Другие придерживаются мнения, что не следует говорить об этом, даже если консультируемые настаивают. Не всякий человек способен справиться с такой тяжелой Дата добавления: 2015-12-16 | Просмотры: 621 | Нарушение авторских прав |