|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
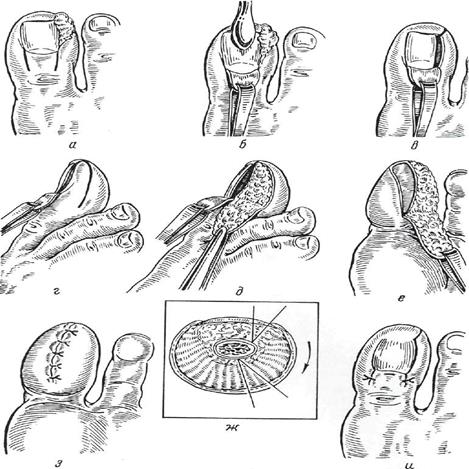
Операция А.А. Чашникова.Операция описана в 1956 г. Операция выполняется под местной анестезией или другим видом обезболивания. Удаляется ногтевая пластинка и тщательно удаляется подногтевая матрица. Скальпелем иссекаются околоногтевые валики. Дерматомом или лезвием забирается кожный лоскут соответствующего размера и средней толщины с наружной поверхности бедра. Лоскут перфорируется и укладывается на ложе ногтя с фиксацией по краям кетгутовыми швами. Накладывается асептическая повязка. При отсутствии элементов нагноения на месте пересадки, первая перевязка выполняется на 10-й день. Автором получены хорошие результаты лечения в 100% случаев применения вышеописанной операции. Операция Я.Б Рывлина (Рис. 66). Операция направлена на профилактику рецидива врастания за счёт искривления соответствующей части матрикса, которая возрождает рост ногтя в прежнем направлении. С этой целью в ходе операции должны быть решены следующие задачи: 1. Удаление ногтевой пластинки; 2. Резекция искривлённой части матрикса от свободного края до задней границы; 3 Перемещение ногтевой бороздки и ногтевого валика по направлению к задней поверхности пальца. Операция описана в 1971г. и представляет собою довольно сложное оперативное вмешательство. Выполняется под внутрикостным или общим обезболиванием. Двумя продольными разрезами длиной по 1 см каждый отсепаровывают прикорневой лоскут кожи и, отделив его от ногтевой пластинки, оттягивают последний в проксимальном направлении. Ногтевую пластинку удаляют. Если по краям ногтя имеются грануляции, то их выскабливают. Скальпелем иссекается часть матрикса во всю длину вплоть до надкостницы фаланги. Острой ложкой выскабливается дно этой раны для удаления возможных обрывков матрикса. Из кожи боковой поверхности пальца, со стороны удалённого участка ногтя, выкраивается лоскут кожи с подкожной клетчаткой слегка дугообразной формы длиной 3-3,5 см. Лоскут отсепаровывают до его основания. Параллельно этому лоскуту на подошвенной стороне пальца иссекают серповидный участок кожи с подкожной клетчаткой шириной 3-4 мм. Тыльный лоскут перемещается в подошвенную сторону и фиксируется швами, закрыв дефект после иссечения лоскута. Тыльный лоскут, у основания ногтя, возвращается на место и фиксируется швами. Таким образом, удаётся отодвинуть ногтевую бороздку и ногтевой валик на 3-4 мм от его первоначального положения. Операция достаточно травматична и оставляет после себя рубец на подошвенной опорной поверхности 1 пальца.
Рис. 66. Радикальная операция при вросшем ногте по Я.Б. Рывлину
Операция Цвирна (Рис. 67). Операция является радикальной, направленной на удаление ногтевой пластинки и матрикса с закрытием ложа ногтя перемещённым кожным лоскутом. Эта операция выполняется при неоднократных рецидивах заболевания или осложнением последнего онихогрифией. Операция выполняется под внутрикостной или общей анестезией, так как инфильтрация тканей новокаином недопустима. Сначала удаляется ногтевая пластинка. Четырьмя глубокими разрезами окаймляют ногтевое ложе с примыкающим ногтевым валиком (рис. 67а). Два продольных разреза распространяются проксимальнее основания ногтевой пластинки на 3-4 см. Лоскут от основания ногтя отсепаровывается и откидывается на тыл пальца, где провизорно фиксируется одним швом к коже (рис. 67б). Ногтевое ложе рассекается вдоль и тщательно удаляется (рис. 67в). Острием скальпеля мобилизуется кожа кончика пальца вместе с подкожной клетчаткой. Тыльный лоскут укладывается на место удалённого ногтя и фиксируется швами (рис. 67г). Накладывается гипсовая шина. Чаще всего лоскут фиксируется на ложе ногтя без особого натяжения, но при необходимости уменьшить натяжение, возможно проведение послабляющих разрезов у кончика мякоти пальца длиной по 1-1,5 см каждый, формирующих встречный кожный лоскут.
Рис.67. Операция Цвирна
При патогистологическом исследовании резецированных во время операции тканей во всех наблюдениях выявлены дегенеративные процессы в мягких тканях и костных структурах различной степени тяжести и глубины вплоть до хронического остеомиелита ногтевой фаланги. Появляется необходимость радикальной резекции поражённых тканей области врастания ногтевой пластинки. При этом осуществляется формирование ограниченной со стороны врастания ростковой зоны за счёт резекции её части с периостом и прилежащей костной тканью. В амбулаторных условиях эффективной является модификация метода Шмидена с радикальной резекцией ростковой зоны ногтевой пластинки на уровне кортикальной пластинки основания ногтевой фаланги. (В классической операции Кенига-Шмидена ростковая зона по возможности иссекается выскребанием ложкой Фолькмана, скальпелем, диатермокоагуляцией). Таким образом, вросший ноготь – достаточно часто встречающееся заболевание, часто дающее рецидивы после операции; оперативные пособия при данной патологии требуют очень тщательного соблюдения всех деталей техники операций; наилучшие результаты при оперативном лечении достигаются при комбинации оперативных пособий. Тестовые вопросы 118. Больной 50 лет длительное время страдает вросшим ногтем первого пальца правой стопы, периодически проводит консервативное лечение. В настоящий момент грубая деформация ногтя с врастанием в мягкие ткани, гиперемия, гипергрануляция и гнойное отделяемое из-под окололоктевого валика. Необходимо: 1) после купирования острого воспаления консервативными мероприятиями (ванночки с растворами антисептика, антибиотики) амбулаторное хирургическое вмешательство на ногте, ногтевом слое и околоногтевом валике 2) немедленное хирургическое вмешательство с пластикой мягких тканей 3) консервативное лечение 4) направление больного в хирургический стационар На прием к амбулаторному хирургу пришел пациент с вросшим ногтем на первом пальце левой стопы. При осмотре выявлена незначительная гиперемия и болезненность в области ногтевой пластинки. Что показано данному пациенту? 1) произвести продольную резекцию ногтевой пластинки 2) удалить ноготь 3) гигиена стопы, ванночки с марганцовкой, в последующем оперативное лечение 4) в лечении не нуждается ГЛАВА 17
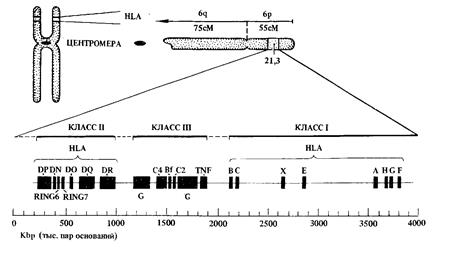
Для практической амбулаторной сети проблема трансплантологии, особенно в далеких от трансплантологических центров регионах, представляется весьма туманной. Однако прогресс науки остановить невозможно, в зарубежных странах пересадка органов превращается в рутинную операцию, совсем недалеко время, когда и в нашей стране пересадки органов перейдут из НИИ и вузовских клиник в практическое здравоохранение. Поликлинические хирурги должны четко представлять возможности лечения некоторых тяжелых заболеваний методами пересадки органов и не отнимать надежду на продление жизни, а иногда и на выздоровление (но с пожизненным приемом иммуносупрессивных средств и иммунологическим мониторингом) у безнадежных больных. Автору много раз приходилось сталкиваться со смертью пациентов. К сожалению, все люди смертны, но каждый раз со смертью больных уходила в небытие частица собственной души. Особенно, когда умирали молодые и нестарые люди. Всего два примера: молодая девушка с врожденным диабетом, рано ослепшая и умершая от диабетической нефропатии и мужчина 56 лет тоже с инсулинозависимым сахарным диабетом, длительно лечившийся с диабетической стопой, потерявший пальцы и половину обеих стоп, но вылечивший их, почти потерявший зрение, многократно подвергавшийся лазерной коагуляции сетчатки, и длительно и мучительно умиравший от нефропатии и ХПН, но очень хотевший жить, полный творческих планов (вел музыкальную передачу на радио, имел богатейшую фонотеку) и не понимавший, что дни его сочтены. Не все методы лечения были исчерпаны у этих больных. В настоящее время таким пациентам проводится одновременная пересадка поджелудочной железы и почки. А молодых больных надо лечить намного раньше, выполняя пересадку поджелудочной железы еще до развития грозных осложнений, либо вводя культуры островковых клеток поджелудочной железы. Однако такие случаи для регионов уникальны. Хирурги поликлиник не владеют ситуацией. У больных и их родственников нет информации о возможных методах лечения. Данная глава освещает практические вопросы трансплантологии. Сегодня в стране более 20 трансплантологических центров. В литературе появилась информация, что донорские органы остаются невостребованными. Ю.Л. Шевченко и соавторы (2000 г.) сообщают, что «… только по Санкт-Петербургу в 1997 г. остались невостребованными более 80 сердечно-легочных и печеночных органных трансплантатов, не говоря о тканевых трансплантатах». Дело остается за подбором пациентов на трансплантацию и финансированием операций. Необходимо отметить, что окончательное решение о пересадке органов и тканей принимают узкие специалисты, которые всесторонне обследуют и лечат больных в профильных отделениях: кардиологии (пересадка сердца), гастроэнтерологии (пересадка печени), нефрологии (пересадка почки), пульмонологии (пересадка легкого или легких, или сердца-легких – на стыке кардиологии и пульмонологии), эндокринологии (поджелудочная железа), но знать показания и противопоказания к трансплантации тех или иных органов и систем, направить на обследование к соответствующему специалисту, информировать больного о возможностях метода, показать пути практической реализации принятого больным решения (для иногородних существует квота региона в Министерстве здравоохранения), знать течение посттрансплантационного периода, иммуносупрессивную терапию и иммунологический мониторинг должен хирург поликлиники. Эта книга адресована молодым хирургам, поэтому хотелось бы, чтобы они использовали все возможности современной хирургии для лечения больных. В данной главе освещаются вопросы подбора пар «донор-реципиент», синдромы отторжения, иммунологическая супрессия, показания, противопоказания к пересадке органов, отдельные технические стороны трансплантации. ПОДБОР ПАР «ДОНОР-РЕЦИПИЕНТ». Роль иммунной системы в исходе пересадки органов и тканей имеет решающее значение. Решающими для приживления трансплантата являются антигены гистосовместимости групп крови АВО, резус-фактора и антигены гистосовместимости лейкоцитов НLА (эйч-эль-эй). Главный комплекс гистосовместимости (ГКГС) находится в 6-ой хромосоме человека, он включает множество генов, число которых точно не установлено. Определение групп крови, резус-фактора и свойственных им антигенов АВО и Rh не вызывает трудностей. НLА-антигены, расположенные на поверхности клеток, могут быть определены с помощью серологических методов исследования, при которых используют сыворотки, содержащие антитела против специфических антигенов гистосовместимости. Практическое значение имеет определение НLА-А,В,С,Д, в том числе ДR антигенов.
Рис. 68. Схема строения HLA Основное правило, обеспечивающее безусловный успех пересадки – выбор донора, идентичного с реципиентом по НLА-антигенам. С иммуногенетических позиций можно выделить несколько групп, в которых вероятность идентичности по НLА-антигенам будет резко различаться: 1) При пересадке между сиблингами, т.е. между индивидуумами, состоящими в степени родства «брат-брат» и т.п., вероятность идентичности очень высока, так как у детей одних родителей вероятность наличия одинаковых гомологичных хромосом очень значительная, 2) При пересадке в комбинации «родитель-ребенок» эта вероятность значительно ниже, так как ребенок получает от родителей разный набор антигенов, 3) При пересадке между индивидуумами, не связанными кровным родством, вероятность идентичности по НLА-антигенам очень мала. Приживление трансплантированного органа зависит в основном от степени идентичности антигенов Важным этапом в оценке донора является проведение антропометрической совместимости донора и реципиента. При решении вопроса о трансплантации комплекса сердце-легкие или легких, печени наружные размеры донора должны быть на 2-3 см, объемные на 10-20% меньше, чем у реципиента. Вес донора должен быть меньше веса реципиента не более чем на 20%, в противном случае большая разница в весе может сказаться на производительности насосной функции сердца. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИЗОВ ОТТОРЖЕНИЯ. Несмотря на успехи, достигнутые в трансплантологии и иммуносупрессивной терапии, отторжение остается одной из основных причин гибели пересаженных органов и нередко самого пациента. Вне зависимости от того, какой орган был пересажен, по характеру этиопатогенеза и ответной иммунной реакции можно выделить: – сверхострое отторжение, развивающееся нередко уже в операционной, как только донорский орган включается в общий кровоток реципиента. Это отторжение обусловлено наличием антител у реципиента, направленных против антигенов донора, и чаще всего требует немедленного удаления пересаженного органа. Ведущая роль в этиопатогенезе сверхострого отторжения отводится гуморальным механизмам иммунного ответа; – острое отторжение – криз (или эпизод отторжения) развивается в первые дни, недели и месяцы послеоперационного периода и является результатом формирования реакции иммунологического распознавания и клеточно-опосредованного ответа реципиента на тканевые антигены донора; – хроническое отторжение характерно для более позднего периода, течет медленно и отличается специфическими изменениями, связанными с видом пересаженного органа. Хронические отторжение почек характеризуется артериитом или гломерулонефритом, хроническое отторжение сердца у больных с ишемической болезнью нередко сопровождается поражением коронарных артерий. При выявлении напряженности трансплантационного иммунитета без явных клинических проявлений нарушения функции пересаженного органа можно говорить о субклинической форме криза отторжения, нередко лежащей в основе хронических структурных нарушений. Первые попытки подавления реакции отторжения пересаженного органа путем тотального облучения тела реципиента после трансплантации были предприняты в различных клиниках между 1959 и 1962 гг. С 1961 г. цитостатик азатиоприн (имуран) стал применяться при трансплантации почки и способствовал в ряде случаев приживлению трансплантата. Начиная с 1963 г., использование имурана в комбинации с преднизолоном стало стандартным режимом иммуносупрессии после трансплантации почек и печени. Комбинированная иммуносупрессия в сочетании с тщательным подбором пар «донор-реципиент» по лейкоцитарным антигенам системы НLА обеспечила значительное улучшение результатов органных трансплантаций. Но до начала 80-х годов прошлого века развитие клинической трансплантологии в мире значительно сдерживалось отсутствием высокоэффективных и нетоксичных препаратов иммуносупрессивного ряда. Открытие и внедрение в клиническую практику циклоспорина А с 1978 года резко снизило кризы отторжения, показатели годичной выживаемости трансплантатов увеличились на 20-30%, это послужило мощным толчком к внедрению трансплантации органов в клиническую практику. Основой современной иммуносупрессивной терапии является «триплет-схема», включающая циклоспорин А, снижение дозы азатиоприна и глюкокортикоидов. Пациенты применяют препараты «триплет-схемы» пожизненно. Для лечения кризов отторжения используют пульс-терапию мегадозами глюкокортикоидов (преднизолон до 1500 мг/сут. в течение 2-3 дней), антилимфоцитарную сыворотку, препараты моноклональных антител к панТ и Т3-лимфоцитам (ортоклон ОКТЗ, мурамонаб и др.). Продолжается активный поиск принципиально новых препаратов (циклоспорин обладает выраженной нефротоксичностью) и схем иммуносупрессивной терапии для увеличения надежности профилактики кризов отторжения, снижения токсичности и выраженности побочных эффектов препаратов «триплет-схемы», снижения инфекционных и опухолевых осложнений в организме реципиента. Для разрешения иммунологических проблем пересадки органов при центрах трансплантации организуются лаборатории клинической иммунологии и иммунологического типирования тканей, проводится иммунологический мониторинг больных после трансплантации органов. Иммунологическое типирование доноров производится в лабораториях клинической иммунологии лечебно-профилактических учреждений и лабораториях иммунологического типирования станций переливания крови на основании договора между последними и бригадой по забору и заготовке органов.
ТРАНСПЛАНТАЦИЯ СЕРДЦА
При обсуждении показаний к трансплантации решается круг общемедицинских и социальных аспектов, который выходит за рамки медицинских проблем и решается коллегиально трансплантационным консилиумом врачей, в который входят хирург-трансплантолог, кардиолог, гепатолог, нефролог (соответственно профилю заболевания), иммунолог-клиницист, психиатр и др. Консилиум решает вопросы: – действительно ли у пациента конечная стадия заболевания и какова продолжительность его жизни; – существует ли для больного альтернатива трансплантации; – переносима ли пациентом операция пересадки органа; – позволяет ли состояние других органов пациента после пересадки пожизненно принимать иммуносупрессанты; – может ли реципиенту быть гарантировано приемлемое качество жизни; – подготовлен ли больной психологически к трансплантации и сохранит ли он после нее эмоциональную устойчивость, контактность и интегральность личности. Консилиум обязан не только изучить данные обследования, но проследить их динамику, а также составить представление о складе характера больного, его доминирующих интересах, поведенческом стереотипе и вредных привычках, о ближайшем окружении и семье. Алкоголизм и употребление наркотиков исключают возможность трансплантации, т.к. делают поведение индивидуума безответственным и непредсказуемым. Показания и критерии к операции трансплантации сердца: – ишемическая болезнь сердца в терминальной стадии развития болезни, кардиопатия, клапанные и врожденные пороки сердца с сердечной недостаточностью 4 степени по классификации Нью-Йоркской ассоциации кардиологов с выживанием пациента не менее 6 месяцев; – нормальная функция или обратимая дисфункция печени и почек; – легочное сосудистое сопротивление до 3 вудовских единиц; – возраст больного не старше 50 лет. Противопоказания к трансплантации сердца: – активная инфекция; – злокачественный опухолевый процесс; – диабет с ретино-, нефро-, ангиопатией; – легочно-обструктивная болезнь, легочная гипертензия выраженной степени; – кахексия с асцитом; – психические заболевания; – алкоголизм, наркомания; – психологическая неуравновешенность, нестабильность. В качестве донора для пересадки сердца должен быть подобран человек не старше 35 лет со здоровым сердцем, с клинически установленной смертью мозга. Если донор после ДТП, следует быть внимательным, так как контузия сердца может быть незамеченной и работа сердца после операции будет неэффективной. Помимо травмы абсолютными противопоказаниями к использованию донорских органов являются злокачественные новообразования и инфекционные заболевания: туберкулез, сифилис, гепатит, СПИД, цитомегаловирусная инфекция. Пересадку сердца выполняют только в отделениях сердечной хирургии, имеющих опыт проведения искусственного кровообращения, подготовленный квалифицированный персонал. Обычно одновременно в смежных операционных начинают операцию изъятия сердца у донора и подготовку реципиента – удаление больного сердца для того, чтобы максимально сократить время между изъятием и трансплантацией донорского сердца. Выполняются ортотопическая и гетеротопическая пересадка сердца. В течение первого года после операции выживают 80% больных, после 5 лет – 50%. Фармакологическую иммунодепрессию после трансплантации сердца производят теми же препаратами, дозировка подбирается индивидуально. Реакция отторжения проявляется низкими зубцами QR на ЭКГ. Для выявления ранних признаков отторжения используют чрезвенозную эндокардиальную биопсию миокарда с последующим изучением его гистологической структуры.
ТРАНСПЛАНТАЦИЯ ЛЕГКОГО
В настоящее время трансплантация одного или двух легких применяется намного реже, чем почек, сердца, печени. Это связано с большим количеством осложнений в связи с проблемой эффективного осуществления дыхательной функции в раннем послеоперационном периоде, ишемией бронхиального анастомоза из-за разрыва сети бронхиальных сосудов, повышенного риска инфицирования вследствие естественного тесного контакта с окружающей средой, трудностями подбора донора со здоровыми легкими. Критерии отбора больных для пересадки легких: – прогрессирующая недостаточность внешнего дыхания (терминальная стадия заболеваний легких) с ожидаемой продолжительностью жизни 12-18 месяцев; – кислородная зависимости больного (ингаляция или вентиляция); – нормальная функция сердца; – отсутствие системных заболеваний; – отсутствие активной (внелегочной) инфекции; – отсутствие противопоказаний для иммунодепрессивной терапии; – возможность в течение месяца (или больше) до операции обходиться без кортикостероидов. Трансплантация обоих легких чаще производится при эмфиземе, муковисцидозе, цистофиброзе, бронхоэктатической болезни. Односторонняя пересадка чаще выполняется при фиброзирующем альвеолите, первичной легочной гипертензии при отсутствии правожелудочковой недостаточности. Используется преимущественно ортотопическая техника пересадки. Выживаемость к концу 1-го года жизни составляет 65-73%.
ТРАНСПЛАНТАЦИЯ СЕРДЦЕ-ЛЕГКИЕ
Пересадка сердца и легких одним блоком применяется у пациентов с легочной гипертензией первичного и вторичного происхождения и при «легочном сердце», являющимся исходом различных заболеваний легочной (альвеолярной) паренхимы, межуточной ткани или воздухоносных путей: – заболевания сердца (синдром Эйзенменгера, клапанные пороки с фиксированной легочной гипертензией и недостаточностью правого сердца); – легочно-васкулярная болезнь (первичная легочная гипертензия, тромбоэмболическая болезнь легких, идиопатический легочный гемосидероз); – заболевания паренхимы легких с развитием «легочного сердца» (эмфизема, муковисцидоз, фиброзирующий альвеолит, лимфоангиолейомиоматоз легких, альфа-I-антитрипсиновый дефицит); – заболевания воздухоносных путей с развитием «легочного сердца» (облитерирующий бронхиолит, хронический обструктивный бронхит, цистофиброз легких, фиброз легких, бронхоэктатическая болезнь). Показания к трансплантации сердца и легких: – конечная стадия сердечнолегочного заболевания (4 класс NУНА); – максимальная «естественная» выживаемость менее 12-24 месяцев; – сохранение функции печени и почек; – возраст не старше 45 лет. Противопоказания к трансплантации сердца и легких: – активная (внелегочная) инфекция, сепсис; – системные заболевания (диабет, опухоль, коллагеноз и т.д.); – язвенная болезнь в стадии обострения; – кахексия с потерей мышечной массы; – некоррегируемый геморрагический диатез; – множественная лекарственная аллергия; – постоянная гормональная зависимость; – предшествующая операция со вскрытием плевры; – спаечный процесс в плевре. Технически операция пересадки легкого и сердца-легкого хорошо разработана. В послеоперационном периоде наблюдается нарушение выделения мокроты в связи с потерей бронхиальной иннервации и легочных рефлексов, высок риск развития отека легких, число инфекционных осложнений после операции более чем в 3 раза превышает таковое при трансплантации сердца, что отражается на уровне смертности больных. Осложнения обусловлены пневмонией, полученной от донора, и цитомегаловирусной инфекцией. Особенности консервации легких заключаются в том, что они предрасположены к более раннему предсмертному повреждению у донора, чем другие органы. Отторжение легких происходит по 3 типам: классическому, атипичному, сосудистому. При классическом отторжении происходит уменьшение перфузии и вентиляции трансплантата, при атипичном – уменьшение альвеолярной вентиляции без изменения перфузии, при сосудистом – снижение перфузии без изменения вентиляции. Для успешного ведения больного в течение первых 24 часов необходимо наличие у постели больного одновременно 2-х медицинских сестер. Большинство реципиентов переносят 2 или 3 значительных криза в первые 3 недели после трансплантации. Все эпизоды острого отторжения проходят в первые 6 недель. Терапия криза отторжения трансплантата включает 3-х дневную пульс-терапию метилпреднизолоном 1000 мг в сутки внутривенно, увеличение дозы циклоспорина, ОКТ-3.
ТРАНСПЛАНТАЦИЯ ПОЧКИ
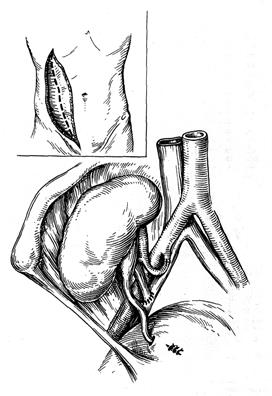
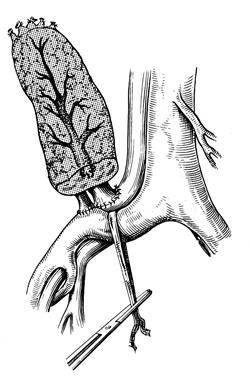
Исторически почка стала первым органом, пересадки которого были осуществлены в эксперименте, а затем и в клинике. В настоящее время в мире зарегистрировано около 600 центров трансплантации почки, в которых выполнено около 400 тысяч операций. Годичная выживаемость трансплантатов в ведущих клиниках достигает 92-95%, а наибольший срок выживания с пересаженной почкой составляет более 30 лет. Основным показанием к трансплантации почки является терминальная стадия хронической почечной недостаточности (ХПН). Наиболее часто к ХПН приводят: – хронический гломерулонефрит; – хронический пиелонефрит; – сахарный диабет, поликистоз; – системные заболевания (склеродермия, системная красная волчанка); – лекарственные и токсические нефропатии; – травмы и опухоли (гипернефрома, опухоль Вильмса), по поводу которых необходима нефрэктомия. Частота вновь выявленных случаев терминальной ХПН составляет 30-50 случаев на 1 млн. населения в год. Существует несколько методов лечения терминальной ХПН: программный гемодиализ, перитонеальный диализ, но наилучшим образом восстанавливает качество продлеваемой жизни больных и обеспечивает их социальную реабилитацию успешная трансплантация почки. Критерии отбора больных для трансплантации почки в последние годы расширены, показанием к трансплантации является ХПН у пациентов в возрасте до 65-70 лет, у которых нет патологии нижних мочевыводящих путей, активной инфекции, выраженной кахексии, злокачественных опухолей или системных заболеваний в активной фазе. Трансплантация почки также является методом выбора лечения детей, страдающих ХПН. В большинстве случаев выполняется гетеротопическая пересадка почки, трансплантат помещается в подвздошную область контрлатеральную по отношению к донорской почке. Почечная артерия анастомозируется с внутренней подвздошной артерией реципиента, венозный анастомоз накладывается «конец в бок» с наружной подвздошной веной. Восстановление непрерывности мочевыводящих путей после включения трансплантата в кровоток осуществляется имплантацией мочеточника в дно мочевого пузыря.
Рис. 69. Параректальный забрюшинный доступ к подвздошным сосудам При пересадке почки от живого родственного донора взятие трансплантата у донора и подготовка сосудов у реципиента должны выполняться двумя бригадами хирургов одновременно в смежных операционных. Почка донора удаляется из раны и ее немедленно начинают перфузировать через артерию охлажденным до 4оС реополиглюкином с добавлением новокаина и 5 мл гепарина. Первичная тепловая ишемия обычно не превышает 2 минуты. Дальнейшие этапы не отличаются от пересадки почки от трупа. В раннем послеоперационном периоде могут возникнуть осложнения: кровотечение, несостоятельность анастомоза мочеточника с мочевым пузырем и образование мочевых свищей, инфицирование раны и ложа почки, острая недостаточность трансплантата, реакция отторжения трансплантата, инфекционные осложнения мочевых путей; в результате использования иммунодепрессивных препаратов для больного опасны цитомегаловирусная и герпетическая инфекция. В отдаленном периоде у ряда больных развивается артериальная гипертензия, при неэффективности консервативной терапии приходится выполнять двустороннюю нефрэктомию.
ТРАНСПЛАНТАЦИЯ ПЕЧЕНИ
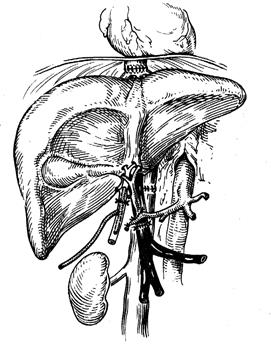
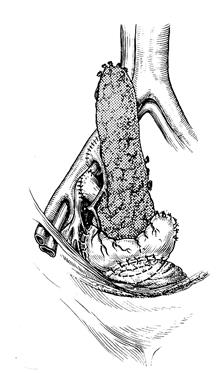
До 80-х годов прошлого века трансплантология печени прогрессировала крайне медленно, годичная выживаемость больных держалась на уровне 30-35%. Внедрение в клиническую практику циклоспорина А, достижения в области забора и консервации органов, стандартизация самой пересадки создали предпосылки для более широкого внедрения ОТП в клиническую практику. Перечень клинических показаний включает более 50 нозологических форм. У детей наиболее частыми показаниями к ОТП является билиарная атрезия, у взрослых – постнекротический цирроз печени, первичный билиарный цирроз, склерозирующий холангит, метаболические заболевания печени. Показания к ОТП при злокачественных новообразованиях сужены, так как в 80% случаев возникает рецидив. Перечень абсолютных противопоказаний к ОТП за последние годы уменьшился. Из него исключены серьезные возрастные ограничения, тромбоз воротной вены, предшествующие операции на печени, желчных путях и воротной вене. Абсолютными противопоказаниями к ОТП остаются септические заболевания сердца и легких в терминальной стадии, СПИД. Подбор донорского органа производится с учетом антропометрического соответствия донора и реципиента, совместимости по системе АВО, выполнения прямой перекрестной пробы. Типирование по критериям НLА не имеет решающего значения при пересадке печени, так как взаимосвязи между совместимостью по НLА и отторжением пересаженной печени нет. Из технических вариантов трансплантации печени гетеротопические методики широкого применения в клинике не нашли, предпочтение отдается ОТП. ОТП – многочасовое хирургическое вмешательство, включающее множество различных элементов, выполнение которых требует максимального внимания и тщательности. ОТП включает 4 основных этапа: 1) извлечение, консервация и подготовка донорского органа, 2) удаление собственной пораженной печени реципиента, 3) имплантация донорской печени, 4) гемостаз. Важное место в проведении операции и профилактике интра- и послеоперационных осложнений отводится порто-кавальному и кава-кавальному шунтированию. Имплантацию донорской печени начинают с наложения верхнего (поддиафрагмального) кавального анастомоза, затем накладывают нижний (подпеченочный) кавальный анастомоз, после – порто-портальный и возобновляют портальный кровоток. Первую порцию крови – около 300-400 мл выпускают в брюшную полость через отверстие в нижнем кавальном анастомозе во избежание рефлекторной остановки сердца при прохождении крови через холодный трансплантат. После заполнения трансплантата портальной кровью и контроля гемостаза обходное кава-кавальное шунтирование прекращают и приступают к наложению артериального анастомоза. До начала билиарной реконструкции необходимо выполнить гемостатические мероприятия. Особенно труден и продолжителен гемостаз раневых поверхностей правого купола диафрагмы и забрюшинной клетчатки, области правого надпочечника. На фоне коагулопатии эти участки плохо поддаются хирургическим методам гемостаза. Восстановление адекватного желчеотделения является завершающим этапом ОТП. Наибольшее распространение получил холедохо-холедохоанастомоз (ХХА) с Т-образным дренажем для беспрепятственного оттока желчи.
Рис. 70. Общий вид пересаженной печени Интраоперационные и ранние послеоперационные осложнения: 1) внутрибрюшное кровотечение, 2) тромбоз печеночной артерии трансплантированной печени, 3) несостоятельность швов желчного анастомоза, 4) тромбоз воротной вены, 5) тромбоз нижней полой вены. Иммуносупрессивную терапию начинают во время операции с введения метилпреднизолона в дозе 0,75-1,5 мг/кг. После операции вводят циклоспорин и азатиоприн. Доза азатиоприна со второй недели уменьшается и к концу 4-ой отменяется. Преднизолон больные получают в течение 3-6 месяцев. Во избежание инфекционных осложнений в течение 5 суток удаляют все дренажи, кроме Т-образного, через 8-12 недель после операции удаляют Т-образный дренаж. Больных выписывают через 4-6 недель после трансплантации. Особое внимание обращают на раннюю диагностику таких симптомов, как ознобы и лихорадка, которые могут быть связаны с холангитом или инфекцией в системе дыхания. После выписки на 2-ой, Реакция отторжения после ОТП бывает 3-х типов: первично-ускоренная, острая (у 70% пациентов первые 3 месяца) и отдаленная. Диагноз криза отторжения ставится на основании динамики желчеотделения, данных биохимического анализа крови, УЗИ и биопсии печени. Для лечения применяют большие дозы метилпреднизилона. Ретрансплантация печени выполняется при отсутствии эффекта от лечения. К настоящему времени в мире выполнено около 50 тысяч операций ОТП в более чем 200 центрах, годичная выживаемость достигает 80%.
ТРАНСПЛАНТАЦИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Пересадка поджелудочной железы (ПЖ) выполняется при инсулинозависимом сахарном диабете. В целом результаты трансплантации ПЖ уступают результатам пересадки почек, сердца, печени. Органная пересадка ПЖ пациентам с инсулинозависимым сахарным диабетом (ИЗСД) сопряжена с большим риском. В настоящее время ИЗСД страдают в мире более 100 млн. человек. При высокой летальности среди больных ИЗСД эта болезнь не несет непосредственной угрозы жизни, поэтому трансплантацию ПЖ нельзя отнести к разряду операций по жизненным показаниям, кроме больных с ИЗСД в терминальной стадии почечной недостаточности. При необходимости выполняют одновременную пересадку ПЖ и почки. До настоящего времени дискутируется вопрос об органной и сегментарной пересадке ПЖ. Сегментарная пересадка возможна от живого родственного донора, в этом ее преимущество. Ключевым вопросом трансплантации ПЖ является проблема экзокринной (внешней) секреции. Все известные способы хирургической внешнесекреторной функции трансплантата ПЖ можно условно разделить на 2 группы: угнетения секреции и ее сохранения. Интрадуктальное введение быстротвердеющего вещества вызывает блокирование оттока секрета трансплантата ПЖ с последующей атрофией и фиброзным перерождением ацинарных клеток без ухудшения функции островков Лангерганса. Модификацией способа является наружное дренирование ПЖ с последующим через 30-40 дней закрытием протоковой системы. Сохранение внешней секреции ПЖ возможно при инвагинационной панкреатикоеюностомии. Более перспективным является дренирование панкреатического сока в мочевой пузырь путем наложения дуоденоцистоанастомоза или в кишку. ПЖ пересаживают в подвздошную ямку, селезеночные артерию и вену соединяют анастомозами с подвздошными сосудами по типу конец в бок.
ПЕРСПЕКТИВЫ РАЗВИТИЯ ТРАНСПЛАНТОЛОГИИ
Трансплантология относится к одной из самых динамично развивающихся областей клинической и экспериментальной медицины. Развитие трансплантологии в РФ зависит от общего состояния развития трансплантологической науки и организации службы. Экономическая ситуация обуславливает дальнейшее развитие отрасли и увеличение числа пересадок органов и тканей. Определенные надежды возлагаются на последние достижения генетики в области клонирования живых организмов и селекции трансгенных животных с определенными, закрепленными в генотипе нужными человеку свойствами тканей. Требуется улучшение консервации трансплантатов, кондиционирования доноров-трупов, так как при дистантном заборе органов необходимо обеспечить длительную жизнеспособность перивитального органа. Обсуждаются проблемы перевода трансплантации органов из вузовской медицины в муниципальную с внедрением трансплантологических операций в работу центров сердечно-сосудистой хирургии, как это сделано во всех развитых странах.
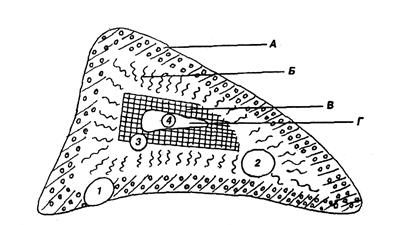
ГЛАВА 18 Хирургическая эндокринология – область хирургии, основным методом которой является выполнение оперативных вмешательств на органах эндокринной системы (ЭС). Центральным звеном ЭС являются секреторные ядра гипоталамуса, шишковидное тело, которые получают информацию из ЦНС и переключают ее на гипофиз, непосредственно участвующий в регуляции зависимых от него эндокринных органов. Периферическое звено ЭС составляют железы, зависимые от гипофиза: щитовидная железа, кора надпочечников, яичники, яички и железы, независимые от гипофиза: мозговое вещество надпочечников, паращитовидные железы, С-клетки ЩЖ (околофолликулярные, медуллярные), α и β-клетки островков ПЖ, а также гормонпродуцирующие клетки желудочно-кишечного тракта и вилочковая железа. Клетки эндокринной системы входят в АПУД-систему – систему клеток, способных к выработке и накоплению биогенных аминов и пептидных гормонов и имеющих общее эмбриональное происхождение. АПУД-систему составляют около 40 типов клеток, обнаруживаемых в ЦНС (гипоталамусе, мозжечке), железах внутренней секреции (гипофизе, шишковидном теле, щитовидной железе, островках поджелудочной железы, надпочечниках, яичниках), в желудочно-кишечном тракте, легких, почках и мочевых путях, параганглиях и плаценте. Предполагают, что единым эмбриональным предшественником клеток АПУД-системы является нейроэндокринно-программированный эпибласт. Наиболее изученной является АПУД-система желудочно-кишечного тракта и ПЖ, объединяемая в отдельную гастроэнтеропанкреатическую эндокринную систему, на долю которой приходится около половины всех апудоцитов. Опухоли (доброкачественные и злокачественные), исходящие из клеток АПУД-системы, носят название апудом. Их клинические проявления определяются гиперпродукцией тех гормонов, которые синтезируются клетками этих опухолей. Апудомами могут секретироваться как ортоэндокринные (энтопические), продуцируемые данным типом клеток в физиологических условиях вещества, так и параэндокринные (эктопические) вещества, секретируемые клетками только при опухолевом перерождении. Оба вида опухолей могут быть мультигормональными, но клиническая картина определяется избыточной секрецией какого-либо одного гормона. Апудомы делят на 3 группы: 1. Ортоэндокринные (инсулома, глюкагонома, гастринома, феохромоцитома, опухоли передней доли гипофиза, кальцитонинома и карциноиды). Они продуцируют соответствующие гормоны теми же клетками, что и в нормальных условиях, но в избыточных количествах. 2. Параэндокринные, исходящие из желез внутренней секреции либо из тканей, которые обычно не рассматриваются как эндокринные (ткань бронхов, почек), секретируют один или несколько гормонов, типичных для других клеток АПУД-системы. АКТГ, кроме гипофиза, может секретироваться медуллярным раком ЩЖ, феохромоцитомой, опухолью островков Лангерганса ПЖ. Некоторые параэндокринные апудомы (карциноиды бронхов) секретируют антидиуретический гормон (АДГ), а почечная карцинома – энтероглюкагон. 3. Множественные эндокринные неоплазии (МЭН) или МЭА (устаревший термин) – наследственно детерминированные поражения, характеризующиеся образованием множественных опухолей эндокринных желез у одного и того же больного, происходящих из клеток АПУД-системы. В настоящее время выделяют синдром МЭН-1, или синдром Вермера (включает опухоли или гиперплазии паращитовидных желез, опухоли поджелудочной железы, гипофиза, коры надпочечников и щитовидной железы), синдром МЭН-2а, или синдром Сиппла (включает медуллярный рак ЩЖ, феохромоцитому, гиперплазию или опухоль паращитовидных желез), синдром МЭН-2в, или синдром Горлина (включает медуллярный рак ЩЖ, феохромоцитому, множественный нейрофиброматоз слизистых оболочек, изменения скелета по типу синдрома Марфана, нарушение функции кишечника). Кроме гормонально-активных опухолей выделяют и гормонально-неактивные опухоли ЭС. Практическое значение в амбулаторной хирургии имеют опухоли щитовидной железы, поджелудочной железы, надпочечников. Задача хирурга поликлиники – диагностика, включая специальные методы исследования; направление на оперативное лечение к онкологу. ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ (ЩЖ) относятся к опухолям наружной локализации, при онкологической настороженности могут быть обнаружены в ранних стадиях и оперированы радикально. Классификация: Доброкачественные I. Эпителиального происхождения – аденомы: 1) фолликулярные, 2) папиллярные. II. Неэпителиальные: – фибромы; – невриномы; – хемодектомы. По клиническим признакам доброкачественные опухоли обычно являются узловым зобом. Злокачественные I. Эпителиальные – рак щитовидной железы: 1. Дифференцированные формы рака: – папиллярная; – фолликулярная. 2. Медуллярный рак (солидный рак с амилоидной стромой). 3. Недифференцированная форма рака: – анапластический рак. II. Неэпителиальные: – саркома; – нейросаркома; – лимфоретикулосаркома. УЗЛОВОЙ ЗОБ в виде одного или нескольких узлов довольно часто протекает без функциональных нарушений, при эутиреоидном состоянии. Как правило, узел определяется в одной доле железы, четко ограничен и более плотный, чем остальные отделы щитовидной железы. Консистенция узла может быть более плотной или мягкой, а иногда напряженно эластичной. О существовании узлового образования больной может и не подозревать, если оно меньше 1,5 см. В других случаях клиническая картина заболевания зависит от локализации «узла» (находится он в нормально расположенной или дистопированной тиреоидной ткани) и возможного нарушения функции соседних органов. Еще одной особенностью в расположении зоба может быть его необычный рост. Зобная ткань растет в сторону от железы, и вследствие этого зоб приобретает необычную локализацию. При росте боковых долей сзади образуется «кольцевидный» зоб, охватывающий трахею и пищевод. Зоб, спускающийся за грудину, называется загрудинным. Степень опущения может быть разной. Выделяют шейно-грудные зобы (большая часть зоба на шее, но нижний полюс погружен в средостение), грудо-шейные (зоб большей частью находится за грудиной) и внутригрудные зобы. Клиническая картина загрудинного зоба определяется степенью компрессии и смещения соседних органов. Ведущими симптомами в этих случаях являются дыхательные расстройства, обусловленные сдавлением трахеи и крупных бронхов. При компрессии верхней полой вены расширяются и набухают вены шеи и верхней половины грудной клетки, появляется цианоз, отеки лица и шеи. О сдавлении симпатического ствола свидетельствуют нарушения ритма сердца и появление симптомов Горнера. Диагностика основана на пальпации щитовидной железы (пальпируются узлы более 1,5 см в диаметре), УЗИ (выявляются узлы 1 см в диаметре), при загрудинном зобе – КТ, сцинтиграфия; определяются гормоны щитовидной железы – ТТГ (тиреотропный гормон), Т3, Т4, проводится тонкоигольная пункционная биопсия (ТПБ) под контролем УЗИ. Лечение. Наиболее сложным и спорным вопросом в хирургии щитовидной железы является выбор лечебной тактики при узловом нетоксическом зобе. Известно, что не каждый определяемый узел в щитовидной железе связан с опухолевым процессом, а следовательно, не подлежит хирургическому лечению. В то же время основным показанием к оперативному вмешательству при узловых формах зоба является возможность злокачественного перерождения. Однако абсолютно надежных во всех случаях дооперационных способов распознавания его нет. Это обстоятельство привело к тому, что многие клиницисты считают обязательным хирургическое лечение всех узловых образований в щитовидной железе. Накопленный опыт показывает, что такая тактика нередко ведет не только к ненужной оперативной активности, но и благодаря «радикальности» вмешательств приводит к инвалидизации многих больных, обрекая их на постоянную заместительную терапию вследствие развития гипотиреоза. В этой сложной клинической ситуации особенно важными являются морфологическая верификация изменений в щитовидной железе и обязательная необходимость оперативного лечения при выявлении признаков, подозрительных в отношении опухоли. Операция является единственным методом радикального лечения при всех видах атипичных и аберрантных зобов. Вопрос об объеме операции при спорадическом зобе решается в зависимости от результатов обследования щитовидной железы: при наличии одиночного узла минимальным объемом вмешательства является гемитиреоидэктомия (удаление пораженной доли с перешейком), при многоузловом зобе и поражении обеих долей удаляют всю измененную ткань, максимально сохраняя неизменную часть железы. ЗЛОКАЧЕСТВЕННЫЕ НОВООБРАЗОВАНИЯ составляют относительно небольшую группу заболеваний щитовидной железы. В то же время щитовидная железа – наиболее часто поражаемый орган эндокринной системы, и прежде всего раковой опухолью. Неэпителиальные злокачественные опухоли (саркома, нейросаркома, лимфоретикулосаркома) встречаются значительно реже. Рак щитовидной железы составляет 0,5% в общей структуре всех новообразований у мужчин и 1% – у женщин. Этиология рака щитовидной железы не установлена, но выявлены некоторые предрасполагающие факторы. К ним относят длительную йодную недостаточность, гиперпластические процессы в железе, лучевые воздействия и т.д. Злокачественные новообразования наиболее часто развиваются в зобно-измененной железе, как с наличием, так и при отсутствии в ней узлов у больных тиреотоксикозом и в эутиреоидном состоянии. Рак чаще всего возникает в узловом зобе при наличии одиночного узла с нормальной или пониженной функцией. Влияние радиационного воздействия на возможность развития рака щитовидной железы особенно заметно, если облучение происходит в детском или подростковом возрасте. Наиболее частой формой является папиллярный рак, который диагностируется более чем в половине наблюдений. Фолликулярный рак составляет приблизительно пятую часть всех злокачественных опухолей этого органа. Папиллярный и фолликулярный раки относятся к наименее злокачественным формам рака щитовидной железы, отличаются медленным ростом и редко дают отдаленные метастазы. Медуллярный рак развивается из парафолликулярных С-клеток, обладает инфильтрирующим ростом, метастазирует как лимфогенным, так и гематогенным путем. Он может сочетаться с феохромоцитомой, аденомой паращитовидной железы (множественная эндокринная неоплазия II типа). Анапластический рак отличается особой злокачественностью, быстро прорастает капсулу и в окружающие ткани и органы и рано дает метастазы. По международной классификации опухолей по системе TNM рак щитовидной железы оценивается следующим образом: Т – первичная опухоль: Т0 – первичная опухоль не определяется; Т1 – опухоль до 1 см в наибольшем измерении, ограниченная тканью щитовидной железы; Т2 – опухоль до 4 см в наибольшем измерении, ограниченная тканью щитовидной железы; Т3 – опухоль более 4 см в наибольшем измерении, ограниченная тканью щитовидной железы; Т4 – опухоль любого размера, распространяющаяся за пределы капсулы щитовидной железы. N – регионарные лимфатические узлы: N0 – нет признаков метастатического поражения регионарных лимфатических узлов; N1 – имеется поражение регионарных лимфатических узлов метастазами; N1а – поражены местные лимфатические узлы на стороне опухоли; N1б – поражены шейные лимфатические узлы с обеих сторон, срединные или на противоположной стороне, медиастинальные. М – отдаленные метастазы: М0 – нет признаков отдаленных метастазов; М1 – имеются отдаленные метастазы. Клиническая картина заболевания определяется морфологической структурой опухоли. Точный диагноз до операции удается установить только у половины больных. Наличие узла в щитовидной железе может не вызывать симптомов болезни. В это время его трудно отличить от аденомы щитовидной железы. Рост опухоли медленный, и она долгое время не выходит за пределы железы. Такие особенности клинической картины характерны для папиллярного и фолликулярного рака. Медуллярный рак растет медленно, но быстрее, чем дифференцированные формы рака. Продуцирует кальцитонин. Нередко у больных наблюдаются поносы и связанная с этим потеря массы тела. Анапластический рак проявляется быстрым ростом и прорастанием опухоли в близлежащие структуры. Быстрое увеличение размеров зоба или нормальной щитовидной железы, усиление ее плотности, изменение контуров – симптомы, которые относятся к ранним клиническим признакам рака. Их появление должно заставить врача подумать о наличии у больного злокачественного новообразования. Диагноз становится более вероятным, если железа бугристая, малоподвижная, пальпируются шейные регионарные лимфатические узлы. С увеличением опухоли у больных появляется чувство давления и боли, затруднение дыхания, глотания. При сдавлении возвратного нерва изменяется звучность голоса. В более поздние сроки появляются симптомы, обусловленные метастазированием. Наиболее частая локализация отдаленных метастазов: кости и легкие. Диагностика. Диагноз злокачественного новообразования щитовидной железы основывается на особенностях клинической картины заболевания и данных дополнительных методов исследования. Большое значение из клинических симптомов придается быстрому росту определяемого в щитовидной железе новообразования. Из дополнительных методов исследования важными являются данные чрескожной пункционной биопсии и трепанбиопсии щитовидной железы. Однако следует иметь в виду, что нередко диагноз устанавливается лишь после гистологического исследования, произведенного во время операции или после нее. Лечение. Основным методом в лечении рака щитовидной железы является хирургический. Объем оперативного вмешательства определяется не только стадией новообразования, но и его гистологической формой. Больные с анапластическим раком к моменту госпитализации, как правило, имеют опухоль значительных размеров, требующей обширного травматического оперативного вмешательства, которое нередко оказывается паллиативным. Поэтому у таких больных нельзя ограничиться операцией. Только при комбинированном лечении можно рассчитывать на сколько-нибудь благоприятный результат. Необходимо проводить предоперационное облучение, а после операции – химиотерапию (адриамицин, блеомицин). Однако и такой вид лечения не дает благоприятных отдаленных результатов. При медуллярной форме рака щитовидной железы осуществляется экстирпация щитовидной железы с радикальной шейной лимфаденэктомией при наличии регионарных метастазов с последующей заместительной терапией тиреоидными гормонами (L-тироксин). При развитии признаков гипопаратиреоза назначают дигидротахистерол (тахистин, АТ-10) в сочетании с препаратами кальция (кальций-сандоз форте). При возможности выполнения радикальной операции лучевая терапия не является обязательным компонентом лечения. К гормонотерапии эта опухоль не чувствительна. Объем оперативного вмешательства при дифференцированных формах рака щитовидной железы определяется стадией процесса. Все остальные методы служат вспомогательными и не являются необходимыми при выполненной радикальной (тиреоидэктомия) операции. Основным видом ХИРУРГИЧЕСКОЙ ПАТОЛОГИИ НАДПОЧЕЧНИКОВ являются новообразования. Диагностика опухолей надпочечников улучшилась с внедрением компьютерной и магнитнорезонансной томографии, ультразвуковых исследований. С помощью этих исследований можно диагностировать опухоли надпочечников в «доклинической стадии». В корковом веществе надпочечников, имеющем 3 зоны: клубочковую, пучковую и сетчатую, могут возникать альдостеромы (синдром Конна; в клубочковой зоне), кортикостеромы, глюкостеромы (синдром Иценко-Кушинга; в пучковой зоне), андростеромы, кортикоэстромы (в сетчатой зоне). В мозговом веществе надпочечников возникают феохромоцитомы, феохромобластомы.
Рис. 73. Схема строения надпочечника и возможного развития клинических А – клубочковая зона; Б – пучковая зона; В – сетчатая зона;
Перечисленные выше опухоли являются гормонально-активными, проявляются артериальной гипертензией, изменениями внешнего вида больных, остеопорозом, почечным синдромом (альдостерома). При подозрении на опухоль надпочечников больные подлежат госпитализации для углубленного обследования: ангиография, сканирование Все опухоли надпочечника могут быть доброкачественными и злокачественными. КОРТИКОСТЕРОМА развивается из пучковой зоны коркового вещества надпочечника. Опухолевая ткань в избыточном количестве продуцирует кортизол, что является причиной развития синдрома Иценко-Кушинга. Заболевают чаще женщины (почти 80%) в возрасте 20-40 лет. В клинической картине преобладают симптомы, характерные для болезни Кушинга: ожирение, преимущественное отложение жира на туловище при одновременном истончении конечностей. Лицо становится лунообразным, его цвет приобретает багряно-цианотичный оттенок. На коже живота, подмышечных областей, бедер появляются «стрии» – фиолетово-красные с западающим дном полосы. Волосы на голове становятся редкими из-за их выпадения. У женщин наступает оволосение по мужскому типу. При специальном обследовании выявляется повышение артериального давления, сахарный диабет, диффузный остеопороз с деформацией тел позвонков. Нарушается половая функция: у женщин появляется дисменорея, аменорея, у мужчин – снижение или исчезновение либидо и потенции. У многих больных появляется депрессивный синдром, снижается память. В диагностике болезни решающая роль принадлежит изучению концентрации уровня 17-кетостероидов в крови и суточной моче, при кортикостероме этот показатель значительно повышен. Наиболее информативными для топической диагностики кортикостером являются КТ и МРТ, УЗИ применяется на начальном этапе диагностики. При определении объема операции необходимо проведение ангиографии с селективным забором проб крови для определения уровней кортизола в оттекающей от надпочечников крови и АКТГ из области предполагаемого расположения вненадпочечниковой опухоли. В отдельных случаях применяется сканирование надпочечников 131J-19-йодхолестеролом. Лечение – оперативное: удаление новообразования вместе с надпочечником, при злокачественном процессе – комбинированная операция с удалением пораженных органов (почки, селезенки, резекция толстой кишки, поджелудочной железы). При двустороннем поражении удаляются оба надпочечника вместе с опухолью. Одно из самых опасных осложнений после супраренэктомии – острая надпочечниковая недостаточность, для ее предупреждения проводится заместительная гормональная терапия препаратами кортикостероидного ряда (кортизон, гидрокортизон, преднизолон). Непрерывное капельное внутривенное введение гидрокортизона в дозе 300-400 мг/сут. позволяет предупредить развитие острой надпочечниковой недостаточности. В последующем больные переходят на таблеттированный преднизолон. АНДРОСТЕРОМА развивается из сетчатой зоны коркового вещества надпочечника. Клинические проявления болезни связаны с чрезмерной продукцией андрогенов. Заболевание возникает в молодом и зрелом возрасте. Чаще болеют женщины. В детском возрасте у девочек появляется гипертрихоз, ускоряется рост, чрезмерно развивается мускулатура, голос становится низким, грубым, развивается гипертрофия клитора. У мальчиков наступает преждевременное половое созревание: характерны усиление развития мускулатуры, невысокий рост, короткие нижние конечности, макрогенитосомия при атрофии яичек. У взрослых женщин заболевание проявляется симптомами маскулинизации с развитием мужских половых признаков – уменьшением подкожной жировой клетчатки, усилением развития мускулатуры, атрофией молочных желез, матки, нарушением менструальной функции, часто возникает гирсутизм. При исследовании гормонального профиля пациента выявляется резкое повышение концентрации 17-КС в моче. Лечение – оперативное, удаление опухоли. КОРТИКОЭСТРОМА (феминизирующая опухоль коркового вещества надпочечника) встречается редко. В основе болезни лежит гиперпродукция тканью опухоли эстрогенов. У девочек болезнь проявляется ускорением физического развития с ранним половым созреванием, у мальчиков – отставанием в половом развитии. У мужчин выявляются симптомы феминизации – гинекомастия, распределение подкожной жировой клетчатки по женскому типу, отсутствие волос на лице, повышение тембра голоса, снижение потенции вплоть до ее утраты, атрофия яичек и полового члена. У женщин гормональные проявления опухолевого роста не дают клинических симптомов. В моче обнаруживают увеличение концентрации эстрогенов. Лечение: оперативное удаление опухоли. АЛЬДОСТЕРОМА (синдром Конна, первичный альдостеронизм) развивается из клубочковой зоны коркового вещества надпочечника. В 1955 г. Конн описал клинический синдром, сопровождающийся постоянной артериальной гипертензией и снижением уровня калия в крови у женщины с аденомой коры надпочечника, выздоровевшей после удаления опухоли. В подавляющем большинстве случаев опухоль носит доброкачественный характер, и лишь в 5% – злокачественный. Опухолевая ткань вырабатывает в избыточном количестве альдостерон. Заболевание чаще возникает у женщин в возрасте 20-50 лет. Основные проявления синдрома Конна связаны с развившимся нарушением водно-солевого равновесия и с зависящей от избытка альдостерона артериальной гипертензией. Гиперпродукция альдостерона приводит к усилению реабсорбции натрия в канальцах почек и увеличению выделения калия и водородных ионов с мочой. Внутриклеточный калий замещается ионами натрия и водорода, развивается внутриклеточный ацидоз и внеклеточный алкалоз. Дефицит калия в организме – один из ведущих факторов в патогенезе синдрома Конна. Основным и постоянным симптомом заболевания является артериальная гипертензия, отличающаяся стойкостью, АД достигает высокого уровня (220-260/120-140 мм рт. ст.). В клинических проявлениях первичного альдостеронизма различают 3 синдрома: сердечно-сосудистый, нервно-мышечный и почечный. Сердечно-сосудистый связан с гипертонией (головные боли, изменения на глазном дне, гипертрофия сердца). Нервно-мышечный проявляется чаще миастенией, реже наблюдаются парестезии, параличи и тетанические судороги. Почечный синдром характеризуется калиепенической нефропатией: патологическое ощущение жажды (полидипсия), полиурия с преобладанием ночного диуреза (никтурия) над дневным. В анализах мочи обнаруживают изо– и гипостенурию, щелочную реакцию. При исследовании крови выявляют повышенное содержание альдостерона, низкий уровень калия, нередко гипернатриемию и гипохлоремический алкалоз. Активность ренина плазмы снижена (нередко до 0). В моче отмечается гиперкалиурия и гипонатриурия. В диагностике важным является установление самого факта гиперальдостеронизма. Углубленному исследованию подвергаются больные артериальной гипертензией, в 1% случаев выявляется альдостерома. Проводятся повторные анализы крови и мочи, определяется содержание калия, альдостерона, ренина плазмы. Выполняется УЗИ, КТ, ангиография. При выявлении альдостеромы проводится оперативное удаление опухоли вместе с остатком надпочечника. В предоперационном периоде проводится коррекция нарушений водно-солевого обмена, проведение гипотензивной и кардиотонизирующей терапии. ФЕОХРОМОЦИТОМА развивается из мозгового вещества надпочечника или хромаффинной ткани в области симпатических ганглиев и параганглиев брюшной полости, забрюшинного пространства, заднего средостения, на шее и в полости черепа. Опухоль может быть одиночной и множественной, доброкачественной и злокачественной. Заболевание чаще возникает в зрелом возрасте одинаково часто у мужчин и женщин. Феохромоцитома может сочетаться с опухолями других эндокринных желез (МЭН-2а и МЭН-2в). Наиболее известны сочетания феохромоцитомы надпочечника и медуллярного рака ЩЖ (синдром Сиппла) с поражением паращитовидных желез – МЭН-2а, при синдроме Горлина (МЭН-2в) имеются те же поражения в сочетании с множественными нейрофибромами слизистых оболочек губ, полости рта, век и марфаноподобная внешность без поражений паращитовидных желез. Отмечено возникновение феохромоцитомы у нескольких членов одной семьи, что говорит о генетической предрасположенности к ее появлению у детей. Клинические проявления заболевания обусловлены гиперпродукцией тканью опухоли адреналина и норадреналина. Главным симптомом феохромоцитомы является артериальная гипертензия, которая может быть 2-х типов: стабильной (70%) и пароксизмальной (30%). Артериальная гипертензия достигает высоких цифр (300 мм рт. ст.). Наблюдаются головные боли, потливость, повышенная возбудимость, беспокойство, дрожание рук, бледность лица, тошнота. Приступы могут продолжаться от нескольких минут до многих часов и самостоятельно прекращаться. Симптомы гиперметаболизма и нарушения углеводного обмена обусловлены ускорением обменных процессов. У больных может быть выявлено повышение основного обмена, похудание, в период криза повышается глюкоза в крови. В диагностике феохромоцитомы ведущая роль принадлежит исследованию концентрации катехоламинов в моче. Исследуется экскреция катехоламинов или их дериватов (ванилилминдальной кислоты) в суточной моче. Эта кислота является метаболитом обоих гормонов (адреналина и норадреналина) и ее концентрация в моче резко повышается при феохромоцитоме. В топической диагностике проводятся УЗИ, КТ, ангиография, завершающим этапом исследования перед операцией является пункционная биопсия под контролем УЗИ. Дата добавления: 2015-12-16 | Просмотры: 134537 | Нарушение авторских прав |