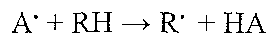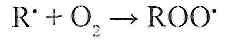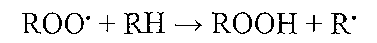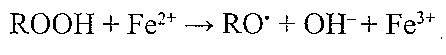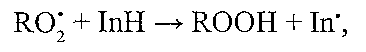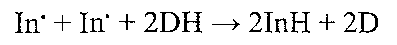|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Додаткові ознаки клінічної смерті 6 страница42.Основи трансплантації органів і тканин. Причини і механізми відторгнення трансплантату, засоби попередження. Реакції «трансплантат проти хазяїна». Що таке реакція "трансплантат проти хазяїна "? За яких умов і вона виникає? Реакція "трансплантат проти хазяїна" (гомологічна хвороба) — це імунна агресія пересаджених клітин донора, спрямована проти антигенних структур реципієнта. Для її виникнення потрібна низка умов, зокрема: 1) стан імунологічної недостатності у реципієнта (імунологічна незрілість у плода і новонароджених, первинні й вторинні імунодефіцити); 2) трансплантація імунокомпетентних клітин; 3) антигенні відмінності між донором і реципієнтом. Якщо створюються такі умови, то імунокомпетентні клітини (лімфоцити) донора нічим не обмежуються у своєму розвитку й починають реагувати на тканини хазяїна комплексом клітинних і гуморальних імунних реакцій. 43.Пошкодження клітини, принципи класифікації. Клітинна смерть Ушкодження клітини — це типовий патологічний процес, основу якого становлять зміни внутрішньоклітинного гомеостазу, що призводять до порушення структурної цілісності клітини і її функціональних властивостей. Залежно від швидкості розвитку й вираженості основних проявів ушкодження клітини може бути гострим і хронічним, залежно від ступеня змін внутрішньоклітинного гомеостазу — оборотним і необоротним, залежно від періоду життєвого циклу, на який припадає дія ушкоджувального агента, - мітотичним та інтєрфазним, залежно від патогенетичних механізмів ініціювання ушкодження - насильницьким і цитопатичним. 11.2. Які чинники можуть викликати ушкодження клітини? Безпосереднє (первинне) ушкодження клітини виникає в результаті прямої дії факторів: 1) фізичної природи (механічний вплив, висока й низька температури, іонізуюче випромінювання та ін.); 2) хімічного походження (кислоти, луги, низькомолекулярні органічні сполуки, ферменти та ін.); 3) біологічної природи (віруси, бактерії, найпростіші). Опосередковане (вторинне) ушкодження виникає як наслідок первинних порушень сталості внутрішнього середовища організму (гіпоксія, ацидоз і алкалоз, гіпер-і гіпоосмія, гіпоглікемія та ін.). 11.3. Які ознаки свідчать про ушкодження клітини? Про ушкодження клітини свідчать такі ознаки: 1. Структурні. їх виявляють за допомогою гістологічних і електронномікроскопіч-них методів дослідження, вони є предметом вивчення патологічної анатомії. 2. Функціональні. До них відносять: порушення електрофізіологічних процесів (деполяризація плазматичної мембрани, зміни властивостей збудливості й провідності, розвиток парабіозу); розлади скоротливості, екзо- і ендоцитозу; порушення клітинного поділу, міжклітинних контактів і взаємодій; зміни у сприйнятті клітиною нервових і гуморальних регуляторних впливів. 3. Фізично-хімічні, які охоплюють: а) порушення з боку клітинних колоїдів (зменшення ступеня дисперсності колоїдів цитоплазми і ядра, підвищення в'язкості цитоплазми, зміна сорбційних властивостей стосовно вітальних барвників) і б) зміни водно-електролітного обміну (збільшення концентрації в цитоплазмі іонів натрію та кальцію і зменшення концентрації іонів калію, набряк клітини і окремих її органел, накопичення іонів водню — ацидоз ушкодження). 4. Біохімічні: 1) зменшення концентрації високоенергетичних сполук— креатинфосфату і АТФ - і збільшення концентрації продуктів їх гідролітичного розщеплення — креатину, АДФ, АМФ, неорганічного фосфату; 2) пригнічення тканинного дихання; 3) роз'єднання окиснення й фосфорування; 4) активація гліколізу; 5) активація процесів протеолізу; 6) збільшення інтенсивності процесів дезамінування. 5. Термодинамічні. Це декомпартменталізація, тобто порушення відносної відособленості внутрішньоклітинних відсіків; конформаційні зміни макромолекул, що відбуваються в напрямку найбільш вигідного термодинамічного стану (денатурація); розпад великих, складних молекул на дрібні, простіші; вирівнювання концентраційних градієнтів як між клітинними відсіками, так і між клітиною та позаклітинним середовищем. 11.4. Чим принципово відрізняються два патогенетичних варіанти ушкодження клітини: насильницький і цитопатичний? Насильницьке ушкодження розвивається при дії на здорову клітину фізичних, хімічних і біологічних факторів, інтенсивність яких перевищує звичайні збуджувальні впливи, до яких клітина адаптована. Цитопатичний варіант виникає в результаті первинного порушення захисно-компенсаторних гомеостатичних механізмів клітини. У цьому випадку факторами, що запускають патогенетичні механізми ушкодження, є природні для даної клітини збуджувальні стимули, які в цих умовах стають ушкоджувальними. До цитопа-тичного варіанта відносять усі види ушкодження клітини, спричинені відсутністю яких-небудь необхідних для неї компонентів (при гіпоксії, голодуванні, гіпо- і авітамінозах, антиоксидантній недостатності, генетичних дефектах, порушеннях нервової трофіки та ін.). Розрізняють два механізми загибелі клітин: некроз і апоптоз. Некроз - це загибель необоротно ушкоджених клітин, яка відбувається за участю лізосомних ферментів, що здійснюють гідролітичне розщеплення усіх компонентів клітини (аутоліз), руйнують плазматичну мембрану і зумовлюють вихід вмісту клітини за ЇЇ межі в навкружну тканину з наступним розвитком запалення. Апоптоз— це шлях запрограмованої загибелі клітин ("самогубство"), що відбувається за участю спеціально призначених для цього активованих ферментів (кас-паз), які руйнують власну ДНК, ядерні білки і білки цитоскелета, не ушкоджуючи при цьому плазматичну мембрану. Основні відмінності між некрозом і апоптозом представлено в табл.
11.22. Назвіть основні причини апоптозу. I. Фізіологічний апоптоз відбувається: а) у період ембріогенезу (імплантація, органогенез, онтогенетична інволюція, метаморфоз) відповідно до генетичної програми знищення клітин, які вже більше не потрібні; б) під час гормон-залежної інволюції органів у дорослих (загибель клітин ен-дометрію під час менструального циклу, атрезія фолікулів яєчника під час менопаузи, зменшення маси молочних залоз після припинення лактації); в) у популяціях клітин з високою інтенсивністю проліферативних процесів для підтримання сталої кількості клітин (наприклад, у криптах слизової тонкої кишки); г) у клітинах, що вже виконали свою функцію (у нейтрофілах по завершенню гострого запалення, у лімфоцитах у кінці імунної відповіді; ґ) у потенційно небезпечних для організму лімфоцитах (клітинах так званих "заборонених клонів'1); д) під час дії цитотоксичних Т-лімфоцитів (Т-кілерів) на уражені вірусами і пухлинні клітини. II. Апоптоз в патологічних умовах може відбуватися: а) унаслідок дії патогенних чинників, що спричиняють необоротне ушкодження ДНК (іонізуюча радіація, протипухлинні препарати); б) в інфікованих вірусами клітинах (наприклад, при вірусному гепатиті); в) у паренхіматозних органах у процесі розвитку атрофії, що виникає як наслідок обтурації їхніх вивідних проток (підшлункова і слинні залози); г) у пухлинах — як під час їхньої регресії, так і в процесі активного росту; ґ) під впливом чинників, що збільшують проникність мітохондріальних мембран. 11.23. Як здійснюється апоптоз? Розрізняють три послідовні фази апоптозу. І. Фаза ініціювання. Суть її полягає в послідовній активації так званих "суїцид- них" ферментів — каспаз (їх сьогодні налічують понад 10). Існує два шляхи такої активації: зовнішній і внутрішній. Зовнішній (рецепторопосередкований) шлях пов'язаний з існуванням на поверхні клітинної мембрани так званих "рецепторів смерті" (із сімейства рецепторів до фактора некрозу пухлин - ФНП). Взаємодія цих рецепторів з ФНП та деякими іншими лігандами спричиняється до появи в цитоплазмі (з внутрішнього боку плазматичної мембрани поблизу активованого рецептора) б ілка-п о середника, який активує протеазу- каспазу-8 (у людини- каспазу-10). Активна каспаза-8 започатковує каскад реакцій (у тому числі і аутокаталітичних), під час яких відбувається перетворення неактивних прокаспаз в активні каспази - ферменти, що "вбивають" клітину. Внутрішній (мітохондріальний) шлях пов'язаний зі збільшенням проникності мітохондріальних мембран (утворенням "мітохондріальної пори") та виходом із мітохондрій у цитоплазму так званих проапоптичних сполук- цитохрому с, апоптозіндукуючого фактора (АІФ) та ін. Утворення "мітохондріальної пори " відбувається внаслідок заміни антиапоптичних білків в мембрані мітохондрій на проапоптичні білки. Така заміна має місце тоді, коли припиняється дія на клітину факторів росту та інших стимуляторів клітинної активності. Цитохром с, потрапивши в цитоплазму, разом з білком цитозолю - апоптозактивуючим фактором (ААФ) утворює комплекс, який активує каспазу-9. Зазначена протеаза започатковує процес утворення інших активних каспаз (див. вище). II. Фаза вбивання ("екзекуції"). У результаті наведених вище подій утворюються активні форми каспаз-екзекуторів (каспаза-3, каспаза-6 та ін.). Ці протеази: а) розщеплюють білки цитоскелета; б) руйнують білки матриксу ядра; в) активують цитоплазматичну ДНК-азу через розщеплення її білкового інгібітора. Унаслідок цього змінюються форма і об'єм клітини, ядро розпадається на окремі фрагменти, а сама клітина на так звані апоптичні тільця — утвори, що зовні мають мембрану, а всередині містять спресовані органели і окремі фрагменти ядра. Ш. Фаза вилучення загиблих клітин. Здійснюється макрофагами шляхом фагоцитозу мертвих клітин і апоптичних тілець. Цьому сприяє вивільнення клітинами ще на ранніх фазах їхнього апоптозу речовин-хемотаксинів, а також поява на поверхні клітин, що гинуть, білків-маркерів, які дають змогу макрофагам розпізнавати мертві клітини серед ще живих. Важливе значення цього етапу полягає в тому, що своєчасний фагоцитоз загиблих клітин запобігає їхньому некрозу, виходу з клітин лізосомних ферментів і розвитку запалення. 44.Універсальні механізми клітинного пошкодження. Які зміни на молекулярному рівні мають велике значення в патогенезі ушкодження клітини? * Можна виділити 6 груп молекулярних механізмів, що відіграють важливу роль у патогенезі ушкодження клітин: ліпідні (пероксидне окиснення ліпідів, активація мембранних фосфоліпаз, детергентна дія вільних жирових кислот), кальцієві, електролітно-осмотичні, ацидотичні, протеїнові і нуклеїнові. 11.6. У чому сутність пероксидного окиснення ліпідів? Пероксидним окисненням ліпідів (ПОЛ) називають вільнорадикальне окиснення ненасичених жирових кислот, що входять до складу фосфоліпідів клітинних мембран. Ініціаторами ПОЛ є вільні радикали, серед яких найбільше значення мають: 'О " (Н02") - супероксидний радикал; ОН' - гідроксильний радикал; Н' - водневий радикал; *02 - синглетний (збуджений) кисень. 11. 7. Які реакції лежать в основі ініціювання пероксидного окиснемня ліпідів? Первинний вільний радикал, що з'явився в клітині (А') взаємодіє з молекулою ненасиченої жирової кислоти (RH), у результаті чого утворюється вільний радикал цієї кислоти (R') і молекулярний продукт реакції (НА):
Вільний радикал жирової кислоти, що утворився, взаємодіє з молекулярним киснем, який завжди міститься в клітині, у результаті чого з'являється пероксидний радикал цієї кислоти (ROO'):
Пероксидний радикал, у свою чергу, вступає у взаємодію з новою молекулою ненасиченої жирової кислоти, що міститься поруч. У ході цієї реакції утворюється гідропероксид (ROOH) і новий вільний радикал:
Слід зазначити дві важливі особливості ПОЛ. Перша полягає в тому, що реакції ПОЛ мають ланцюговий характер. Це означає, що в ході реакцій ПОЛ не відбувається знищення вільних радикалів і в процес утягуються все нові й нові молекули нена-сичених жирових кислот. Друга особливість- це розгалужений характер ПОЛ. Інакше кажучи, у реакціях ПОЛ у кількості, що наростає, з'являються вільні радикали, джерелом яких є самі проміжні продукти ПОЛ. Прикладом може бути утворення вільних радикалів з гідропероксидів ліпідів при їхній взаємодії з наявними в клітині металами змінної валентності:
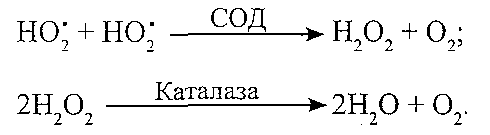
Через те що в багатьох біохімічних реакціях за умов норми утворюється невелика кількість вільних радикалів, існує постійна небезпека активації ПОЛ в клітині. Однак у природних умовах цього не відбувається, оскільки клітина має у своєму розпорядженні механізми антиоксидантного захисту, завдяки яким досягається інактивація вільних радикалів, обмеження й гальмування ПОЛ. 11.8. Які антиоксидантні системи є в клітинах? І. Ферментні антиоксидантні системи: 1. Супероксгіддисмутазна. Компоненти: супероксиддисмутаза (СОД), каталаза. Призначення: інактивація супероксидних радикалів (HOj):
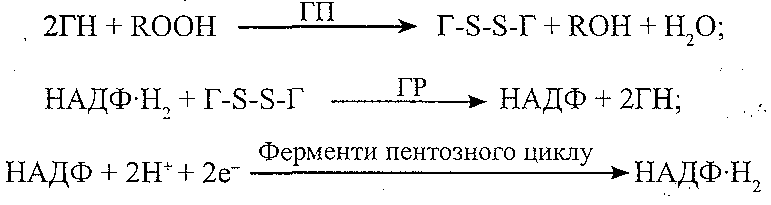
Причини порушень: набуті розлади синтезу ферментів, дефіцит міді і заліза. 2. Глютатіонова. Компоненти: глютатіон (Г), глютатіонпероксидаза (ГП), глютатіонредуктаза (ГР), НАДФ-Н2. Призначення: інактивація і руйнування гідропероксидів ліпідів:
Причини порушень: спадково обумовлені і набуті порушення синтезу ферментів, дефіцит селену, порушення пентозного циклу (зменшення утворення НАДФН2). II. Неферментні антиоксиданти: 1. "Істинні" антиоксиданти. Компоненти: токофероли, убіхінони, нафтохінони, флавоноїди, стероїдні гормони, біогенні аміни. Призначення: інактивація вільних радикалів жирових кислот:
де In — антиоксидант; In' — вільний радикал цього антиоксиданту, що має низьку реакційну здатність. Причини порушень: гіповітаміноз Е, порушення регенерації "істинних" антиоксидантів. 2. Допоміжні антиоксиданти. Компоненти: аскорбінова кислота, сполуки, що містять сірку - глютатіон, цистин, цистеїн. Призначення: регенерація "істинних" антиоксидантів:
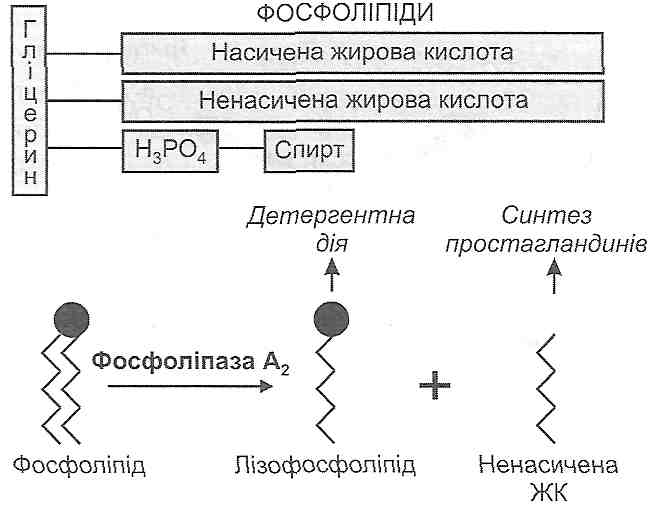
де DH - відновлена, D — окиснена форма допоміжного антиоксиданту. Причини порушень: гіповітаміноз С, порушення пентозного циклу, дефіцит сполук, що містять сірку. 11.9. У яких випадках відбувається активація ПОЛ? Активація ПОЛ відбувається: 1) при надмірному утворенні первинних вільних радикалів (ультрафіолетове й іонізуюче випромінювання, гіпероксІя, отруєння чотирихлористим вуглецем, гіпервітаміноз D та ін.); 2) при порушенні функціонування антиоксидантних систем (недостатність ферментів - супероксиддисмутази, каталази, глютатіон пер оксид ази, глютатіонредуктази; дефіцит міді, заліза, селену; гіповітамінози Е, С; порушення пентозного циклу). 11.10. Які механізми лежать в основі порушень бар'єрних функцій клітинних мембран при активації ПОЛ? I. Іонофорнш механізм обумовлений появою в клітині речовин, що мають властивості іонофорів, тобто сполук, здатних полегшувати дифузію іонів через мембрану завдяки утворенню комплексів, що проходять через її шари. У процесі активації ПОЛ серед проміжних продуктів його реакцій з'являються речовини-іонофори для іонів кальцію і водню. У результаті цього підвищується проникність клітинних мембран до цих іонів. II. Механізм електричного пробою пов'язаний з існуванням на багатьох мембранах (плазматичній, внутрішній мітохондріальній) різниці потенціалів. У результаті появи гідрофільних продуктів ПОЛ порушуються електроізоляційні властивості гідрофобного шару клітинних мембран, що призводтггь до електричного пробою мембрани, тобто до електромеханічного її розриву з утворенням нових трансмембранних каналів іонної провідності. 11.11. Як порушується матрична функція мембран у процесі активації ПОЛ? Сутність матричної функції ліпідного подвійного шару мембран полягає в тому, що в ньому вмонтовані мембранні ферменти та деякі спеціалізовані білки. У процесі ПОЛ порушується активність мембранних ферментів, оскільки змінюється їх ліпідне мікрооточення, яке багато в чому визначає властивості білкових молекул. Крім того, у ході реакцій ПОЛ відбувається утворення "зшивок" між молекулами білків і фосфоліпідів, а також окиснення сульфгідрильних груп активних центрів, що призводить до необоротної інактивації ферментів. 11.12. Яким чином підвищення активності фосфоліпаз впливає на ушкодження клітинних мембран? У патогенезі ушкодження клітини велике значення має надмірна активація фос-фоліпази А2 - ферменту, що здійснює гідролітичне відщеплення ненасичених жирових кислот від молекул фосфоліпідів клітинних мембран (рис. 33). У результаті цього утворюються лізофосфоліпіди, в молекулах яких лише один жировокислотний "хвіст", у зв'язку з чим вони мають здатність до міцелоутворення і є дуже сильними
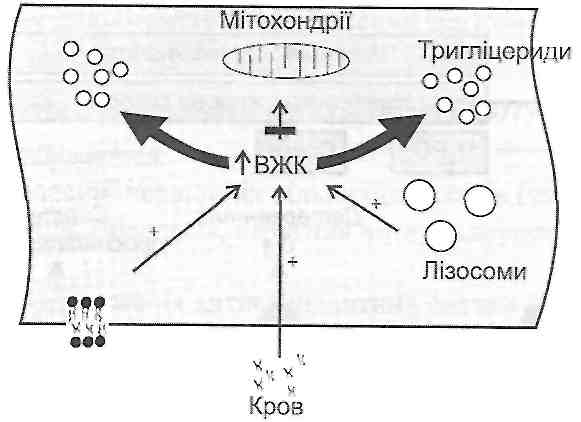
Рис. 33. Утворення лізофосфоліпідів детергентами (рис. 34). З детергентною дією лізофосфоліпідів і пов'язане ушкодження клітинних мембран в умовах надмірної активації фосфоліпази А,, яку, як правило, викликають високі концентрації іонів кальцію в цитоплазмі клітини. 11.13. За яких умов виникає небезпека детергентноїдії вільних жирових кислот на клітинні мембрани? Детергентна дія вільних жирових кислот (ВЖК) виявляється при збільшенні їхнього вмісту в клітині. Це може бути обумовлене (оис. 35):
Рис. 34. Підвищення проникності клітинних мембран внаслідок детергентної дії лізофосфоліпідів а) посиленим надходженням ВЖК у клітину при гіперліпацидемії (наприклад, активація ліполізу в жировій тканині при стресі, цукровому діабеті); б) вивільненням ВЖК у лізосомах із тригліцеридної частини ліпопротеїдів, що надійшли в клітину із плазми крові (наприклад, гіперліпопротеїнемія при атеросклерозі); в) вивільненням ВЖК із фосфоліпідів мембран під дією мембранних фосфоліпаз; г) порушеннями використання ВЖК як джерела енергії (зменшення активності ферментів Р-окиснення і циклу Кребса, наприклад, при гіпоксії). Для того щоб запобігти ушкоджувальній дії надлишку жирових кислот, клітина має у своєму розпорядженні систему ферментів, які переводять вільні жирові кис-
Рис. 35. Причини накопичення вільних жирових кислот (ВЖК) у клітині лоти у форму триглщеридів. При цьому відбувається невластиве для норми відкладення тригліцеридів у вигляді жирових крапель, тобто виникає жирова дистрофія клітини. 11.14. У яких випадках іони кальцію втягуються в патогенез ушкодження клітини? З якими ефектами цих іонів пов 'язана їхня участь в ушкодженні клітинних структур? Ушкодження клітинних структур може бути обумовлене стійким підвищенням концентрації іонів Са2+ у цитоплазмі клітини. Така ситуація виникає або в результаті надмірного надходження іонів Са2+ у цитоплазму (гіперкальціємія, підвищення проникності плазматичної мембрани), або в результаті порушення механізмів, що забезпечують видалення іонів Са2+ із цитоплазми (порушення Са-насосів, Na-Ca-об-мінного механізму, Са-акумулгоючої функції мітохондрій). Підвищення концентрації іонів Са2т у цитоплазмі викликає: а) контрактуру (пер є скорочення) фібрилярних структур клітини (міофібрил, елементів цитоскєлета); б) активацію фосфоліпази А,; в) роз'єднання процесів окиснення й фосфорування. 11. 15. Чим можуть бути обумовлені зміни вмісту іонів натрію й калію в клітині і яка роль таких порушень у патогенезі клітинного ушкодження? Вирівнювання концентрацій іонів Na+ і К + по обидва боки плазматичної мембрани (збільшення вмісту Na+ і зменшення вмісту К+ у цитоплазмі) у своїй основі може мати два механізми: 1) посилену дифузію іонів через плазматичну мембрану за існуючим концентраційним і електричним градієнтом і 2) порушення механізмів активного транспорту Na+ і К+ (Na-K-насоса). Перший механізм реалізується в умовах загальних порушень водно-електролітного обміну (гіпернатріємія, гіпокаліємія) і порушень бар'єрної функції плазматичної мембрани (підвищення її іонної проникності). Розлади функції Na-K-насоса можуть бути обумовлені дефіцитом АТФ у клітині, збільшенням вмісту холестеролу в ліпідному бішарі мембрани (наприклад, при атеросклерозі), дією цілої низки специфічних інгібіторів Na-K-АТФ-ази (наприклад, строфантину). Зміни вмісту іонів Na+ і К+ викликають: а) втрату клітиною електричного мембранного потенціалу (потенціалу спокою), а отже і збудливості; б) набряк клітини; в) осмотичне розтягнення клітинних мембран, що супроводжується підвищенням їх проникності. 11. 16. Чим може бути обумовлений розвиток внутрішньоклітинного ацидозу і які зміни в клітині можуть бути з ним пов 'язані? До розвитку внутрішньоклітинного ацидозу можуть спричинятися: 1) надмірне надходження іонів Н+ у клітину з позаклітинного середовища (декомпенсований газовий або негазовий ацидоз); 2) надмірне утворення кислих продуктів у самій клітині при активації гліколізу (молочна кислота), порушеннях циклу Кребса (три- і дикарбонові кислоти), гідролітичному розщепленні фосфоліпідів клітинних мембран (вільні жирові кислоти, фосфорна кислота) та ін.; 3) порушення зв'язування вільних іонів Н+ у результаті недостатності буферних систем клітини; 4) порушення виведення іонів Н+ з клітини при розладах Na-H-обмінного механізму, а також в умовах порушеного місцевого кровообігу в тканині. Внутрішньоклітинний ацидоз викликає: а) зміну конформації білкових молекул з порушенням їх ферментативних, скоротливих та інших властивостей; б) підвищення проникності клітинних мембран; в) активацію лізосомних гідролітичних ферментів. 11.17. Які зміни білкових молекул мають значення в патогенезі ушкодження клітини? До білкових (протеїнових) механізмів ушкодження клітини можна віднести: 1) інгібуванння ферментів (оборотне і необоротне); 2) денатурацію, тобто порушення нативної будови білкових молекул у результаті обумовлених розривом ковалентних зв'язків змін вторинної й третинної структур білка; 3) протеоліз, що здійснюється під дією лізосомних протеолітичних ферментів (ка-тепсинів) і протеаз, які активуються іонами Са2+, У результаті протеолізу можуть з'являтися пептиди, що мають властивості фізіологічно активних речовин. З виходом останніх з ушкоджених клітин може бути пов'язаний розвиток як місцевих, так і загальних реакцій організму (запалення, гарячка). 11. 18. Які порушення функціонування генетичного апарату клітини можуть призводити до її ушкодження? Основу ушкодження клітини можуть становити так звані нуклеїнові механізми, обумовлені порушеннями процесів: 1) реплікації ДНК (денатурація ДНК, ушкодження ДНК-репліказної ферментної системи, дефіцит трифосфонуклеотидів - АТФ, ГТФ, ТТФ і ЦТФ); 2) транскрипції (мутаційні дефекти генної матриці, інгібування ДНК-залежної РНК-полімерази антибіотиками й токсинами, порушення посттранскрипційної модифікації інформаційної РНК: неприєднання "кепа" до головного кінця молекули, порушення утворення полі-А-хвоста, розлади сплайсингу тощо); 3) трансляції (дефіцит або якісні зміни інформаційної, рибосомної або транспортної РНК, а також рибосомних ферментів і нєферментних білків; дефіцит вільних амінокислот і АТФ; інгібування процесу антибіотиками й мікробними токсинами). 11.19. Які існують універсальні механізми підвищення проникності клітинних мембран при ушкодженні клітини? Підвищення проникності клітинних мембран може бути обумовлене: 1) активацією пероксидного окиснення ліпідів; 2) активацією фосфоліпаз; 3) осмотичним розтягненням мембран; 4) адсорбцією білків (поліелектролітів) на мембрані; 5) змінами фазового стану мембранних ліпідів (ацидоз, зміна температури). Які порушення виникають у клітині в результаті ушкодження окремих її органоїдів (плазматичної мембрани, мітохондрій, ендоплазматичногоретикулуму лізосом)? Порушення бар'єрної функції плазматичної мембрани призводить до вирівнювання існуючих у нормі концентраційних градієнтів речовин: у клітину надходять іони Na+, Са2+, СІ", а виходять іони К+, Mg2+, неорганічного фосфату, низько- і високо-молекулярні органічні сполуки (АМФ, АДФ, проміжні продукти клітинного обміну, білки-ферменти). З ушкодженнями білків і глікопротеїдних комплексів, вбудованих у плазматичну мембрану, пов'язані порушення систем активного транспорту речовин (Na-K-, Са-насосів; Na-Ca- і Na-H-обмінних механізмів); зміни специфічних іонних каналів (Na-, K-, Са-каналів); порушення клітинних рецепторів, що сприймають зовнішні регуляторні сигнали (а- і)3-адренорецепторів, ш- і n-холінорецепторів та ін.); порушення міжклітинних взаємодій; зміни антигенних властивостей клітини. Ушкодження мітохондрій супроводжується або пригніченням процесів клітинного дихання, або ефектом роз'єднання процесів окиснення й фосфорування. І в тому, і в другому випадку результатом розладів мітохондріальних функцій буде порушення енергозабезпечення клітини (рис. 36). Ушкодження шорсткого ендоплазматичного ретикулуму призводить до деза-грегації полісом, унаслідок чого порушуються реакції біосинтезу білка в клітині. У результаті ушкодження гладкого ендоплазматичного ретикулуму і його ферментних систем страждають процеси детоксикації, мікросомного окиснення та ін. У деяких клітинах, наприклад м'язових, порушується здатність ендоплазматичного (саркоплазма-тичного) ретикулуму депонувати іони Са2+, що сприяє реалізації так званих кальцієвих механізмів ушкодження клітини. Підвищення проникності лізосомних мембран призводить до виходу в цитоплазму гідролітичних ферментів, активація яких у кінцевому підсумку викликає необоротні зміни клітини — її аутоліз.
45.Механізми клітинного захисту і адаптації клітин до дії пошкоджуючих факторів. Які захисно-компенсаторні механізми має ушкоджена клітина? Все різноманіття захисно-компенсаторних реакцій клітини у відповідь на її ушкодження можна умовно розділити на дві групи. I. Реакції, спрямовані на відновлення порушеного внутрішньоклітинного гомеостазу: а) активація механізмів активного транспорту речовин (Na-K-, Са-насосів; Na-Ca-, Na-H-обмінних механізмів, мікровезикулярного транспорту); б) посилення регенерації антиоксидантів; в) зв'язування вільних жирових кислот (синтез тригліцеридів); г) активація синтезу білків, нуклеїнових кислот, фосфоліпідів та ін. Неодмінною умовою реалізації цих механізмів є достатнє енергозабезпечення клітини. Це досягається підвищенням інтенсивності енергетичного обміну (активація гліколізу, клітинного дихання, пентозного циклу) і перерозподілом наявних у клітин енергетичних ресурсів. II. Реакції, спрямовані на створення функціонального спокою ушкодженої клітини. їхня мета полягає в тому, щоб усунути можливі додаткові зрушення внутрішньоклітинного гомеостазу при дії фізіологічних збуджувальних факторів (стабілізація ушкодження) і звести до мінімуму енергетичні витрати на виконання специфічних функцій клітини. Дата добавления: 2016-03-26 | Просмотры: 861 | Нарушение авторских прав |