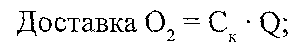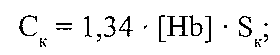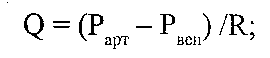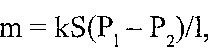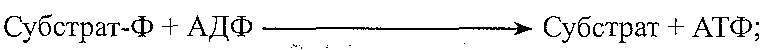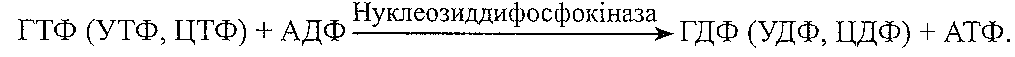|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Додаткові ознаки клінічної смерті 11 страницаОсновний обмін спочатку трохи збільшується, а потім поступово зменшується і стає на 10—20 % менше вихідного. Розвивається негативний азотистий баланс. 18.5. Що характерно для другого періоду голодування - періоду максимального пристосування? Середня його тривалість — 40-50 діб. Темпи зменшення маси тіла уповільнюються і становлять 0,5-1 % на добу. Відчуття голоду зникає. Основним джерелом енергії є жири, про що свідчить дихальний коефіцієнт, який дорівнює 0,7. Гіпоглікемія збільшує надходження в кров ліполітичних гормонів (адреналіну, глюкокортикоїдів, глюкагону). Унаслідок цього відбувається мобілізація жиру з депо — розвивається гіперліпацидемія. Вона, у свою чергу, є причиною посиленого утворення кетонових тіл у печінці. Кетонемія, що виникає, може призводити до не-газового ацидозу. Основний обмін у цей період на 10-20 % нижче вихідного рівня. Азотистий баланс негативний. 18.6. Як втрачають масу різні органи і тканини в другому періоді голодування? Втрата маси в другому періоді голодування становить: жирова тканина — 97 %,' селезінка — 60 %, печінка — 54 %, сім'яники — 40 %, м'язи - 31 %, кров - 26 %, нирки - 26 %, нервова система - 4 %, серце - 3,6 %. 18.7. Дайте характеристику третього періоду голодування. Цей період називають термінальним, тому що він передує смерті. Його тривалість 2—3 доби. Відбувається інтенсивний розпад тканин, розвивається інтоксикація. Основним джерелом енергії є білки, про що свідчить дихальний коефіцієнт, який дорівнює 0,8. Збільшується виділення із сечею азоту, калію, фосфатів (ознаки деструкції клітин і тканинних білків). Смерть настає при зменшенні маси тіла до 50 % від вихідної. 74.Патофізіологія неповного та часткового (якісного) голодування. Види, причини та механізми найбільш важливих проявів. Поняття про лікувальне голодування. 18.8. Які фактори визначають максимально можливу тривалість повного голодування із уживанням води? І. Ендогенні фактори: а) вид тварини- б) вік; в) стать; г) кількість і якість жирових та білкових резервів організму; ґ) загальний функціональний стан організму; д) м'язова робота. Усі зазначені чинники впливають на тривалість голодування, змінюючи величину основного обміну. Що вищий рівень основного обміну, то менша тривалість голодування, і навпаки. її. Екзогенні фактори. Це чинники зовнішнього середовища, які збільшують енер-говитрати організму. Такими є: а) низька температура навколишнього середовища; б) висока вологість повітря; в) велика швидкість руху повітря. 18.11. Назвіть особливості неповного голодування. Неповне голодування (енергетична недостатність) розвивається, коли енергетична цінність їжі не задовольняє енергетичні потреби організму. Неповне голодування від повного відрізняється такими особливостями: 1) тривалістю (неповне голодування може тривати місяці, роки); 2) більш вираженими деструктивними змінами в тканинах; 3) значно більшим зменшення основного обміну (на 30—40 %); 4) розвитком виражених набряків унаслідок зменшення вмісту білків у плазмі крові; 5) великого падіння маси тіла не відбувається через затримку рідини в організмі; 6) відновити життєдіяльність систем організму після неповного голодування набагато складніше. 75.Білково-калорійна недостатність, форми. Патогенез основних клінічних проявів. 18.12. Що таке білково-енергетична недостатність? Наведіть приклади. Білково-енергетична недостатність — це стан, що виникає як результат поєднання неповного і якісного білкового голодування. Прикладами є: а) аліментарна дистрофія. Описана в Ленінграді під час облоги в роки другої світової війни. У її патогенезі, крім білкової й енергетичної недостатності, мають значення й додаткові чинники: холод, фізичне стомлення, нервово-психічна напруга; б) аліментарний маразм. Розвивається в дітей віком до одного року. На перше місце виступає енергетична недостатність; в) квашіоркор. Розвивається в дітей віком 3-6 років. Головним у патогенезі є білкова недостатність. Енергетичний дефіцит компенсується надлишковим споживанням вуглеводів. 18.13. Якими клінічними синдромами виявляє себе білково-енергетична недостатність? І. Недостатнє надходження в організм білків призводить до порушення білоксин-тетичної функції печінки. Це є причиною гіпопротеїнемії, що, у свою чергу, обумовлює розвиток онкотичних набряків. II. Енергетична недостатність є причиною зменшення основного обміну. Це виявляється зниженням температури тіла (гіпотермією). III. Атрофічні синдроми. їх розвиток пов'язаний з порушеннями пластичного й енергетичного забезпечення клітин. 76.Гіпоксія: визначення поняття, класифікація, етіологія, патогенез. Патологічні зміни та пристосувально-компенсаторні реакції при гіпоксії. Гіпоксія (кисневе голодування) — це типовий патологічний процес, що виникає внаслідок недостатнього постачання тканин киснем або в результаті порушення його використання клітинами.' 19.2. Як класифікують кисневе голодування? I. Етіологічна класифікація: а) гіпоксична (екзогенна); б) дихальна (респіраторна); в) серцево-судинна (циркуляторна); г) кров'яна (гемічна); ґ) тканинна (гістотоксична) гіпоксія. II. За темпами розвитку і тривалістю виділяють: а) блискавичну; б) гостру; в) підгостру; г) хронічну гіпоксію Ні. Залежно від поширеності процесу гіпоксія може бути загальною і місцевою.
Назвіть причини зменшення доставки кисню кров'ю.
де С. — вміст кисню в артеріальній крові; Q — об'ємна швидкість течії крові. Причинами порушення доставки кисню кров'ю можуть бути: а) зменшення вмісту кисню в артеріальній крові; б) зменшення об'ємної швидкості течії крові в тканині (порушення кровопостачання); в) зменшення віддачі кисню гемоглобіном (зменшення дисоціації оксигемоглобіну). 19.6. Чим може бути обумовлене зменшення вмісту кисню в артеріальній крові?
де - Ск - вміст кисню в артеріальній крові; [НЬ] - концентрація гемоглобіну в крові; S — насичення гемоглобіну киснем; 1,34 - число Хюфнера. Причиною зменшення вмісту кисню в артеріальній крові можуть бути: а) зменшення концентрації гемоглобіну, здатного зв'язувати кисень (зменшення кисневої ємності крові). Це може бути обумовлено або анемією (зменшується загальний вміст гемоглобіну), або інактивацією гемоглобіну; б) зменшення насичення гемоглобіну киснем. Закономірно виникає при зменшенні напруги кисню в артеріальній крові нижче 60 мм рт. ст. 19.7. Які зміни можуть зменшувати об'ємну швидкість течії крові в тканинах і призводити до гіпоксії? Оскільки
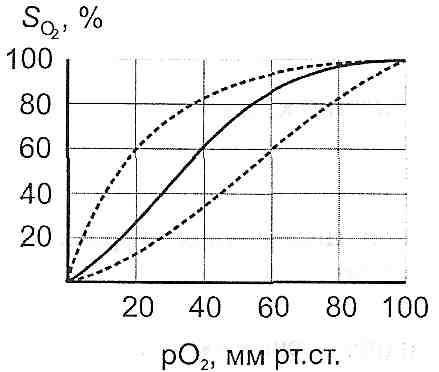
де Q — об'ємна швидкість течії крові; Ра — артеріальний тиск на початку, а Рвсн — венозний тиск наприкінці перфузованої ділянки; (Р т — Р) перфузійний тиск; R — гемодинамічний опір, то зменшення кровопостачання тканин може бути обумовлене такими групами причин. І. Зменшення перфузійного тиску в судинах органа або тканини: а) зменшення артеріального тиску; б) збільшення венозного тиску. IJ. Збільшення гемодинамічного опору судин даної ділянки: а) звуження судин; б) підвищення в'язкості крові. 19.8. Які фактори викликають зміщення кривої дисоціації оксигемоглобіну? Крива дисоціації оксигемоглобіну відображує залежність між напругою кисню в артеріальній крові і насиченням гемоглобіну киснем (рис. 61).
Рис. 61. Крива дисоціації оксигемоглобіну Зміщення цієї кривої вліво відбувається при: а) зниженні температури; б) алкалозі; в) гіпокапнії; г) зменшенні в еритроцитах вмісту 2,3-дифос- -фогліцерату; ґ) отруєннях оксидом вуглецю (II); д) появі спадково обумовлених патологічних форм гемоглобіну, які не віддають кисень тканинам. При зміщенні кривої вліво гемоглобін легше приєднує кисень у капілярах легень, але гірше віддає його тканинам. Причиною зміщення кривої дисоціації оксигемоглобіну вправо можуть бути: а) підвищення температури; б) ацидоз; в) гіперкапнія; г) збільшення вмісту в еритроцитах 2,3-дифосфогліцерату. Вплив ацидозу і гіперкапнії на дисоціацію оксигемоглобіну відомий як ефект Бора. При зміщенні кривої вправо гемоглобін гірше приєднує кисень у капілярах легень, але краще віддає його тканинам. З цим, зокрема, пов'язане захисно-компенсаторне значення ефекту Бора при кисневому голодуванні. 19.9. Які фактори зумовлюють порушення дифузії кисню в тканинах? Відповідно до закону Фіка
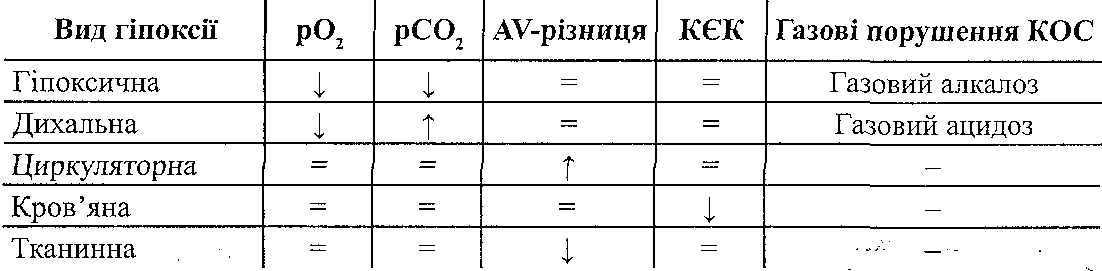
де m — кількість газу, що дифундує (дифузійний потік); k — коефіцієнт дифузії; S - загальна площа поверхні, через яку здійснюється дифузія; 1 - відстань дифузії; (Pj —Р2) — різниця між напругою О, у капілярах і клітинах. Звідси випливає, що причинами порушення дифузії кисню в тканинах можуть бути: 1) зменшення коефіцієнта дифузії кисню (наприклад, при відкладеннях у тканині ліпідів, гіаліну, амілоїду, солей кальцію); 2) зменшення загальної площі поверхні кровоносних капілярів при зменшенні їхньої кількості; 3) збільшення дифузійної відстані (наприклад, при набряку); 4) зменшення напруги кисню в капілярах; 5) збільшення напруги кисню в клітинах. 19.10. Що таке гіпоксія навантаження? Гіпоксія навантаження — це кисневе голодування, що виникає при збільшенні функціонального навантаження. Воно пов'язане з посиленим використанням кисню клітинами. При цьому доставка кисню тканинам може навіть зростати. Якщо все-таки доставка кисню не покриває його посиленого використання клітинами, напруга кисню в тканинах падає й розвивається гіпоксія. 19.11. Що таке гіпоксична гіпоксія? Коли вона виникає? Тіпоксичною (екзогенною) називають гіпоксію, причиною якої є зменшення парціального тиску кисню у вдихуваному повітрі. Гіпоксична гіпоксія може наставати при: а) зниженні атмосферного тиску (при підніманні на висоту в гори); 6) зменшенні вмісту кисню у вдихуваному повітрі (робота в шахтах, несправність систем кисневого забезпечення в літальних апаратах, на підводних човнах, у скафандрах). 19.12. Назвіть патогенетичні фактори розвитку гірської хвороби. Гірська хвороба виникає при підніманні неадаптованого організму в гори. Вона являє приклад підгострої і хронічної гіпоксії. Провідне значення в патогенезі гірської хвороби має зменшення парціального тиску кисню у вдихуваному повітрі (гіпоксична гіпоксія). Крім того, при підніманні в гори патогенну дію чинять й інші фактори, зокрема, зменшення власне атмосферного тиску (синдром декомпресії), сонячна радіація, зниження температури зовнішнього середовища, сухість вдихуваного повітря, збільшення фізичного навантаження. 19.13. Які зони виділяють при підніманні в гори з урахуванням ознак гіпоксії, що розвивається? I. Нейтральна зона (висота від 0 до 2000 м над рівнем моря). Функції організму не страждають. II. Зона повної компенсації (висота від 2000 до 4000 м над рівнем моря). Відзначається збільшення частоти пульсу, дихання, підвищення артеріального тиску. У той же час зменшується фізична й розумова працездатність, розвивається ейфорія, порушується тонка координація рухів, послаблюється увага. III. Зона неповної компенсації (висота від 4000 до 6000 м над рівнем моря). Розвиваються важкі, але оборотні зміни. Тахікардія змінюється брадикардією, падає артеріальний тиск, дихання стає частим і поверхневим, іноді розвивається дихання Чейна-Стокса, характерні сонливість, млявість, нудота. IV. Критична зона (понад 7000 м над рівнем моря). Розвиваються необоротні зміни. Артеріальний тиск падає до 0, пульс стає ниткоподібним, з'являється термінальне дихання, людина непритомніє, розвиваються судоми й настає смерть. 19.14. Що таке висотна хвороба? Висотна хвороба - це гостра або блискавична форма гіпоксичної гіпоксії, що виникає під час висотних польотів у літальних апаратах з кабінами відкритого типу або при порушенні герметичності кабін закритого типу. 19.15. Які зміни показників газового стану крові характерні для гіпоксичної гіпоксії? Зменшення р02 і рС02 артеріальної крові, розвиток газового алкалозу. 19.16. Що таке дихальна гіпоксія? Дихальна гіпоксія - це кисневе голодування, причиною якого є недостатність зовнішнього дихання. Причини її розвитку див. розд. 29. 19.17. Які зміни показників газового стану крові характерні для дихальної гіпоксії? Зменшення р02 і збільшення рС02 артеріальної крові, розвиток газового ацидозу.: 19.18. Що таке циркуляторна гіпоксія? Циркуляторна гіпоксія — це кисневе голодування, причиною якого є розлади загальної гемодинаміки або порушення місцевого кровообігу. В основі порушень системного кровообігу можуть лежати недостатність серця й недостатність судин (шок, колапс). До місцевої гіпоксії призводять ішемія, тромбоз, емболія, венозна гіперемія. Залежно від механізмів розвитку деякі автори виділяють дві форми циркулятор-ної гіпоксії: ішемічну і застійну. 19.19. Які зміни показників газового стану крові характерні для циркуляторної гіпоксії? Збільшення артеріовенозної різниці за киснем за рахунок повнішого вилучення його з артеріальної крові. 19.20. Що таке кров'яна (гемічна) гіпоксія? Назвіть її види. Кров 'яна (гемічна) гіпоксія — це кисневе голодування, що виникає внаслідок зменшення кисневої ємності крові. Виділяють дві форми кров'яної гіпоксії: а) анемічну — виникає як наслідок анемії (див. розд. 26); б) гіпоксію, пов'язану з інактивацією гемоглобіну. 19.21. Назвіть форми інактивованого гемоглобіну. 1. Карбоксигемоглобін - продукт взаємодії гемоглобіну з оксидом вуглецю (II) (чадним газом, CO). 2. Метгемоглобін — гемоглобін, у якому залізо перебуває в окисненому, тривалентному стані. 3. Сульфгемоглобін — сполука гемоглобіну із сірководнем. 19.22. Які механізми обумовлюють розвиток порушень в організмі при отруєнні оксидом вуглецю (II)? У патогенезі порушень, спричинюваних оксидом вуглецю (II), мають значення такі фактори: |< -*• а) інактивація гемоглобіну, що зменшує кисневу ємність крові, — розвивається кров 'яна гіпоксія; б) зміщення кривої дисоціації оксигемоглобіну вліво - навіть той гемоглобін, що не зазнав інактивації, погано віддає кисень тканинам; в) зв'язування оксиду вуглецю (II) із залізом інших білків, що містять у собі гем, зокрема цитохромів — розвивається тканинна гіпоксія. 19.23. Які фактори можуть бути причиною утворення метгемоглобіну, а отже й розвитку кров'яної гіпоксії? Причини утворення метгемоглобіну: 1) екзогенніречовши-окислювачі (метгемоглобіноутворювачі). До них відносять: а) нітросполуки (оксид азоту (II), нітрити, нітрати); б) аміносполуки (анілін, фенілгідразин); в) окислювачі (хлорати, перманганати, хінони); г) окисно-відновні барвники (метиленовий синій у високих концентраціях); ґ) лікарські препарати (нітрогліцерин, амілнітрит, сульфаніламіди, барбітурати); 2) недостатність антиоксидантних систем еритроцитів, що відновлюють метгемоглобін. Це спостерігається при порушеннях пентозного циклу і глютатіон-редуктази. Описано генетично обумовлений дефект ферменту - НАДФ-залежної метгемоглобінредуктази. 19.24. Які зміни показників газового стану крові характерні для кров 'яної гіпоксії? Зменшення кисневої ємності крові 77.Етіологія і патогенез тканинної гіпоксії. Принципи терапії гіпоксії. Можливі негативні наслідки кисневої терапії. 19.25. Що таке тканинна гіпоксія? Тканинна гіпоксія — це кисневе голодування, що виникає в результаті порушення утилізації кисню клітинами. В її основі лежать два типи порушень: а) пригнічення біологічного окиснення; б) роз'єднання окиснення й фосфорування (див. розд. 17). 19.26. Які зміни показників газового стану крові характерні для тканинної гіпоксії? Зменшення артеріовенозної різниці за киснем і збільшення рО, венозної крові. 19.27. Дайте порівняльну характеристику основних показників газового стану крові при різних видах гіпоксії.
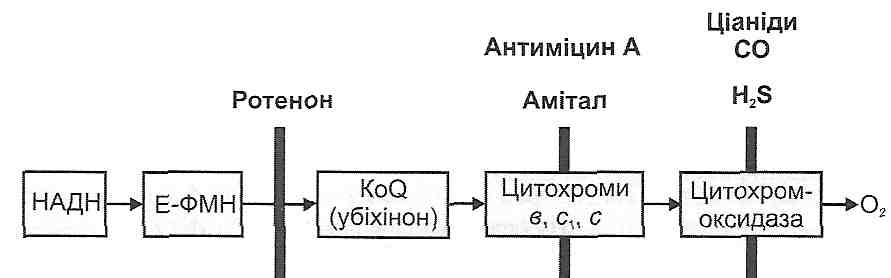
р02 — напруга кисню в артеріальній крові; рС02 — напруга вуглекислого газу в артеріальній крові; AV-різниця — артеріовенозна різниця за киснем; КЄК — киснева ємність крові; КОС — кислотно-основний стан. 19.28. На які групи можна поділити всі захисно-компенсаторні реакції, що виникають при гіпоксії? I. Реакції, спрямовані на збільшення доставки кисню кров 'ю. II. Місцеві (тканинні) реакції, спрямовані на поліпшення забезпечення клітин киснем. III. Реакції в системах утилізації кисню. 19.29. Назвіть захисно-компенсаторні реакції організму, спрямовані на збільшення доставки кисню тканинам. 1. Реакції зовнішнього дихання. Спрямовані на збільшення р02 артеріальної крові, тому можуть бути ефективними тільки при гіпоксичній і дихальній гіпоксії. Вони виявляють себе: а) збільшенням глибини дихання; б) збільшенням частоти дихання; в) мобілізацією резервних альвеол. Комплекс зазначених змін отримав назву гіпервенпгиляції. 2. Реакції системи кровообігу. Спрямовані на збільшення кровопостачання тканин і є ефективними при всіх видах гіпоксії, крім тканинної. До цих реакцій відносять: а) збільшення хвилинного об'єму крові за рахунок збільшення сили й частоти серцевих скорочень; б) підвищення артеріального тиску; в) перерозподіл течії крові - зменшення кровообігу в шкірі, скелетних м'язах, органах черевної порожнини і збільшення — у серці й головному мозку. 3. Реакції системи крові. Спрямовані на збільшення кисневої ємності крові і виявляють себе збільшенням кількості еритроцитів та концентрації гемоглобіну в периферичній крові. Це досягається за рахунок: а) виходу додаткової кількості еритроцитів з депо; б) активації еритропоезу (при гіпоксії посилюється утворення ниркових ери-тропоетинів). Крім того, захисне значення має зміщення кривої дисоціації оксигемоглобіну вправо — ефект Бора (див. запит. 19.8). 19.31. Назвіть місцеві (тканинні) реакції, спрямовані на поліпшення забезпечення клітин киснем в умовах гіпоксії. 1. Посилення місцевого кровообігу — артеріальна гіперемія. Розвивається як наслідок безпосереднього впливу зменшення р02 на гладкі м'язи судин і дії на судини вазо-активних метаболітів (аденозину, молочної кислоти, іонів калію й водню та ін.) 2. Збільшення кількості капілярів, що функціонують. У результаті зменшується відстань дифузії кисню і збільшується загальна площа дифузійної поверхні. 3. Підвищення вмісту в клітинах міоглобіну, який у м'язах є внутрішньоклітинним депо кисню. 19.32. Назвіть захисно-компенсаторні реакції в системах утилізації кисню при гіпоксії. 1. Зниження функціональної активності клітин, унаслідок чого зменшується їхня потреба в кисні. 2. Збільшення кількості дихальних ферментів і мітохондрій у клітинах. 3. Збільшення спорідненості цитохромоксидази з киснем. 4. Підвищення ступеня спряженості окиснення й фосфорування до максимально можливої величини, що дорівнює 3. 5. Активація гліколізу 78. Порушення енергетичного обміну: етіологія, патогенез, наслідки. Поняття про енергетичні потреби організму, позитивний та негативний енергетичний баланс. Зміни основного обміну при патології. 17.1. Що таке позаклітинні і внутрішньоклітинні порушення енергетичного обміну? Залежно від причин розвитку розрізняють поза- і внутрішньоклітинні розлади енергетичного обміну. Позаклітинними називають розлади енергетичного обміну, пов'язані з первинними порушеннями забезпечення клітин поживними речовинами і киснем. Це голодування і більшість видів гіпоксії. При внутрішньоклітинних розладах енергетичного обміну доставка поживних речовин і кисню не страждає, а порушується їх використання клітинами. 1 7.2. Назвіть основні причини порушення постачання клітин поживними речовинами. 1. Повна відсутність їжі або дефіцит поживних речовин у ній. 2. Порушення процесів травлення і всмоктування. 3. Порушення мобілізації поживних речовин з депо (наприклад, ураження печінки, розлади нервово-гуморальної регуляції жирового обміну). 4. Порушення транспорту поживних речовин кров'ю (загальні й місцеві розлади кровообігу). 5. Порушення дифузії поживних речовин у тканинах. 6. Втрата поживних речовин або їх використання не за призначенням (протеїнурія, глюкозурія, опікова хвороба, злоякісні пухлини). 17.3. Які порушення хімічного складу крові свідчать про порушення постачання клітин поживними речовинами? 1. Гіпоглікемія - зменшення концентрації глюкози в крові. 2. Гіполіпацидемія й гіполіпопротеїнемія — зменшення вмісту в крові вільних жирових кислот і ліпопротеїнів. 3. Гіпопротеїнемія й гіпоаміноацидемія - зменшення вмісту білків і вільних амінокислот у крові. 17.4. Назвіть причини внутрішньоклітинних порушень енергетичного обміну. 1. Порушення транспорту поживних речовин через клітинну мембрану (наприклад, глюкози при цукровому діабеті). 2. Порушення центральних внутрішньоклітинних катаболічних шляхів. 3. Розлади процесів біологічного окиснення в мітохондріях. 4. Роз'єднання процесів окиснення й фосфорування. 5. Порушення транспорту АТФ із мітохондрій до місць використання. 6. Порушення використання енергії АТФ. 17.5. Порушення яких центральних внутрішньоклітинних катаболічних шляхів можуть призводити до розладів енергозабезпечення клітин? 1. Пригнічення гліколізу. 2. Порушення циклу Кребса. 3. Розлади пентозного циклу. 4. Пригнічення окиснення жирових кислот. 5. Пригнічення процесів дезамінування і окиснення амінокислот. 17.6. Назвіть основні причини порушень центральних катаболічних шляхів у клітинах. I. Зменшення вмісту вітамінів і вітаміноподібних речовин у клітинах (вітамінна недостатність). II. Набуте зменшення активності ферментів: а) зменшення активності окремих молекул ферментів (дія метаболічних отрут); б) зменшення кількості молекул ферментів (розлади білоксинтетичної функції клітин). III. Спадково обумовлені ензимопатії. Описано численні генетичні дефекти ферментів гліколізу, пентозного циклу, катаболічних перетворень амінокислот. Нині не відомі які-небудь ензимопатії, безпосередньо пов'язані з циклом Кребса й (3-окис-ненням жирових кислот. IV. Дефіцит АТФ. АТФ використовується клітиною для активації субстратів, які надходять у центральні катаболічні шляхи (наприклад, фосфорування глюкози й фрук-тозо-6-фосфату, активація жирових кислот). Дефіцит АТФ створює "зачароване коло" — він порушує катаболічні перетворення поживних речовин, що веде до порушення ресинтезу АТФ. Це, у свою чергу, збільшує дефіцит макроергічних сполук. 17.7. Які причини можуть викликати розвиток вітамінної недостатності у клітинах? Розвиток вітамінної недостатності в клітинах викликають: а) гіпо- і авітамінози; б) порушення транспорту вітамінів у клітину; в) порушення перетворення вітамінів у коферменти; г) порушення утворення холоферментів — комплексів коферментів з апоферментами. 17.8. Назвіть основні причини порушення біологічного окиснення в мітохондріях клітин. 1. Дефіцит коферментів: НАД, ФМН, убіхінону. 2. Дефіцит мікроелементів: Fe (входить до складу залізо-сірчаних центрів НАДН-дегі-дрогеназного комплексу і цитохромів) і Си (входить до складу цитохромоксидази). 3. Блокада транспорту електронів по дихальному ланцюгу (дія отрут— ротенону, антиміцину А, аміталу, ціанідів, оксиду вуглецю (II), сірководню; рис. 58).
Рис. 58. Блокада транспорту електронів по дихальному ланцюгу 4. Порушення акцепторного контролю дихання (АДФ не контролює швидкість транспорту електронів по дихальному ланцюгу). 17.9. Що таке роз 'єднання окиснення й фосфорування? Які його механізми? Роз'єднання окиснення й фосфорування — це стан, при якому енергія, що вивільняється в процесі транспорту електронів по дихальному ланцюгу, не здатна акумулюватися в макроергічних зв'язках АТФ і тому виділяється у вигляді теплоти. Для цього стану характерне зменшення ресинтезу АТФ і збільшення споживання кисню клітинами. В основі роз'єднання окиснення й фосфорування можуть лежати такі механізми: а) зменшення градієнта концентрацій іонів водню між матриксом мітохондрій і цитоплазмою; б) зменшення трансмембранного електричного потенціалу на внутрішній мітохон-дріальній мембрані; в) порушення АТФ-синтетазного ферментного комплексу; г) використання енергії градієнта концентрацій іонів водню не на синтез АТФ, а на інші цілі (транспорт іонів кальцію із цитоплазми в мітохондрії, транспорт фосфату, АДФ, АТФ та ін.). 17.10. При порушенні яких біохімічних реакцій зменшується ресинтез АТФ у клітинах? Утворення АТФ у клітинах зменшується за умов пригнічення: а) гліколітичного (субстратного) фосфорування:
б) окисного фосфорування в мітохондріях:
в) креатинкіназної реакції:
г) аденілаткіназної реакції:
ґ) нуклеозиддифосфокіназної реакції:
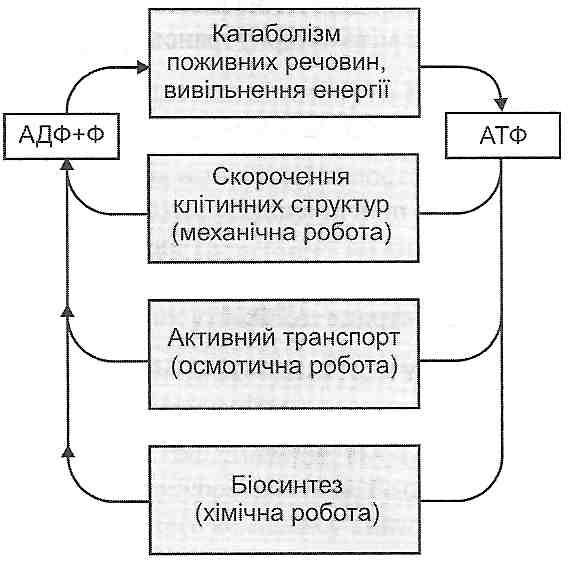
17.11. Які наслідки для клітини має дефіцит АТФ? Дефіцит АТФ у клітині призводить до: 1. Порушення механічної роботи - скорочення контрактильних структур клітин. Це виявляє себе розладами елементарних клітинних функцій: скорочення, міграції, екзо- і ендоцитозу, клітинного поділу, руху війок, джгутиків (рис. 59). 2. Порушення осмотичної роботи — процесів активного транспорту іонів. При дефіциті АТФ страждають механізми як первинного, так і вторинного активного транспорту: натрій-калієвий і кальцієвий насоси, натрій-кальцієвий і натрій-водневий обмінні механізми. Це викликає порушення внутрішньоклітинного гомеостазу й ушкодження клітин. 3. Порушення хімічної роботи — біосинтезу речовин. Наслідком цього є порушення самовідновлення й самовідтворення клітин, механізмів їх довгострокової адаптації до дії факторів навколишнього середовища. В остаточному підсумку відбувається повільна загибель клітин. 4. Порушення реакцій клітинного метаболізму.
Рис. 59. Шляхи використання АТФ у клітинах 17.12. Які порушення метаболізму в клітинах можуть бути пов'язані з первинним дефіцитом АТФ? В умовах дефіциту АТФ порушуються не тільки реакції біосинтезу речовин (анаболізм), але й реакції їх розщеплення (катаболізм). Це пов'язано з тим, що при дефіциті АТФ безпосередньо порушуються: а) активація субстратів (фосфорування) і залучення їх у катаболічні шляхи (гліколіз, Р-окиснення); б) активація багатьох ферментів, здійснювана протешкіназами; в) утворення циклічного АМФ. 17.13. Наведіть приклади "зачарованих кіл" у розвитку енергодефіцитного стану клітин. Зменшення вмісту АТФ у клітині призводить до пригнічення функції Са-насосів, внаслідок чого збільшується концентрація іонів кальцію в цитоплазмі. Це викликає роз'єднання окиснення й фосфорування - у результаті дефіцит АТФ зростає (див. розд. 11). Дата добавления: 2016-03-26 | Просмотры: 483 | Нарушение авторских прав |