|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология
|
ЛИЗОЦИМ
Лизоцим представляет собой термостабильный белок типа муколитического фермента. Он содержится в тканевых жидкостях животных и растений, у человека - в слезах, слюне, перитонеальной жидкости, плазме и сыворотке крови, в лейкоцитах, материнском молоке и др.
Лизоцим продуцируется моноцитами крови и тканевыми макрофагами. Он вызывает лизис многих сапрофитных бактерий, оказывая менее выраженное литическое действие на ряд патогенных микроорганизмов и неактивен в отношении вирусов.
Механизм бактериолитического действия лизоцима состоит в гидролизе связей между N-ацетилмурамовой кислотой и N-ацетилглюкозамином в полисахаридных цепях пептидогликанового слоя клеточной стенки бактерии. Это приводит к изменению ее проницаемости, сопровождающемуся диффузией клеточного содержимого в окружающую среду, и гибели клеток.
Заживление ран в области слизистых оболочек, имеющих контакт с большим количеством различных микроорганизмов, в том числе и патогенных, в известной степени объясняется наличием лизоцима.
НОРМАЛЬНАЯ МИКРОФЛОРА.
 Организм человека заселен (колонизирован) примерно 500 видами микроорганизмов, составляющими его нормальную микрофлору, в виде сообщества микроорганизмов (микробиоценоз). Они находятся в состоянии равновесия (эубиоза) друг с другом и организмом человека. Большинство этих микроорганизмов являются комменсалами, не причиняющими вреда человеку. Микрофлора колонизирует поверхность тела и полости, сообщающиеся с окружающей средой. В норме микроорганизмы отсутствуют в легких, матке и внутренних органах. Различают постоянную и транзиторную микрофлору. Постоянная (резидентная) микрофлора представлена микроорганизмами, постоянно присутствующими в организме. Транзиторная (непостоянная, или аллохтонная) микрофлора неспособна к длительному существованию в организме. Организм человека заселен (колонизирован) примерно 500 видами микроорганизмов, составляющими его нормальную микрофлору, в виде сообщества микроорганизмов (микробиоценоз). Они находятся в состоянии равновесия (эубиоза) друг с другом и организмом человека. Большинство этих микроорганизмов являются комменсалами, не причиняющими вреда человеку. Микрофлора колонизирует поверхность тела и полости, сообщающиеся с окружающей средой. В норме микроорганизмы отсутствуют в легких, матке и внутренних органах. Различают постоянную и транзиторную микрофлору. Постоянная (резидентная) микрофлора представлена микроорганизмами, постоянно присутствующими в организме. Транзиторная (непостоянная, или аллохтонная) микрофлора неспособна к длительному существованию в организме.
|
Постоянную микрофлору можно разделить на облигатную и факультативную.
Облигатная микрофлора (бифидобактерии, лактобактерии, пептострептококки, кишечные палочки и др.) является основой микробиоценоза, а факультативная микрофлора (стафилококки, стрептококки, клебсиеллы, клостридии, некоторые грибы и др.) включает меньшую часть микробиоценоза. Количество микроорганизмов у взрослого человека составляет около 1014 особей, причем преобладают в значительной степени облигатные анаэробы. Микроорганизмы, составляющие нормальную микрофлору, заключены в высокогидратированный экзополисахаридно-муциновый матрикс, образуя биологическую пленку, устойчивую к различным воздействиям.  Микрофлора кожи.На коже в ее более глубоких слоях (волосяных мешочках, протоках сальных и потовых желез) анаэробов в 2-10 раз больше, чем аэробов. Кожу колонизируют грамположительные бактерии (пропионибактерии, коринеформные бактерии, эпидермальные стафилококки и другие коагулазоотрицательные стафилококки*, микрококки, пептострептококки, стрептококки, Dermabacter hominis), дрожжеподобные грибы рода Malassezia, реже встречается транзиторная микрофлора (Staphylococcus aureus, Streptococcus pyogenes и др.). При ослаблении организма на коже возрастает количество грамотрицательных бактерий. В норме на 1 см2 кожи приходится менее 80 000 микроорганизмов и это количество не увеличивается в результате действия бактерицидных стерилизующих факторов. Например, в поте кожи обнаружены - иммуноглобулины классов А и G, трансферин, лизоцим, органические кислоты и другие противомикробные вещества. Низкий уровень рН (5,5), низкая температура кожи также ограничивают размножение микроорганизмов. Более увлажненные участки кожи колонизируются наибольшим количеством микроорганизмов (106 на 1 см2), например, в паховых складках, межпальцевых пространствах, подмышечных впадинах. Усиленный рост микроорганизмов происходит при загрязнении кожи; при ослаблении организма размножающиеся там микроорганизмы определяют запах тела. Микрофлора кожи имеет большое значение в распространении микроорганизмов в воздухе. В результате десквамации (шелушения) кожи несколько миллионов чешуек, несущих каждая несколько микроорганизмов, загрязняют окружающую среду. __________________________________________________________________________ * _Staphylococcus hominis, Staphylococcus haemolyticus, Staphylococcus warneri, Staphylococcus capitis (на лбу, лице), Staphylococcus saprophyticus, Staphylococcus caprae, Staphylococcus saccharolyticus, Staphylococcus pasteuri, Staphylococcus lugdunensis, Staphylococcus simulans, Staphylococcus xylosis. Staphylococcus auricularis колонизирует внешний слуховой канал. __________________________________________________________________________ Микрофлора кожи.На коже в ее более глубоких слоях (волосяных мешочках, протоках сальных и потовых желез) анаэробов в 2-10 раз больше, чем аэробов. Кожу колонизируют грамположительные бактерии (пропионибактерии, коринеформные бактерии, эпидермальные стафилококки и другие коагулазоотрицательные стафилококки*, микрококки, пептострептококки, стрептококки, Dermabacter hominis), дрожжеподобные грибы рода Malassezia, реже встречается транзиторная микрофлора (Staphylococcus aureus, Streptococcus pyogenes и др.). При ослаблении организма на коже возрастает количество грамотрицательных бактерий. В норме на 1 см2 кожи приходится менее 80 000 микроорганизмов и это количество не увеличивается в результате действия бактерицидных стерилизующих факторов. Например, в поте кожи обнаружены - иммуноглобулины классов А и G, трансферин, лизоцим, органические кислоты и другие противомикробные вещества. Низкий уровень рН (5,5), низкая температура кожи также ограничивают размножение микроорганизмов. Более увлажненные участки кожи колонизируются наибольшим количеством микроорганизмов (106 на 1 см2), например, в паховых складках, межпальцевых пространствах, подмышечных впадинах. Усиленный рост микроорганизмов происходит при загрязнении кожи; при ослаблении организма размножающиеся там микроорганизмы определяют запах тела. Микрофлора кожи имеет большое значение в распространении микроорганизмов в воздухе. В результате десквамации (шелушения) кожи несколько миллионов чешуек, несущих каждая несколько микроорганизмов, загрязняют окружающую среду. __________________________________________________________________________ * _Staphylococcus hominis, Staphylococcus haemolyticus, Staphylococcus warneri, Staphylococcus capitis (на лбу, лице), Staphylococcus saprophyticus, Staphylococcus caprae, Staphylococcus saccharolyticus, Staphylococcus pasteuri, Staphylococcus lugdunensis, Staphylococcus simulans, Staphylococcus xylosis. Staphylococcus auricularis колонизирует внешний слуховой канал. __________________________________________________________________________  Микрофлора конъюнктивы.На конъюнктиве глаза имеется небольшое количество коринеформных бактерий и стафилококков. Незначительное количество микробов на коньюнктиве обусловлено действием лизоцима и других бактерицидных факторов слезной жидкости. Микрофлора конъюнктивы.На конъюнктиве глаза имеется небольшое количество коринеформных бактерий и стафилококков. Незначительное количество микробов на коньюнктиве обусловлено действием лизоцима и других бактерицидных факторов слезной жидкости.  Микрофлора верхних дыхательных путей.В верхние дыхательные пути попадают пылевые частицы, нагруженные микроорганизмами, большая часть которых задерживается и погибает в носо- и ротоглотке. Здесь растут бактероиды, коринеформные бактерии, гемофильные палочки, лактобактерии, стафилококки, стрептококки, нейссерии, пептококки, пептострептококки и др. Трахея, бронхи и альвеолы обычно стерильны. Микрофлора верхних дыхательных путей.В верхние дыхательные пути попадают пылевые частицы, нагруженные микроорганизмами, большая часть которых задерживается и погибает в носо- и ротоглотке. Здесь растут бактероиды, коринеформные бактерии, гемофильные палочки, лактобактерии, стафилококки, стрептококки, нейссерии, пептококки, пептострептококки и др. Трахея, бронхи и альвеолы обычно стерильны.  Микрофлора желудочно-кишечного тракта.Микрофлора пищеварительного трактанаиболее представительна по своему качественному и количественному составу. Микроорганизмы свободно обитают в полости пищеварительного тракта, а также колонизируют слизистые оболочки в виде биологической пленки. Рот.В полости рта обитают многочисленные микроорганизмы. В 1 мл слюны обитает до 108 бактерий. Этому способствуют остатки пищи во рту, благоприятная температура (370) и щелочная реакция среды. Анаэробов больше, чем аэробов, в 100 и более раз. Здесь обитают разнообразные бактерии: бактероиды, превотеллы, порфиромонады, бифидобактерии, эубактерии, фузобактерии, лактобактерии, актиномицеты, гемофильные палочки, лептотрихии, нейссерии, спирохеты, стрептококки, стафилококки, пептококки, пептострептококки, вейлонеллы и др. Обнаруживаются также грибы рода Candida и простейшие (Entamaeba gingivalis, Trichomonas tenax). Бактерии имеют определенное топографическое распространение. Так, различные виды стрептококков располагаются неодинаково: на эпителии щек – S. mitior, на сосочках языка, в слюне – S. salivarius, на зубах –, S. mutans. Актиномицеты присутствут в больших количествах на языке, десневых карманах, зубной бляшке и в слюне. Ассоцианты нормальной микрофлоры и продукты их жизнедеятельности образуют зубной налет. Состав микрофлоры рта регулируется механическим действием слюны и языка; микроорганизмы смываются слюной со слизистой оболочки и зубов (человек проглатывает в день около литра слюны). Антимикробные компоненты слюны, особенно лизоцим, антитела (секреторный IgA), подавляют адгезию посторонних микробов к эпителиоцитам. С другой стороны бактерии образуют полисахариды: S. sanguis и S. mutans преобразовывают сахарозу во внеклеточный полисахарид (глюканы, декстраны), участвующие в адгезии к поверхности зубов. Колонизации постоянной частью микрофлоры способствует фибронектин, покрывающий эпителиоциты слизистых оболочек. Он обладает сродством к грамположительным бактериям. При низком уровне фибронектина грамположительные бактерии замещаются на грамотрицательные. Пищевод практически не содержит микроорганизмы. Желудок. Микрофлора желудка представлена лактобациллами и дрожжами, единичными кокками и грамотрицательными бактериями. Концентрация бактерий меньше, чем 103 бактерий на 1мл. Она несколько беднее, чем, например, микрофлора кишечника, так как желудочный сок имеет низкое значение рН, неблагоприятное для жизни многих микроорганизмов. Желудок в норме это своеобразная стерилизационная камера (соляная кислота, пепсиноген – предшественник пепсина и др.), подавляющая патогенные микроорганизмы. При гастритах, язвенной болезни желудка обнаруживаются изогнутые формы бактерий, относящихся к роду Helicobacter, которые являются этиологическими факторами многих патологических процессов (гастрит, язвы, опухоли). Тонкая кишка.В тонкой кишке находится 105-108 микроорганизмов на 1 мл содержимого. Здесь обнаруживаются бифидобактерии, лактобактерии, клостридии, эубактерии, энтерококки, порфиромонады, превотеллы и анаэробные кокки. Толстая кишка.Наибольшее количество микроорганизмов накапливается в толстой кишке. В 1 г фекалий содержится до 1012 микробных клеток. Около 95% всех видов микроорганизмов составляют анаэробные бактерии. Основными представителями микрофлоры толстой кишки являются: грамположительные анаэробные палочки (бифидобактерии, лактобациллы, эубактерии); грамположительные спорообразующие анаэробные палочки (клостридии перфрингенс и др.); энтерококки; грамотрицательные анаэробные палочки (бактероиды); грамотрицательные факультативно-анаэробные палочки (кишечные палочки и сходные с ними бактерии сем. Enterobacteriaceae - цитробактер, энтеробактер, клебсиеллы, протей и др.); анаэробные грамположительные кокки (пептострептококки, пептококки, Gemella morbillorum). На эпителии успешно растут спирохеты. В меньших количествах обнаруживаются фузобактерии, порфиромонады, превотеллы, пропионибактерии, вейлонеллы, стафилококки, синегнойная палочка и дрожжеподобные грибы рода Candida (C. glabrata, С. albicans, C. tropicalis, C. parapsilosis, C. krusei). Количество простейших (Blastocystis hominis, Chilomastix mesnili, Endolimax nana, coli, hartmanni, Entamoeba polecki, Enteromonas hominis, Iodamoeba butschlii, Retortamonas intestinalis и Trichomonas hominis) колеблется в норме, в зависимости от диеты и действия факторов окружающей среды. Рост посторонней микрофлоры задерживается в результате антагонистических свойств нормальной микрофлоры и блокирующего действия секреторного IgA. Кроме этого у младенцев угнетающим действием обладает лактоферрин, поступающий с грудным молоком матери. Микрофлора желудочно-кишечного тракта.Микрофлора пищеварительного трактанаиболее представительна по своему качественному и количественному составу. Микроорганизмы свободно обитают в полости пищеварительного тракта, а также колонизируют слизистые оболочки в виде биологической пленки. Рот.В полости рта обитают многочисленные микроорганизмы. В 1 мл слюны обитает до 108 бактерий. Этому способствуют остатки пищи во рту, благоприятная температура (370) и щелочная реакция среды. Анаэробов больше, чем аэробов, в 100 и более раз. Здесь обитают разнообразные бактерии: бактероиды, превотеллы, порфиромонады, бифидобактерии, эубактерии, фузобактерии, лактобактерии, актиномицеты, гемофильные палочки, лептотрихии, нейссерии, спирохеты, стрептококки, стафилококки, пептококки, пептострептококки, вейлонеллы и др. Обнаруживаются также грибы рода Candida и простейшие (Entamaeba gingivalis, Trichomonas tenax). Бактерии имеют определенное топографическое распространение. Так, различные виды стрептококков располагаются неодинаково: на эпителии щек – S. mitior, на сосочках языка, в слюне – S. salivarius, на зубах –, S. mutans. Актиномицеты присутствут в больших количествах на языке, десневых карманах, зубной бляшке и в слюне. Ассоцианты нормальной микрофлоры и продукты их жизнедеятельности образуют зубной налет. Состав микрофлоры рта регулируется механическим действием слюны и языка; микроорганизмы смываются слюной со слизистой оболочки и зубов (человек проглатывает в день около литра слюны). Антимикробные компоненты слюны, особенно лизоцим, антитела (секреторный IgA), подавляют адгезию посторонних микробов к эпителиоцитам. С другой стороны бактерии образуют полисахариды: S. sanguis и S. mutans преобразовывают сахарозу во внеклеточный полисахарид (глюканы, декстраны), участвующие в адгезии к поверхности зубов. Колонизации постоянной частью микрофлоры способствует фибронектин, покрывающий эпителиоциты слизистых оболочек. Он обладает сродством к грамположительным бактериям. При низком уровне фибронектина грамположительные бактерии замещаются на грамотрицательные. Пищевод практически не содержит микроорганизмы. Желудок. Микрофлора желудка представлена лактобациллами и дрожжами, единичными кокками и грамотрицательными бактериями. Концентрация бактерий меньше, чем 103 бактерий на 1мл. Она несколько беднее, чем, например, микрофлора кишечника, так как желудочный сок имеет низкое значение рН, неблагоприятное для жизни многих микроорганизмов. Желудок в норме это своеобразная стерилизационная камера (соляная кислота, пепсиноген – предшественник пепсина и др.), подавляющая патогенные микроорганизмы. При гастритах, язвенной болезни желудка обнаруживаются изогнутые формы бактерий, относящихся к роду Helicobacter, которые являются этиологическими факторами многих патологических процессов (гастрит, язвы, опухоли). Тонкая кишка.В тонкой кишке находится 105-108 микроорганизмов на 1 мл содержимого. Здесь обнаруживаются бифидобактерии, лактобактерии, клостридии, эубактерии, энтерококки, порфиромонады, превотеллы и анаэробные кокки. Толстая кишка.Наибольшее количество микроорганизмов накапливается в толстой кишке. В 1 г фекалий содержится до 1012 микробных клеток. Около 95% всех видов микроорганизмов составляют анаэробные бактерии. Основными представителями микрофлоры толстой кишки являются: грамположительные анаэробные палочки (бифидобактерии, лактобациллы, эубактерии); грамположительные спорообразующие анаэробные палочки (клостридии перфрингенс и др.); энтерококки; грамотрицательные анаэробные палочки (бактероиды); грамотрицательные факультативно-анаэробные палочки (кишечные палочки и сходные с ними бактерии сем. Enterobacteriaceae - цитробактер, энтеробактер, клебсиеллы, протей и др.); анаэробные грамположительные кокки (пептострептококки, пептококки, Gemella morbillorum). На эпителии успешно растут спирохеты. В меньших количествах обнаруживаются фузобактерии, порфиромонады, превотеллы, пропионибактерии, вейлонеллы, стафилококки, синегнойная палочка и дрожжеподобные грибы рода Candida (C. glabrata, С. albicans, C. tropicalis, C. parapsilosis, C. krusei). Количество простейших (Blastocystis hominis, Chilomastix mesnili, Endolimax nana, coli, hartmanni, Entamoeba polecki, Enteromonas hominis, Iodamoeba butschlii, Retortamonas intestinalis и Trichomonas hominis) колеблется в норме, в зависимости от диеты и действия факторов окружающей среды. Рост посторонней микрофлоры задерживается в результате антагонистических свойств нормальной микрофлоры и блокирующего действия секреторного IgA. Кроме этого у младенцев угнетающим действием обладает лактоферрин, поступающий с грудным молоком матери.  Микрофлора мочеполового тракта. Почки, мочеточники, мочевой пузырь, матка, простата обычно стерильны. Микрофлора наружных гениталий представлена эпидермальными стафилококками, коринеформными бактериями, зеленящими стрептококками, сапрофитическими микобактериями (Myc. smegmatis), кандидами и энтеробактериями. На слизистой оболочке передней уретры обоих полов встречаются в норме стафилококки, непатогенные нейссерии, коринеформные бактерии, сапрофитные трепонемы и др. Микрофлора мочеполового тракта. Почки, мочеточники, мочевой пузырь, матка, простата обычно стерильны. Микрофлора наружных гениталий представлена эпидермальными стафилококками, коринеформными бактериями, зеленящими стрептококками, сапрофитическими микобактериями (Myc. smegmatis), кандидами и энтеробактериями. На слизистой оболочке передней уретры обоих полов встречаются в норме стафилококки, непатогенные нейссерии, коринеформные бактерии, сапрофитные трепонемы и др.  Микрофлора влагалища включает лактобактерии, бифидобактерии, бактероиды, пропионибактерии, порфириномонады, превотеллы, пептострептококки, коринеформные бактерии и др. Преобладают анаэробы: соотношение анаэробы/аэробы составляет 10/1. В репродуктивный период жизни преобладают грамположительные бактерии, а в период менопаузы она заменяется грамотрицательными бактериями. Примерно у 5-60% здоровых женщин выявляются Gardnerella vaginalis; у 15 – 30% - Mycoplasma hominis; у 5% - бактерии рода Mobiluncus. Состав микрофлоры зависит от многих факторов: менструального цикла, беременности, и др. В клетках влагалищного эпителия накапливается гликоген (способствуют эндогенные эстрогены), расщепляемый лактобактериями с образованием молочной кислоты. Образующиеся органические кислоты подкисляют среду до рН 4-4,6. Подкисление лактобактериями вагинального секрета, продукция ими перекиси водорода и бактериоцинов ведет к подавлению роста посторонней микрофлоры. Полость матки и мочевой пузырь в норме стерильны. Микрофлора влагалища включает лактобактерии, бифидобактерии, бактероиды, пропионибактерии, порфириномонады, превотеллы, пептострептококки, коринеформные бактерии и др. Преобладают анаэробы: соотношение анаэробы/аэробы составляет 10/1. В репродуктивный период жизни преобладают грамположительные бактерии, а в период менопаузы она заменяется грамотрицательными бактериями. Примерно у 5-60% здоровых женщин выявляются Gardnerella vaginalis; у 15 – 30% - Mycoplasma hominis; у 5% - бактерии рода Mobiluncus. Состав микрофлоры зависит от многих факторов: менструального цикла, беременности, и др. В клетках влагалищного эпителия накапливается гликоген (способствуют эндогенные эстрогены), расщепляемый лактобактериями с образованием молочной кислоты. Образующиеся органические кислоты подкисляют среду до рН 4-4,6. Подкисление лактобактериями вагинального секрета, продукция ими перекиси водорода и бактериоцинов ведет к подавлению роста посторонней микрофлоры. Полость матки и мочевой пузырь в норме стерильны.  Возрастные изменения в составе микрофлоры. Ребенок рождается стерильным,но проходя через родовые пути, захватывает сопутствующую микрофлору. Формирование микрофлоры осуществляется в результате контакта новорожденного с микроорганизмами окружающей среды и микрофлорой организма матери. Формирование микрофлоры новорожденных начинается с попадания микроорганизмов в процессе родов на кожу и слизистые оболочки. Дальнейшее формирование микрофлоры определяется санитарным состоянием среды, в которой проходили роды, типом вскармливания и др. Нормальная микрофлора становится устойчивой и к 1 - 3 месяцам жизни сходной с микрофлорой взрослого. Первоначально после рождения полость рта ребенка колонизируют аэробы, а после прорезывания зубов аэробы замещаются анаэробами. При грудном вскармливании основой микрофлоры являются бифидобактерии (109-1011 в 1 г. кала). При искусственном вскармливании у недоношенных и слабых детей нарушается размножение бифидобактерий, увеличивается количество транзиторной микрофлоры, грамотрицательных бактерий (энтеробактерий и др.), а также кокков. У таких детей часто развиваются кишечные болезни. В сформировавшемся микробиоценозе кишечника преобладают бифидобактерии и лактобактерии. Возрастные изменения в составе микрофлоры. Ребенок рождается стерильным,но проходя через родовые пути, захватывает сопутствующую микрофлору. Формирование микрофлоры осуществляется в результате контакта новорожденного с микроорганизмами окружающей среды и микрофлорой организма матери. Формирование микрофлоры новорожденных начинается с попадания микроорганизмов в процессе родов на кожу и слизистые оболочки. Дальнейшее формирование микрофлоры определяется санитарным состоянием среды, в которой проходили роды, типом вскармливания и др. Нормальная микрофлора становится устойчивой и к 1 - 3 месяцам жизни сходной с микрофлорой взрослого. Первоначально после рождения полость рта ребенка колонизируют аэробы, а после прорезывания зубов аэробы замещаются анаэробами. При грудном вскармливании основой микрофлоры являются бифидобактерии (109-1011 в 1 г. кала). При искусственном вскармливании у недоношенных и слабых детей нарушается размножение бифидобактерий, увеличивается количество транзиторной микрофлоры, грамотрицательных бактерий (энтеробактерий и др.), а также кокков. У таких детей часто развиваются кишечные болезни. В сформировавшемся микробиоценозе кишечника преобладают бифидобактерии и лактобактерии.  Значение микрофлоры организма человека.Нормальная микрофлора организма является своеобразным “экстракорпоральным органом”, играющим важную роль в жизнедеятельности человека. Значение и функции нормальной микрофлоры многообразны. Нормальная микрофлора является одним из факторов неспецифической резистентностиорганизма. Значение микрофлоры организма человека.Нормальная микрофлора организма является своеобразным “экстракорпоральным органом”, играющим важную роль в жизнедеятельности человека. Значение и функции нормальной микрофлоры многообразны. Нормальная микрофлора является одним из факторов неспецифической резистентностиорганизма.  Нормальная микрофлора обладает антагонистическими свойствами против патогенной и гнилостной микрофлоры, так как продуцирует молочную, уксусную кислоты, антибиотики, бактериоцины; конкурирует с посторонней микрофлорой за счет более высокого биологического потенциала. Нормальная микрофлора обладает антагонистическими свойствами против патогенной и гнилостной микрофлоры, так как продуцирует молочную, уксусную кислоты, антибиотики, бактериоцины; конкурирует с посторонней микрофлорой за счет более высокого биологического потенциала.  Нормальная микрофлора участвует в водно - солевом обмене, регуляции газового состава кишечника, обмене белков, углеводов, жирных кислот, холестерина, нуклеиновых кислот, а также в продукции биологически активных соединений: антибиотиков, витаминов (К, группы В и др.), токсинов и др. Нормальная микрофлора участвует в переваривании и детоксикации экзогенных субстратов и метаболитов, что сравнимо с функцией печени. Нормальная микрофлора участвует в водно - солевом обмене, регуляции газового состава кишечника, обмене белков, углеводов, жирных кислот, холестерина, нуклеиновых кислот, а также в продукции биологически активных соединений: антибиотиков, витаминов (К, группы В и др.), токсинов и др. Нормальная микрофлора участвует в переваривании и детоксикации экзогенных субстратов и метаболитов, что сравнимо с функцией печени.  Нормальная микрофлора участвует в рециркуляции стероидных гормонов и желчных солей в результате экскреции метаболитов из печени в кишечник и последующего возврата в нее. Нормальная микрофлора участвует в рециркуляции стероидных гормонов и желчных солей в результате экскреции метаболитов из печени в кишечник и последующего возврата в нее.  Нормальная микрофлора выполняет морфокинетическую роль в развитии различных органов и систем организма, участвует в физиологическом воспалении слизистой оболочки и смене эпителия. Нормальная микрофлора микрофлора выполняет антимутагенную функцию, разрушая концерогенные вещества в кишечнике. В то же время некоторые бактерии могут продуцировать сильные мутагены. Оказалось, что ферменты бактерий кишечника преобразовывают искусственный подсластитель цикломат в активный канцероген (циклогексамин) для мочевого пузыря. Нормальная микрофлора выполняет морфокинетическую роль в развитии различных органов и систем организма, участвует в физиологическом воспалении слизистой оболочки и смене эпителия. Нормальная микрофлора микрофлора выполняет антимутагенную функцию, разрушая концерогенные вещества в кишечнике. В то же время некоторые бактерии могут продуцировать сильные мутагены. Оказалось, что ферменты бактерий кишечника преобразовывают искусственный подсластитель цикломат в активный канцероген (циклогексамин) для мочевого пузыря.  Экзополисахариды (гликокаликс) микроорганизмов, входящие в состав биологической пленки, защищают микробные клетки от разнообразных физико-химических воздействий. Слизистая оболочка кишечника так же находится под защитой биологической пленки. Экзополисахариды (гликокаликс) микроорганизмов, входящие в состав биологической пленки, защищают микробные клетки от разнообразных физико-химических воздействий. Слизистая оболочка кишечника так же находится под защитой биологической пленки.  Значительное влияние оказывает микрофлора кишечника на формирование и поддержание иммунитета. В кишечнике находится примерно 1,5 кг микроорганизмов, антигены которых стимулируют иммунную систему. Естественным неспецифическим стимулятором иммуногенеза является мурамилдипептид, образующийся из пептидогликана бактерий под влиянием лизоцима и других литических ферментов, находящихся в кишечнике. В результате происходит обильное насыщение кишечной ткани лимфоцитами и макрофагами, тоесть в норме кишка находится как бы в состоянии хронического воспаления. Животные гнотобионты, выращиваемые в среде, свободной от микроорганизмов, отличаются, от обычных животных, слабо развитой лимфоидной тканью. Особенно отличается тонкая пластинка propria. Кишечная ткань слабо насыщена лимфоцитами и макрофагами в результате чего животные гнотобионты неустойчивы к инфекциям. Значительное влияние оказывает микрофлора кишечника на формирование и поддержание иммунитета. В кишечнике находится примерно 1,5 кг микроорганизмов, антигены которых стимулируют иммунную систему. Естественным неспецифическим стимулятором иммуногенеза является мурамилдипептид, образующийся из пептидогликана бактерий под влиянием лизоцима и других литических ферментов, находящихся в кишечнике. В результате происходит обильное насыщение кишечной ткани лимфоцитами и макрофагами, тоесть в норме кишка находится как бы в состоянии хронического воспаления. Животные гнотобионты, выращиваемые в среде, свободной от микроорганизмов, отличаются, от обычных животных, слабо развитой лимфоидной тканью. Особенно отличается тонкая пластинка propria. Кишечная ткань слабо насыщена лимфоцитами и макрофагами в результате чего животные гнотобионты неустойчивы к инфекциям.  Важнейшей функцией нормальной микрофлоры является ее участие в колонизационной резистентности. Колонизационная резистентность - это совокупность защитных факторов организма и конкурентных, антагонистических и других свойств нормальной микрофлоры (в основном анаэробов) кишечника, придающих стабильность микрофлоре и предотвращающих колонизацию слизистых оболочек посторонними микроорганизмами. При снижении колонизационной резистентности увеличивается количество и спектр аэробных условно-патогенных микробов. Их транслокация через слизистые оболочки может привести к развитию эндогенного гнойно-воспалительного процесса. Для предотвращения инфекционных осложнений, при понижении сопротивляемости организма и повышенном риске аутоинфекции (в случаях обширных травм, ожогов, иммунодепрессивной терапии, трансплантации органов и тканей и др.)целесообразно сохраненить или восстановить колонизационную резистентность с помощью селективной деконтаминации. С елективная деконтаминация этоизбирательное удаление из пищеварительного тракта аэробных бактерий и грибов для повышения сопротивляемости организма к инфекционным агентам. Селективную деконтаминацию проводят путем назначения для приема внутрь малоадсорбируемых химиопрепаратов, подавляющих аэробную часть микрофлоры и не влияющих на анаэробы, например комплексное назначение ванкомицина, гентамицина и нистатина. Важнейшей функцией нормальной микрофлоры является ее участие в колонизационной резистентности. Колонизационная резистентность - это совокупность защитных факторов организма и конкурентных, антагонистических и других свойств нормальной микрофлоры (в основном анаэробов) кишечника, придающих стабильность микрофлоре и предотвращающих колонизацию слизистых оболочек посторонними микроорганизмами. При снижении колонизационной резистентности увеличивается количество и спектр аэробных условно-патогенных микробов. Их транслокация через слизистые оболочки может привести к развитию эндогенного гнойно-воспалительного процесса. Для предотвращения инфекционных осложнений, при понижении сопротивляемости организма и повышенном риске аутоинфекции (в случаях обширных травм, ожогов, иммунодепрессивной терапии, трансплантации органов и тканей и др.)целесообразно сохраненить или восстановить колонизационную резистентность с помощью селективной деконтаминации. С елективная деконтаминация этоизбирательное удаление из пищеварительного тракта аэробных бактерий и грибов для повышения сопротивляемости организма к инфекционным агентам. Селективную деконтаминацию проводят путем назначения для приема внутрь малоадсорбируемых химиопрепаратов, подавляющих аэробную часть микрофлоры и не влияющих на анаэробы, например комплексное назначение ванкомицина, гентамицина и нистатина.  Представители нормальной микрофлоры при снижении сопротивляемости организма вызывают гнойно-воспалительные процессы, т.е. нормальная микрофлора может стать источником аутоинфекции, или эндогенной инфекции. Когда микробы - комменсалы оказываются при транслокации в непривычных местах обитания, они могут вызывать различные нарушения. Например, бактероиды, обитающие в норме в кишке, могут вызывать абсцессы, проникая в различные ткани в результате травмы или хирургической операции. Эпидермальный стафилококк в норме часто встречающийся на коже склонен колонизировать внутривенные катетеры, вызывая нарушения кровотока. Такие комменсалы кишки как кишечная палочка поражают мочевую систему (цистит и др.). Представители нормальной микрофлоры при снижении сопротивляемости организма вызывают гнойно-воспалительные процессы, т.е. нормальная микрофлора может стать источником аутоинфекции, или эндогенной инфекции. Когда микробы - комменсалы оказываются при транслокации в непривычных местах обитания, они могут вызывать различные нарушения. Например, бактероиды, обитающие в норме в кишке, могут вызывать абсцессы, проникая в различные ткани в результате травмы или хирургической операции. Эпидермальный стафилококк в норме часто встречающийся на коже склонен колонизировать внутривенные катетеры, вызывая нарушения кровотока. Такие комменсалы кишки как кишечная палочка поражают мочевую систему (цистит и др.).  В результате действия микробных декарбоксилаз и ЛПС высвобождается дополнительное количество гистамина, что может вызывать аллергические состояния. В результате действия микробных декарбоксилаз и ЛПС высвобождается дополнительное количество гистамина, что может вызывать аллергические состояния.  Нормальная микрофлора является хранилищем и источником хромосомных и плазмидных генов, в частности генов лекарственной устойчивости к антибиотикам. Нормальная микрофлора является хранилищем и источником хромосомных и плазмидных генов, в частности генов лекарственной устойчивости к антибиотикам.  Отдельных представителей нормальной микрофлоры используют в качестве санитарно-показательных микроорганизмов, свидетельствующих о загрязнении окружающей среды (воды, почвы, воздуха, продуктов питания и др.) выделениями человека и, следовательно, об их эпидемиологичекой опасности.
Дисбактериоз (диагностика, лечение).Состояние эубиоза - динамического равновесия нормальной микрофлоры и организма человека может нарушаться под влиянием факторов окружающей среды, стрессовых воздействий, широкого и бесконтрольного применения антимикробных препаратов, лучевой терапии и химиотерапии, нерационального питания, оперативных вмешательств и т.д. В результате нарушается колонизационная резистентность. Аномально размножившиеся транзиторные микроорганизмы продуцируют токсичные продукты метаболизма - индол, скатол, аммиак, сероводород. Состояния, развивающиеся в результате утраты нормальных функций микрофлоры, называются дисбактериозом и дисбиозом. При дисбактериозе происходят стойкие количественные и качественные изменения бактерий, входящих в состав нормальной микрофлоры. При дисбиозе изменения происходят и среди других групп микроорганизмов (вирусов, грибов и др.). Дисбиоз и дисбактериоз могут приводить к эндогенным инфекциями. Дисбиозы классифицируют по этиологии (грибковый, стафилококковый, протейный и др.) и по локализации (дисбиоз рта, кишки, влагалища и т.д.). Изменения в составе и функциях нормальной микрофлоры сопровождаются различными нарушениями: развитием инфекций, диарей, запоров, синдрома мальабсорбции, гастритов, колитов, язвенной болезни, злокачественных новообразований, аллергий, мочекаменной болезни, гипо - и гиперхолестеринемии, гипо- и гипертензия, кариеса, артрита, поражений печени и др. Отдельных представителей нормальной микрофлоры используют в качестве санитарно-показательных микроорганизмов, свидетельствующих о загрязнении окружающей среды (воды, почвы, воздуха, продуктов питания и др.) выделениями человека и, следовательно, об их эпидемиологичекой опасности.
Дисбактериоз (диагностика, лечение).Состояние эубиоза - динамического равновесия нормальной микрофлоры и организма человека может нарушаться под влиянием факторов окружающей среды, стрессовых воздействий, широкого и бесконтрольного применения антимикробных препаратов, лучевой терапии и химиотерапии, нерационального питания, оперативных вмешательств и т.д. В результате нарушается колонизационная резистентность. Аномально размножившиеся транзиторные микроорганизмы продуцируют токсичные продукты метаболизма - индол, скатол, аммиак, сероводород. Состояния, развивающиеся в результате утраты нормальных функций микрофлоры, называются дисбактериозом и дисбиозом. При дисбактериозе происходят стойкие количественные и качественные изменения бактерий, входящих в состав нормальной микрофлоры. При дисбиозе изменения происходят и среди других групп микроорганизмов (вирусов, грибов и др.). Дисбиоз и дисбактериоз могут приводить к эндогенным инфекциями. Дисбиозы классифицируют по этиологии (грибковый, стафилококковый, протейный и др.) и по локализации (дисбиоз рта, кишки, влагалища и т.д.). Изменения в составе и функциях нормальной микрофлоры сопровождаются различными нарушениями: развитием инфекций, диарей, запоров, синдрома мальабсорбции, гастритов, колитов, язвенной болезни, злокачественных новообразований, аллергий, мочекаменной болезни, гипо - и гиперхолестеринемии, гипо- и гипертензия, кариеса, артрита, поражений печени и др.  Нарушения нормальной микрофлоры человека определяется следующим образом: 1. Выявление видового и количественного состава представителей микробиоценоза определенного биотопа (кишки, рта, влагалища, кожи и т.д.) - путем высева из разведений исследуемого материала, или отпечатков, смыва на соответствующие питательные среды (среда Блаурокка для бифидобактерий, среда МРС-2 для лактобактерий, анаэробный кровяной агар для бактероидов, среда Левина или Эндо для энтеробактерий, желчно-кровяной агар для энтерококков, кровяной агар для стрептококков и гемофилов, мясопептонный агар с фурагином для синегнойной палочки, среду Сабуро для грибов и др.). 2. Определение в исследуемом материале микробных метаболитов - маркеров дисбиоза (жирных кислот, гидроксижирных кислот, жирнокислотных альдегидов, ферментов и др.). Например, обнаружение в фекалиях бета-аспартил-глицина и бета-аспартил-лизина свидетельствует о нарушении кишечного микробиоценоза, так как в норме эти дипептиды метаболизируются кишечной анаэробной микрофлорой
Для восстановления нормальной микрофлоры проводят: а) селективную деконтаминацию; б)назначают препараты пробиотиков* (эубиотиков), полученные из лиофильно высушенных живых бактерий - представителей нормальной микрофлоры кишечника - бифидобактерий (бифидумбактерин), кишечной палочки (колибактерин) лактобактерий (лактобактерин) и др. __________________________________________________________________________ * _Пробиотики – препараты, оказывающие при приеме per os нормализирующее действие на организм человека и его микрофлору. __________________________________________________________________________ Нарушения нормальной микрофлоры человека определяется следующим образом: 1. Выявление видового и количественного состава представителей микробиоценоза определенного биотопа (кишки, рта, влагалища, кожи и т.д.) - путем высева из разведений исследуемого материала, или отпечатков, смыва на соответствующие питательные среды (среда Блаурокка для бифидобактерий, среда МРС-2 для лактобактерий, анаэробный кровяной агар для бактероидов, среда Левина или Эндо для энтеробактерий, желчно-кровяной агар для энтерококков, кровяной агар для стрептококков и гемофилов, мясопептонный агар с фурагином для синегнойной палочки, среду Сабуро для грибов и др.). 2. Определение в исследуемом материале микробных метаболитов - маркеров дисбиоза (жирных кислот, гидроксижирных кислот, жирнокислотных альдегидов, ферментов и др.). Например, обнаружение в фекалиях бета-аспартил-глицина и бета-аспартил-лизина свидетельствует о нарушении кишечного микробиоценоза, так как в норме эти дипептиды метаболизируются кишечной анаэробной микрофлорой
Для восстановления нормальной микрофлоры проводят: а) селективную деконтаминацию; б)назначают препараты пробиотиков* (эубиотиков), полученные из лиофильно высушенных живых бактерий - представителей нормальной микрофлоры кишечника - бифидобактерий (бифидумбактерин), кишечной палочки (колибактерин) лактобактерий (лактобактерин) и др. __________________________________________________________________________ * _Пробиотики – препараты, оказывающие при приеме per os нормализирующее действие на организм человека и его микрофлору. __________________________________________________________________________
|
ФАГОЦИТИРУЮЩИЕ КЛЕТКИ ОРГАНИЗМА.
Защитная роль подвижных клеток крови и тканей была впервые обнаружена И. И. Мечниковым в 1883 г. Он назвал эти клетки фагоцитами и сформулировал основные положения фагоцитарной теории иммунитета.
| Фагоцитоз - поглощение фагоцитом крупных макромолекулярных комплексов или корпускул, бактерий. Клетки-фагоциты: нейтрофилы и моноциты/макрофаги. Фагоцитировать могут также эозинофилы (наиболее эффективны при антигельминтном иммунитете). Процесс фагоцитоза усиливают опсонины, обволакивающие объект фагоцитоза. Моноциты составляют 5-10 %, а нейтрофилы 60-70 % лейкоцитов крови. Поступая в ткань моноциты формируют популяцию тканевых макрофагов: купферовские клетки (или звездчатые ретикулоэндотелиоциты печени), микроглия ЦНС, остеокласты костной ткани, альвеолярные и интерстициальные макрофаги).
| | Процесс фагоцитоза
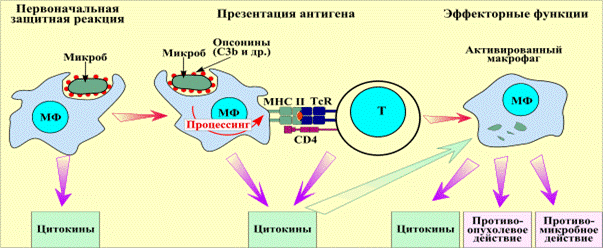
| | Фагоциты направленно перемещаются к объекту фагоцитоза, реагируя на хемоаттрактанты: вещества микробов, активированные компоненты комплемемента (С5a, C3a) и цитокины. Плазмалемма фагоцита обхватывает бактерии или другие корпускулы и собственные поврежденные клетки. Затем объект фагоцитоза окружается плазмалеммой и мембранная везикула (фагосома), погружается в цитоплазму фагоцита. Мембрана фагосомы сливается с лизосомой и фагоцитированный микроб разрушается, pН закисляется до 4,5; активируются ферменты лизосомы. Фагоцитированный микроб разрушается под действием ферментов лизосом, катионных белков дефенсинов, катепсина G, лизоцима и др. факторов. При окислительном (дыхательном) взрыве в фагоците образуются токсичные антимикробные формы кислорода – перекись водорода H2O2, суперосиданион O2-, гидроксильный радикал ОH-, синглетный кислород. Кроме этого антимикробным действием обладают окись азота и радикал NO-. Макрофаги выполняют защитную функцию еще до взаимодействия с другими иммунокомпетентными клетками (неспецифическая резистентность). Активация макрофага происходит после разрушения фагоцитируемого микроба, его процессинга (переработки) и презентации (представлении) антигена T-лимфоцитам. В заключительную стадию иммунного ответа Т-лимфоциты выделяют цитокины, активирующие макрофаги (приобретенный иммунитет). Активированные макрофаги вместе с антителами и активированным комплементом (С3b) осуществляют более эффективный фагоцитоз (иммунный фагоцитоз), разрушая фагоцитированные микробы.
| | Центральная роль макрофага в иммунитете
| 
| | Фагоцитоз может быть завершенным, завершающимся гибелью захваченного микроба, и незавершенным, при котором микробы не погибают. Примером незавершенного фагоцитоза является фагоцитоз гонококков, туберкулезных палочек и лейшманий.
| Незавершенный фагоцитоз микобактерий (окраска по Цилю-Нельсену)
|
Все фагоцитирующие клетки организма, по И. И. Мечникову, подразделяются на макрофаги и микрофаги. К м и к р о ф а г а м относятся полиморфно-ядерные гранулоциты крови: нейтрофилы, эозинофилы и базофилы. Макрофаги различных тканей организма (соединительной ткани, печени, легких и др.) вместе с моноцитами крови и их костномозговыми предшественниками (промоноциты и монобласты) объединены в особую систему мононуклеарных фагоцитов (СМФ). СМФ филогенетически более древняя по сравнению с иммунной системой. Она формируется в онтогенезе достаточно рано и имеет определенные возрастные особенности.
Микрофаги и макрофаги имеют общее миелоидное происхождение - от полипотентной стволовой клетки, которая является единым предшественником грануло- и моноцитопоэза. В периферической крови содержится больше гранулоцитов (от 60 до 70 % всех лейкоцитов крови), чем моноцитов (от 1 до 6 %). Вместе с тем длительность циркуляции моноцитов в крови значительно больше (полупериод 22 ч), чем короткоживущих гранулоцитов (полупериод 6,5 ч). В отличие от гранулоцитов крови, являющихся зрелыми клетками, моноциты, покидая кровяное русло, в соответствующем микроокружении созревают в тканевые макрофаги. Внесосудистый пул мононуклеарных фагоцитов в десятки раз превышает их число в крови. Особенно богаты ими печень, селезенка, легкие.
Все фагоцитирующие клетки характеризуются общностью основных функций, сходством структур и метаболических процессов. Наружная плазматическая мембрана всех фагоцитов является активно функционирующей структурой. Она отличается выраженной складчатостью и несет множество специфических рецепторов и антигенных маркеров, которые постоянно обновляются. Фагоциты снабжены высокоразвитым лизосомным аппаратом, в котором содержится богатый арсенал ферментов. Активное участие лизосом в функциях фагоцитов обеспечивается способностью их мембран к слиянию с мембранами фагосом или с наружной мембраной. В последнем случае происходит дегрануляция клеток и сопутствующая секреция лизосомных ферментов во внеклеточное пространство.
Фагоцитам присущи три функции: 1 - защитная, связанная с очисткой организма от инфекционных агентов, продуктов распада тканей и т. д.; 2 - представляющая, заключающаяся в презентации антигенных эпитопов на мембране фагоцита; 3 - секреторная, связанная с секрецией лизосомных ферментов и других биологически активных веществ - монокинов, играющих важную роль в иммуногенезе.
В соответствии с перечисленными функциями различают следующие последовательно протекающие стадии фагоцитоза.
1. Хемотаксис - целенаправленное передвижение фагоцитов в направлении химического градиента хемоаттрактантов в окружающей среде. Способность к хемотаксису связана с наличием на мембране специфических рецепторов для хемоаттрактантов, в качестве которых могут выступать бактериальные компоненты, продукты деградации тканей организма, активированные фракции системы комплемента - С5а, СЗа, продукты лимфоцитов- лимфокины.
2. Адгезия (прикрепление) также опосредована соответствующими рецепторами, но может протекать в соответствии с законами неспецифического физико-химического взаимодействия. Адгезия непосредственно предшествует эндоцитозу (захвату).
3. Эндоцитоз является основной физиологической функцией так называемых профессиональных фагоцитов. Различают фагоцитоз - в отношении частиц с диаметром не менее 0,1 мкм и пиноцитоз - в отношении более мелких частиц и молекул. Фагоцитирующие клетки способны захватывать инертные частицы угля, кармина, латекса, обтеканием их псевдоподиями без участия специфических рецепторов. В то же время фагоцитоз многих бактерий, дрожжеподобных грибов рода Саndida и других микроорганизмов опосредован специальными маннозофукозными рецепторами фагоцитов, распознающими углеводные компоненты поверхностных структур микроорганизмов. Наиболее эффективным является фагоцитоз, опосредованный рецепторами, для Fс-фрагмента иммуноглобулинов и для СЗ-фракции комплемента. Такой фагоцитоз называют иммунным, так как он протекает при участии специфических антител и активированной системы комплемента, опсонизирующих микроорганизм. Это делает клетку высокочувствительной к захвату фагоцитами и приводит к последующей внутриклеточной гибели и деградации.
В результате эндоцитоза образуется фагоцитарная вакуоль - фагосома.
Следует подчеркнуть, что эндоцитоз микроорганизмов в большой степени зависит от их патогенности. Лишь авирулентные или низковирулентные бактерии (бескапсульные штаммы пневмококка, штаммы стрептококка, лишенные гиалуроновой кислоты и М-протеина) фагоцитируются непосредственно. Большинство бактерий, наделенных факторами агрессивности (стафилококки- А - протеином, кишечные палочки - выраженным капсульным антигеном, сальмонеллы - Vi -антигеном и др.), фагоцитируются, только после их опсонизации комплементом или (и) антителами.
Внутриклеточное переваривание начинается по мере поглощения бактерий или других объектов. Оно происходит в фаголизосомах, образующихся за счет слияния первичных лизосом с фагосомами. Захваченные фагоцитами микроорганизмы погибают в результате осуществления механизмов микробоцидности этих клеток. Различают кислородзависимые механизмы микробоцидности, связанные с окислительным взрывом, и кислороднезависимые механизмы, опосредованные катионными белками и ферментами (в том числе лизоцимом), попадающими в фагосому в результате ее слияния с лизосомами.
Так называемый окислительный взрыв проявляется усилением потребления кислорода и глюкозы и одновременным выбросом биологически активных нестабильных продуктов восстановления кислорода: пероксида водорода Н2О2, супероксиданионов О2, гидроксильных радикалов ОН -. При этом нестабильные кислородные радикалы участвуют в микробоцидности фагоцитов.
Внутриклеточная участь захваченных фагоцитами микроорганизмов может быть различной в зависимости от их вирулентности, и способности к внутриклеточному паразитизму. Авирулентные и низковирулентные бактерии погибают и перевариваются в фаголизосомах лизосомными гидролазами.
Незавершенный фагоцитоз. Многие вирулентные бактерии часто не погибают и могут длительно персистировать внутри фагоцитов. Факультативно и облигатно внутриклеточные паразиты после эндоцитоза сохраняют жизнеспособность и размножаются внутри фагоцитов, вызывая их гибель и разрушение.
Выживание фагоцитированных микроорганизмов могут обеспечивать различные механизмы. Одни патогенные агенты способны препятствовать слиянию лизосом с фагосомами (токсоплазмы, микобактерии туберкулеза). Другие обладают устойчивостью к действию лизосомных ферментов (гонококки, стафилококки, стрептококки группы А и др.). Третьи после эндоцитоза покидают фагосому, избегая действия микробоцидных факторов, и могут длительно персистировать в цитоплазме фагоцитов (риккетсии и др.). В этих случаях фагоцитоз остается незавершенным.
Презентативная, или представляющая, функция макрофагов состоит в фиксации на наружной мембране антигенных эпитопов микроорганизмов. В таком виде они бывают представлены макрофагами для их специфического распознавания клетками иммунной системы - Т-лимфоцитами.
Секреторная функция заключается в секреции биологически активных веществ - монокинов мононуклеарными фагоцитами. К ним относятся вещества, оказывающие регулирующее действие на пролиферацию, дифференциацию и функции фагоцитов, лимфоцитов, фибробластов и других клеток. Особое место среди них занимает интерлейкин- 1 (ИЛ-1), который секретируется макрофагами. Он активирует многие функции Т-лимфоцитов, в том числе продукцию лимфокина - интерлейкина-2 (ИЛ-2).
ИЛ-1 и ИЛ-2 являются клеточными медиаторами, участвующими в регуляции иммуногенеза и разных форм иммунного ответа. Одновременно ИЛ-1 обладает свойствами эндогенного пирогена, поскольку он индуцирует лихорадку, действуя на ядра переднего гипоталамуса. Макрофаги продуцируют и секретируют такие важные регуляторные факторы, как простагландины, лейкотриены, циклические нуклеотиды с широким спектром биологической активности.
Наряду с этим фагоциты синтезируют и секретируют ряд продуктов с преимущественно эффекторной активностью: антибактериальной, антивирусной и цитотоксической. К ним относятся кислородные радикалы (О2, Н2О2), компоненты комплемента, лизоцим и другие лизосомные ферменты, интерферон. За счет этих факторов фагоциты могут убивать бактерии не только в фаголизосомах, но и вне клеток, в ближайшем микроокружении. Этими секреторными продуктами может быть опосредовано также цитотоксическое действие фагоцитов на различные клетки-мишени в клеточно-опосредованных реакциях иммунитета, например в реакции гиперчувствительности замедленного типа (ГЗТ, при отторжении гомотрансплантатов, в противоопухолевом иммунитете.
Рассмотренные функции фагоцитирующих клеток обеспечивают их активное участие в поддержании гомеостаза организма, в процессах воспаления и регенерации,- в неспецифической противоинфекционной защите, а также в иммуногенезе и реакциях специфического клеточного иммунитета (ГЗТ). Раннее вовлечение фагоцитирующих клеток (сначала - гранулоцитов, затем - макрофагов) в ответную реакцию на любую инфекцию или какое-либо повреждение объясняется тем, что микроорганизмы, их компоненты, продукты некроза тканей, белки сыворотки крови, вещества, секретируемые другими клетками, являются хемоаттрактантами для фагоцитов. В очаге воспаления происходит активация функций фагоцитов. Макрофаги приходят на смену микрофагам.
В тех случаях, когда воспалительной реакции с участием фагоцитов оказывается недостаточно для очищения организма от возбудителей, тогда секреторные продукты макрофагов обеспечивают вовлечение лимфоцитов и индукцию специфического иммунного ответа.
Дата добавления: 2014-12-12 | Просмотры: 2938 | Нарушение авторских прав
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
|

 Организм человека заселен (колонизирован) примерно 500 видами микроорганизмов, составляющими его нормальную микрофлору, в виде сообщества микроорганизмов (микробиоценоз). Они находятся в состоянии равновесия (эубиоза) друг с другом и организмом человека. Большинство этих микроорганизмов являются комменсалами, не причиняющими вреда человеку. Микрофлора колонизирует поверхность тела и полости, сообщающиеся с окружающей средой. В норме микроорганизмы отсутствуют в легких, матке и внутренних органах. Различают постоянную и транзиторную микрофлору. Постоянная (резидентная) микрофлора представлена микроорганизмами, постоянно присутствующими в организме. Транзиторная (непостоянная, или аллохтонная) микрофлора неспособна к длительному существованию в организме.
Организм человека заселен (колонизирован) примерно 500 видами микроорганизмов, составляющими его нормальную микрофлору, в виде сообщества микроорганизмов (микробиоценоз). Они находятся в состоянии равновесия (эубиоза) друг с другом и организмом человека. Большинство этих микроорганизмов являются комменсалами, не причиняющими вреда человеку. Микрофлора колонизирует поверхность тела и полости, сообщающиеся с окружающей средой. В норме микроорганизмы отсутствуют в легких, матке и внутренних органах. Различают постоянную и транзиторную микрофлору. Постоянная (резидентная) микрофлора представлена микроорганизмами, постоянно присутствующими в организме. Транзиторная (непостоянная, или аллохтонная) микрофлора неспособна к длительному существованию в организме.
 Микрофлора кожи.На коже в ее более глубоких слоях (волосяных мешочках, протоках сальных и потовых желез) анаэробов в 2-10 раз больше, чем аэробов. Кожу колонизируют грамположительные бактерии (пропионибактерии, коринеформные бактерии, эпидермальные стафилококки и другие коагулазоотрицательные стафилококки*, микрококки, пептострептококки, стрептококки, Dermabacter hominis), дрожжеподобные грибы рода Malassezia, реже встречается транзиторная микрофлора (Staphylococcus aureus, Streptococcus pyogenes и др.). При ослаблении организма на коже возрастает количество грамотрицательных бактерий. В норме на 1 см2 кожи приходится менее 80 000 микроорганизмов и это количество не увеличивается в результате действия бактерицидных стерилизующих факторов. Например, в поте кожи обнаружены - иммуноглобулины классов А и G, трансферин, лизоцим, органические кислоты и другие противомикробные вещества. Низкий уровень рН (5,5), низкая температура кожи также ограничивают размножение микроорганизмов. Более увлажненные участки кожи колонизируются наибольшим количеством микроорганизмов (106 на 1 см2), например, в паховых складках, межпальцевых пространствах, подмышечных впадинах. Усиленный рост микроорганизмов происходит при загрязнении кожи; при ослаблении организма размножающиеся там микроорганизмы определяют запах тела. Микрофлора кожи имеет большое значение в распространении микроорганизмов в воздухе. В результате десквамации (шелушения) кожи несколько миллионов чешуек, несущих каждая несколько микроорганизмов, загрязняют окружающую среду. __________________________________________________________________________ * _Staphylococcus hominis, Staphylococcus haemolyticus, Staphylococcus warneri, Staphylococcus capitis (на лбу, лице), Staphylococcus saprophyticus, Staphylococcus caprae, Staphylococcus saccharolyticus, Staphylococcus pasteuri, Staphylococcus lugdunensis, Staphylococcus simulans, Staphylococcus xylosis. Staphylococcus auricularis колонизирует внешний слуховой канал. __________________________________________________________________________
Микрофлора кожи.На коже в ее более глубоких слоях (волосяных мешочках, протоках сальных и потовых желез) анаэробов в 2-10 раз больше, чем аэробов. Кожу колонизируют грамположительные бактерии (пропионибактерии, коринеформные бактерии, эпидермальные стафилококки и другие коагулазоотрицательные стафилококки*, микрококки, пептострептококки, стрептококки, Dermabacter hominis), дрожжеподобные грибы рода Malassezia, реже встречается транзиторная микрофлора (Staphylococcus aureus, Streptococcus pyogenes и др.). При ослаблении организма на коже возрастает количество грамотрицательных бактерий. В норме на 1 см2 кожи приходится менее 80 000 микроорганизмов и это количество не увеличивается в результате действия бактерицидных стерилизующих факторов. Например, в поте кожи обнаружены - иммуноглобулины классов А и G, трансферин, лизоцим, органические кислоты и другие противомикробные вещества. Низкий уровень рН (5,5), низкая температура кожи также ограничивают размножение микроорганизмов. Более увлажненные участки кожи колонизируются наибольшим количеством микроорганизмов (106 на 1 см2), например, в паховых складках, межпальцевых пространствах, подмышечных впадинах. Усиленный рост микроорганизмов происходит при загрязнении кожи; при ослаблении организма размножающиеся там микроорганизмы определяют запах тела. Микрофлора кожи имеет большое значение в распространении микроорганизмов в воздухе. В результате десквамации (шелушения) кожи несколько миллионов чешуек, несущих каждая несколько микроорганизмов, загрязняют окружающую среду. __________________________________________________________________________ * _Staphylococcus hominis, Staphylococcus haemolyticus, Staphylococcus warneri, Staphylococcus capitis (на лбу, лице), Staphylococcus saprophyticus, Staphylococcus caprae, Staphylococcus saccharolyticus, Staphylococcus pasteuri, Staphylococcus lugdunensis, Staphylococcus simulans, Staphylococcus xylosis. Staphylococcus auricularis колонизирует внешний слуховой канал. __________________________________________________________________________  Нормальная микрофлора обладает антагонистическими свойствами против патогенной и гнилостной микрофлоры, так как продуцирует молочную, уксусную кислоты, антибиотики, бактериоцины; конкурирует с посторонней микрофлорой за счет более высокого биологического потенциала.
Нормальная микрофлора обладает антагонистическими свойствами против патогенной и гнилостной микрофлоры, так как продуцирует молочную, уксусную кислоты, антибиотики, бактериоцины; конкурирует с посторонней микрофлорой за счет более высокого биологического потенциала. 