|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ОБЩАЯ ИММУНОЛОГИЯ
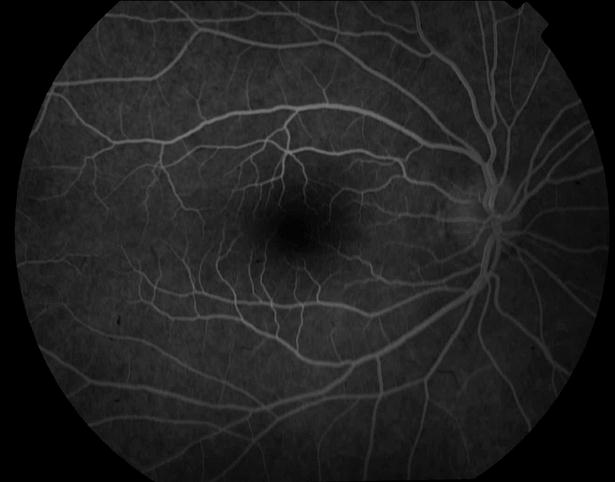
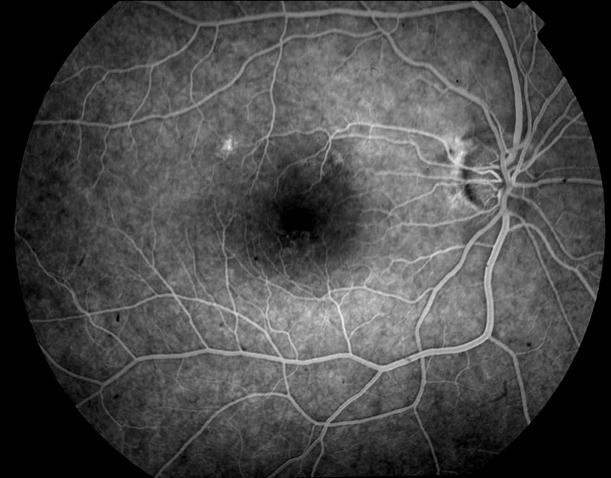
Рисунок 1. Нормальная картина глазного дна на ФА.
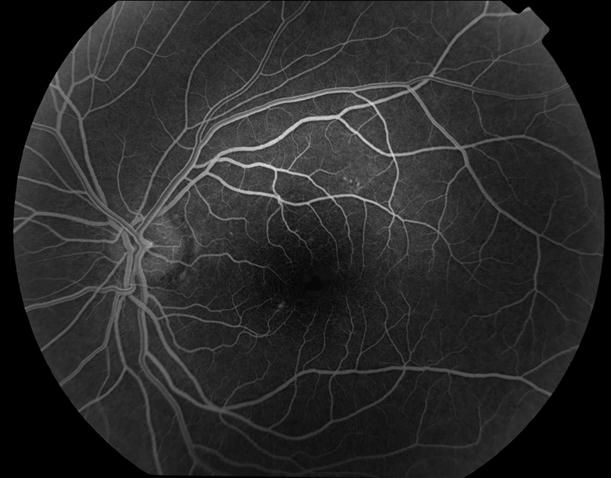
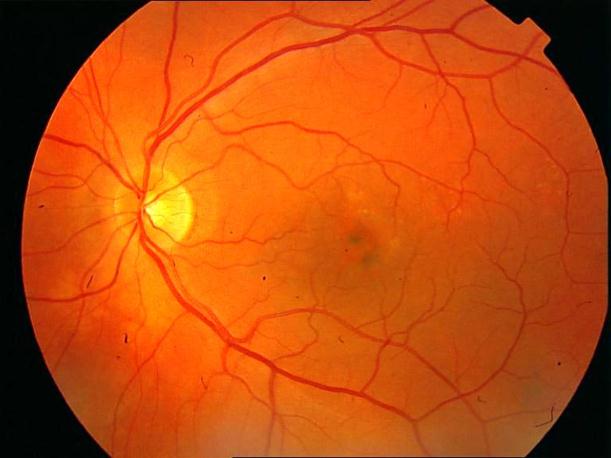
Рисунок 2. Артериовенозная фаза ФА у пациента с единичными друзами. Нормальная структура глазного дна. Рекомендован контроль состояния глазного дна не реже одного раза в шесть месяцев.
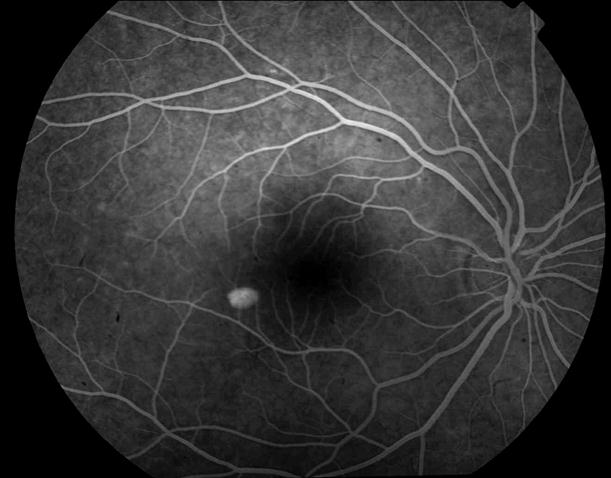
Рисунок 3. Локальная отслойка пигментного ретинального эпителия. Поздняя фаза ФА. Показана ангиопротекторная терапия.
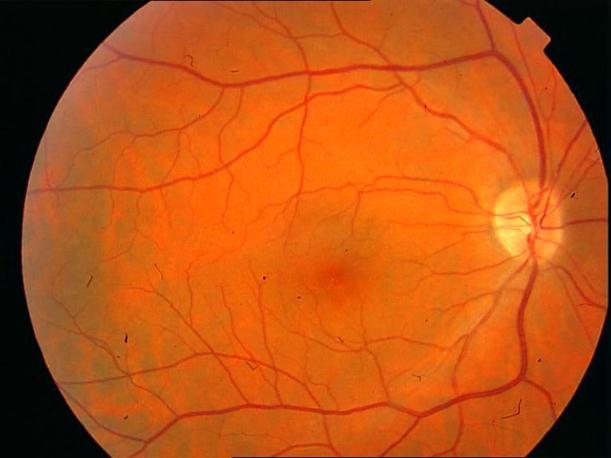
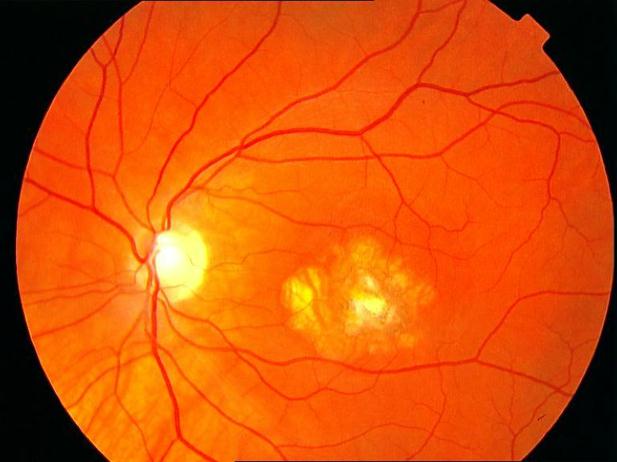
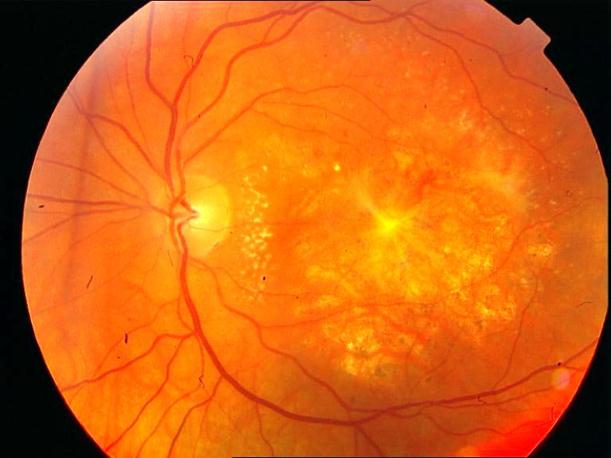
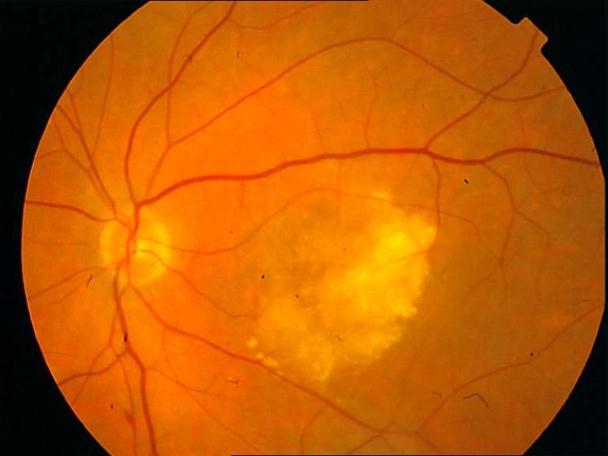
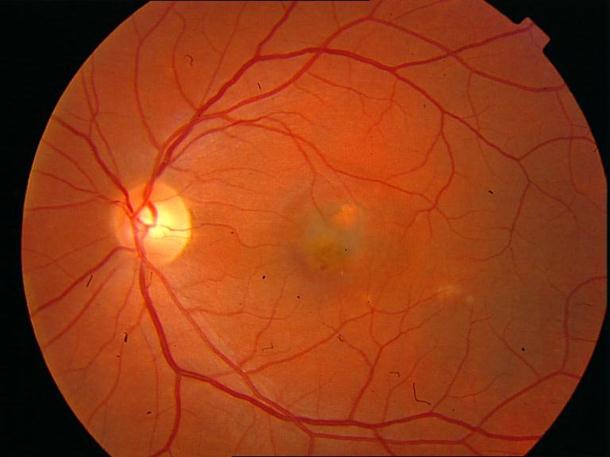
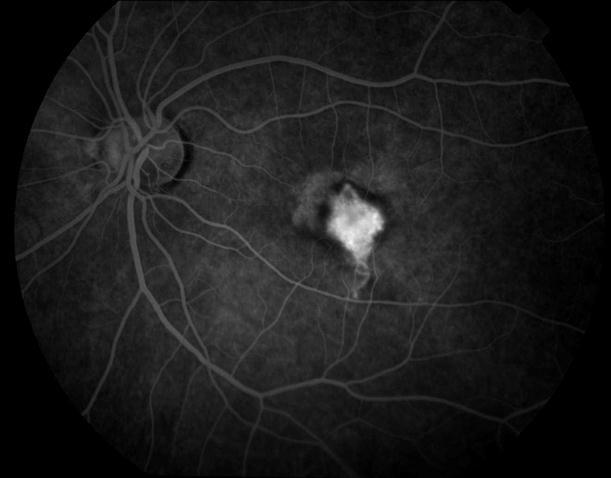
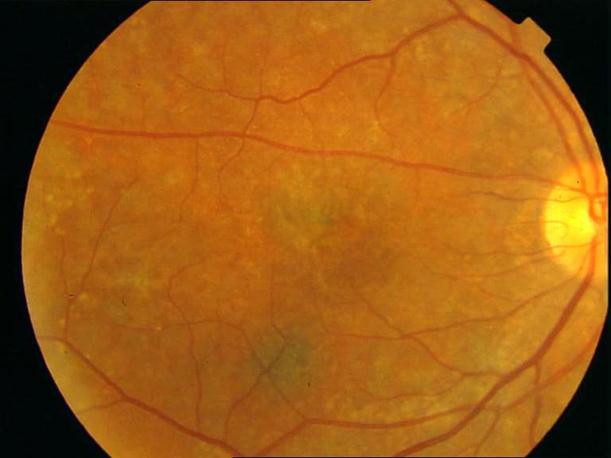
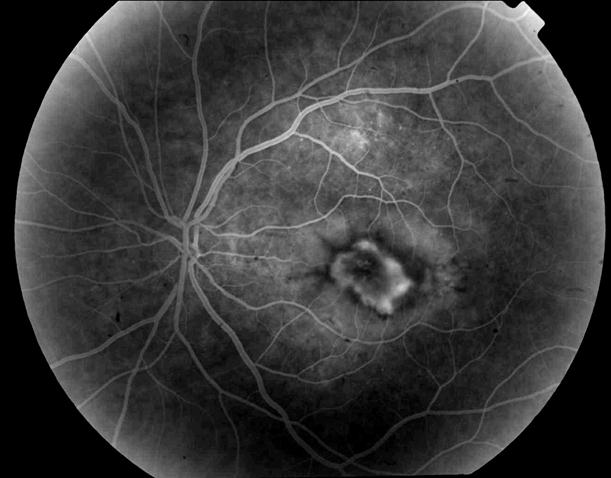
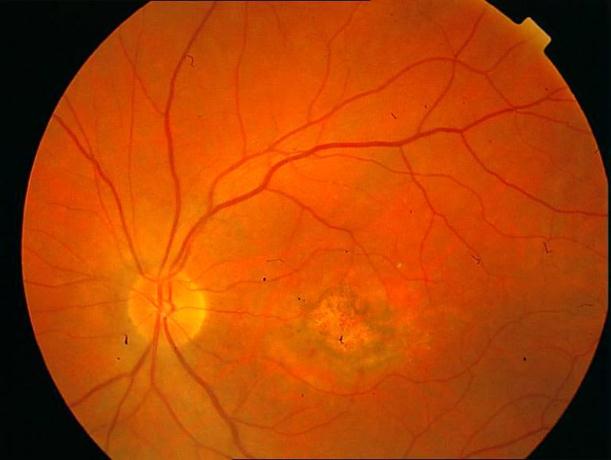
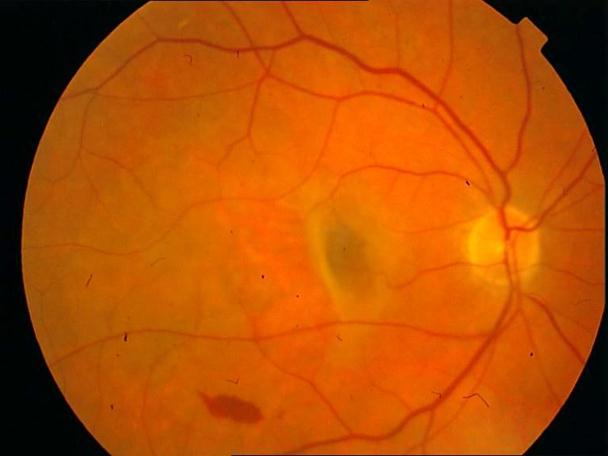
Рисунок 4. Мелкие интраретинальные друзы в заднем полюсе.
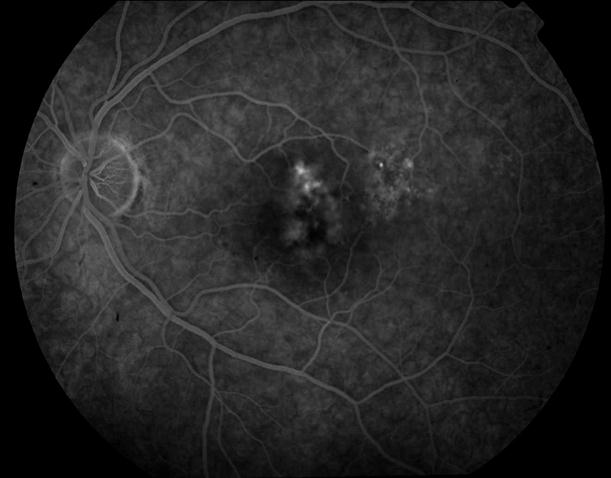
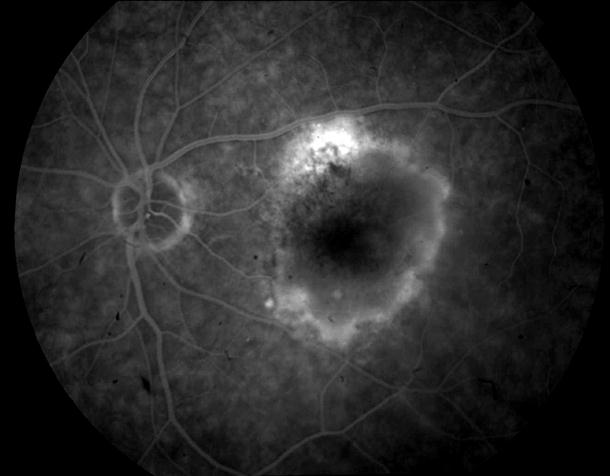
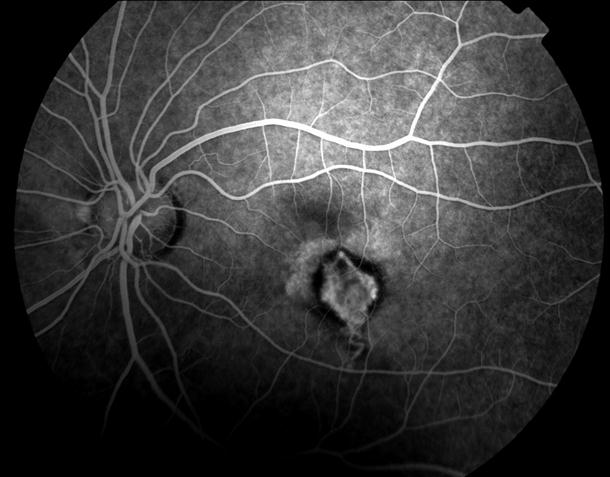
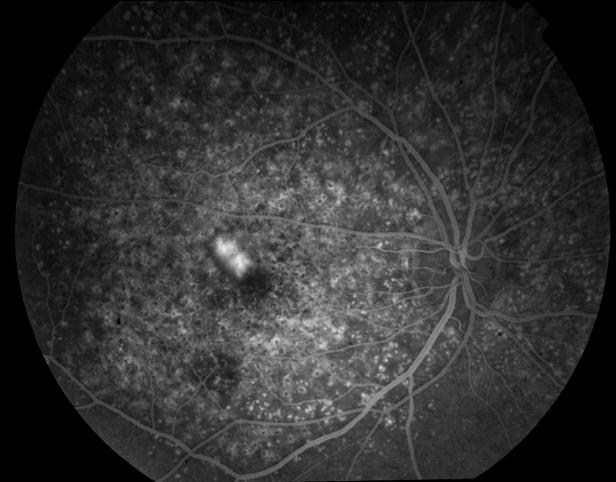
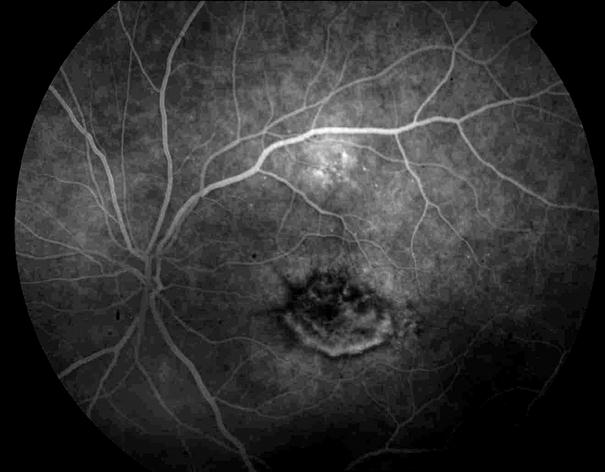
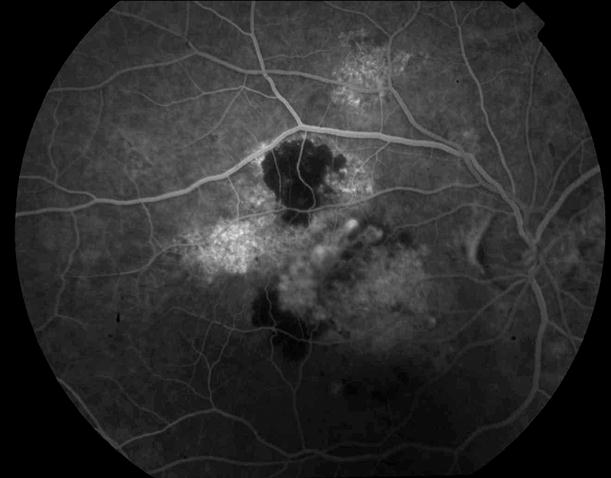
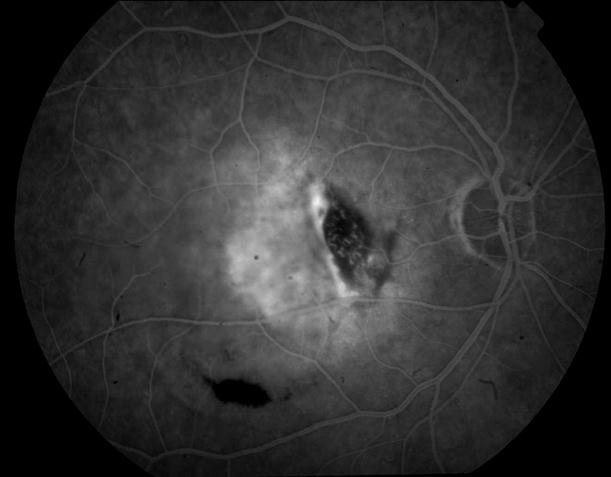
Рисунок 5. На ФА этого же больного гиперфлюоресценция в области скопления друз парамакулярно на 10.30. Изменена нормальная структурность центральной аваскулярной зоны. Показан контроль АД, уровня холестерина крови. Назначаются препараты, улучшающие трофику сетчатки. Контроль состояния глазного дна не реже одного раза в шесть месяцев.
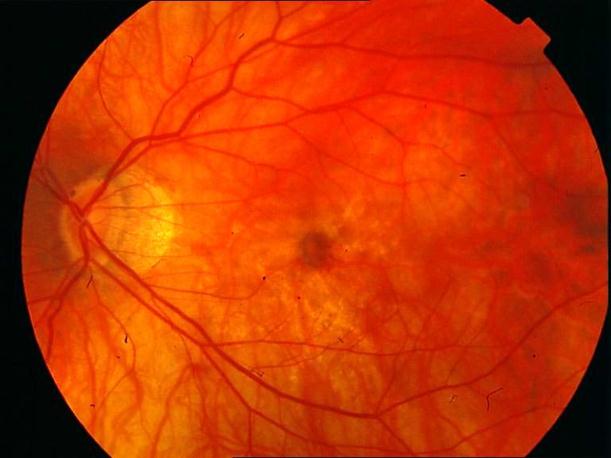
Рисунок 6. Географическая атрофия пигментного ретинального эпителия. Показана консервативная терапия, направленная на улучшение микроциркуляции. Развития СНМ не ожидается. Острота зрения – 0,09 – 0,1 с максимальной коррекцией. Чтение с лупой текста №8. Риск дальнейшего снижения остроты зрения умеренный.
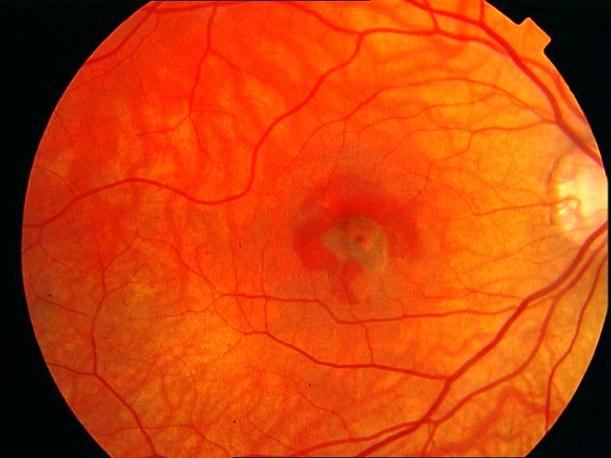
Рисунок 7. Атрофический очаг хориоидеи и пигментного ретинального эпителя в исходе перенесенного врожденного центрального хориоретинита. Развития СНМ не ожидается.
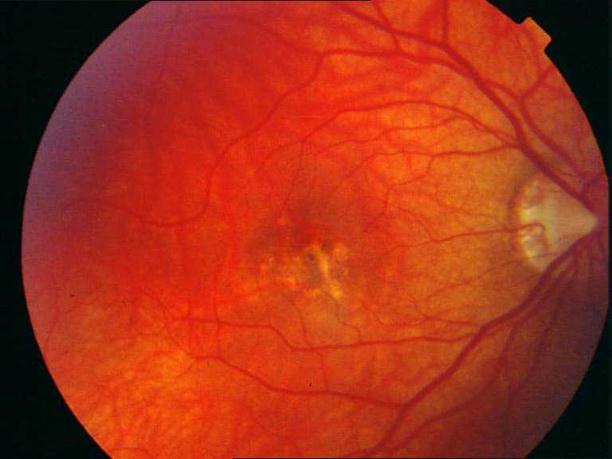
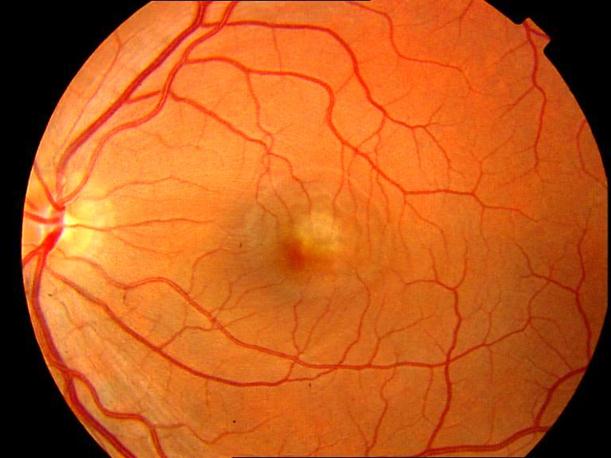
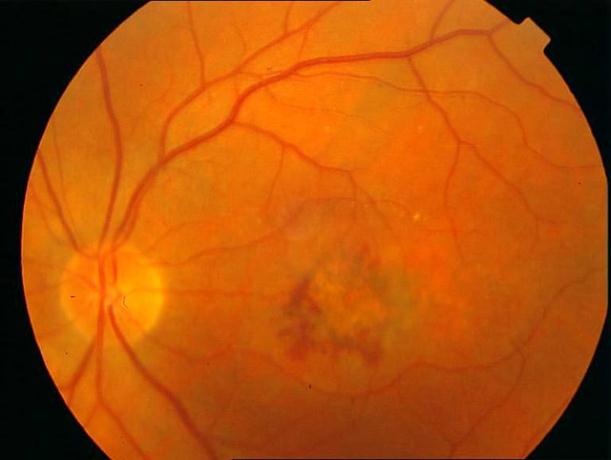
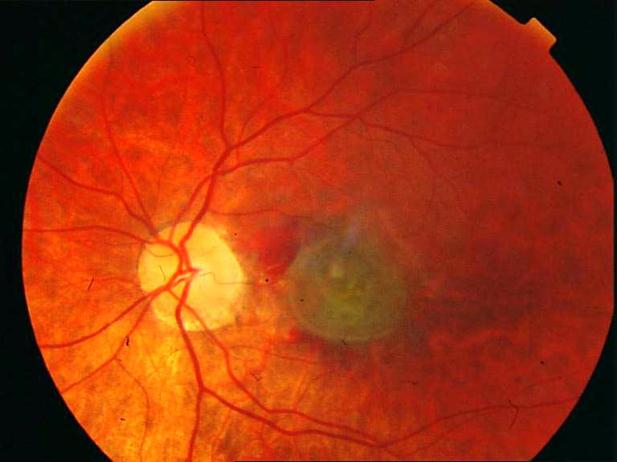
Рисунок 8. Центральная хориоретинальная дистрофия. Отек сетчатки, дезорганизация пигмента в фовеа. Твердые друзы в заднем полюсе.
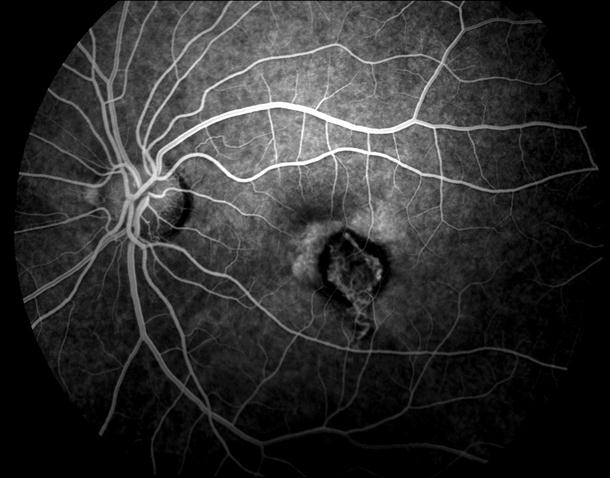
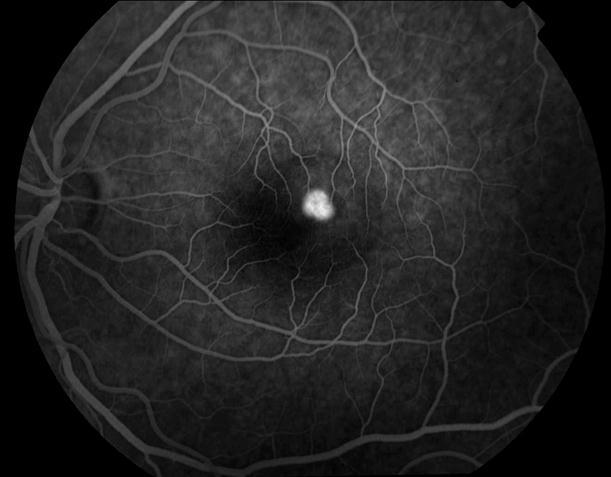
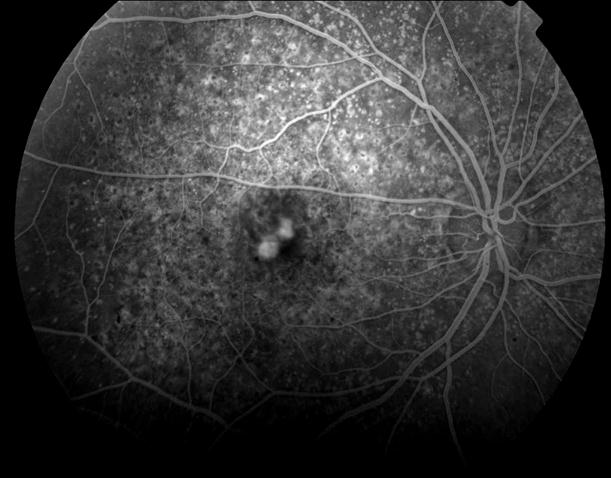
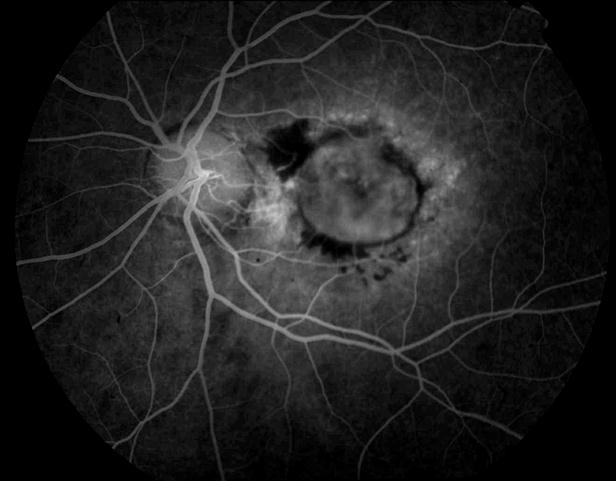
Рисунок 9. На ФА этого же больного видны дефекты пигментного эпителия в области дистрофии и дефекты мембраны Бруха в верхнем сегменте фовеа. Показана консервативная ангиопротекторная и ноотропная терапия. Вероятность развития СНМ высокая.
Рисунок 10. Большой очаг атрофии пигментного эпителия, интраретинальный фиброз в макуле. По краю очага старые твердые экссудаты. Острота зрения – сотые. Лечебные мероприятия малоперспективны.
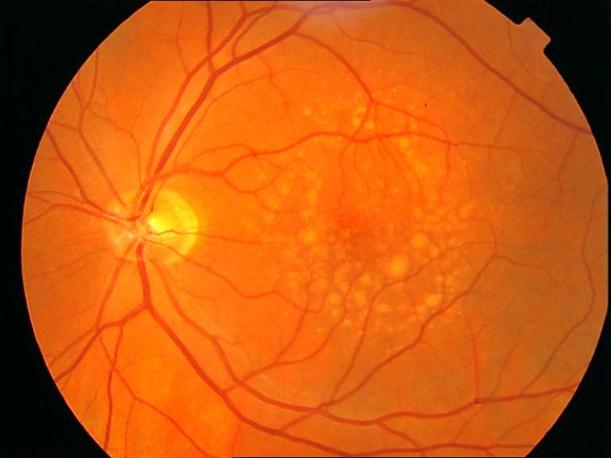
Рисунок 11. Мягкие сливные друзы в заднем полюсе на фоне сенильной макулодистрофии. Острота зрения с максимальной коррекцией 0,7.
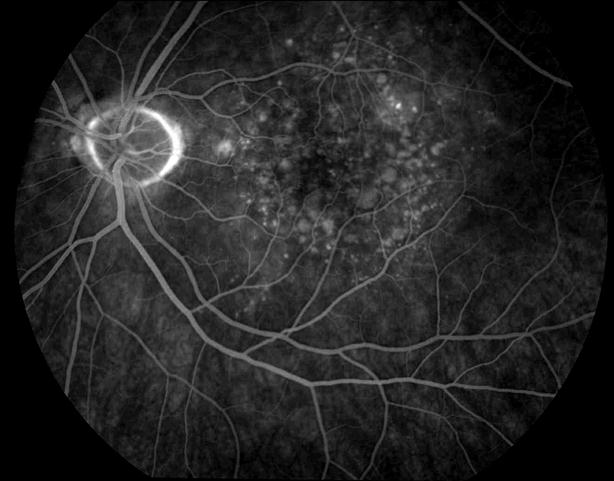
Рисунок 12. ФА этого же больного. Показано консервативное лечение, направленное на улучшение трофических процессов в заднем полюсе. Вероятность развития СНМ высокая. Рекомендован контроль состояния глазного дна один раз в 3 – 6 месяцев. Возможна прямая (субпороговая, микроимпульсная) лазеркоагуляция мягких друз.
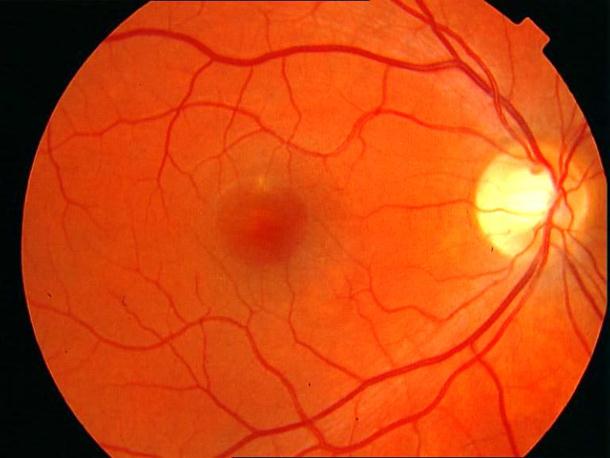
Рисунок 13. Центральная серозная хориоретинопатия. Отслойка нейроэпителия в фовеа. Острота зрения с максимальной коррекцией 0,4. Жалобы на «пятно» перед глазом, искажения предметов.
Рисунок 14. Этот же больной. Очажки просачивания по ходу веточки верхнее-височной артерии на ФА. Показано длительное назначение ангиопротекторов (дицинон, добезилат кальция и т.п.). Возможна прямая лазеркогуляция наиболее яркой точки просачивания по краю центральной аваскулярной зоны на 12 часах.
Рисунок 15. Центральная серозная хориоретинопатия. Отслойка нейроэпителия в фовеа. Жалобы на «пятно» перед глазом, искажение предметов. Острота зрения 0,8, коррекции не поддается.
Рисунок 16. На ФА этого же больного определяются две точки просачивания. Выполнена прямая лазеркоагуляция точек просачивания, назначены ангиопротекторные препараты. Зрение поднялось до1,0 (исходного), жалобы на искажения и «пятно» перед глазом исчезли. Вероятность развития СНМ и значительного снижения центрального зрения без лазерного лечения высокая.
Рисунок 17. Отек сетчатки в маклярной зоне, скопления твердых и мягких экссудатов по краю. В фовеа предположительно скрытая хориоидальная неоваскуляризация.
Рисунок 18. Влажная форма сенильной макулодистрофии. Обширная зона отека сетчатки, множественные интраретинальные включения.
Рисунок 19. На ФА этого же больного признаки ишемического отека сетчатки и формирующегося интраретинального рубца в макуле. Показана консервативная терапия ишемических изменений. Острота зрения 0,05 с максимальной коррекцией. Прогноз неблагоприятный.
Рисунок 20. Влажная форма сенильной макулодистрофии. Отек сетчатки в макулярной зоне, сливные интраретинальные экссудаты в большом количестве, дезорганизация пигмента.
Рисунок 21. ФА того же больного. Ишемический отек и скопления экссудатов экранируют свечение центральной части макулярной зоны. Острота зрения – сотые. Лечебные мероприятия малоперспективны.
Рисунок 22. Глазное дно пациента с близорукостью высокой степени. Подозрение на субфовеальную СНМ. Показано проведение ФА. При выявлении СНМ – проведение ФДТ. Показана ангиопротекторная терапия и местное введение стероидных препаратов (дипроспан, кеналог парабульбарно).
Рисунок 23. Субретинальная неоваскулярная мембрана, интраретинальное кровоизлияние. Покзано выпонение ФА и ФДТ в ближайшее время (проведено). Острота зрения с максимальной коррекцией 0,1. Ранее пациент получал консервативное лечение, на фоне которого зрение прогрессивно снижалось.
Рисунок 24. Фотография глазного дна этого же пациента через 2 года. Полный регресс неоваскулярной мембраны. В фовеа определяется дезорганизация пигмента и нежный интраретинальный рубчик. Острота зрения с максимальной коррекцией 0,9 – 1,0 (миопия высокой степени).
Рисунок 25. Субфовеальная СНМ, отслойка нейроэпителия в фовеа с геморрагическим компонентом. Показано выполнение ФА с последующей ФДТ.
Рисунок 26. Серозная отслойка пигментного и нейроэпителия, субретинальная неоваскулярная мембрана, осложненная интраретинальным кровоизлиянием. Показано проведение ФА. Выполнение ФДТ возможно. Прогноз по остроте зрения неблагоприятный.
Рисунок 27. Венозная фаза ФА. Субретинальная неоваскулярная мембрана с видимым питающим сосудом.
Рисунок 28. Тот же больной. Венозная фаза ФА.
Рисунок 29. Тот же больной. Фаза рециркуляции ФА. Выполнена ФДТ с визудином. Острота зрения с 0,02 поднялась до 0,2. Читает с расстояния 10см текст №7. Функции остаются стабильными 2 года.
Рисунок 30. Миопическое глазное дно. Субретинальная неоваскулярная мембрана. Острота зрения с максимальной коррекцией 0,2. Показано выполнение ФА с последующей ФДТ.
Рисунок 31. Серозная отслойка нейроэпителия, субретинальная неоваскулярная мембрана, осложненная интраретинальным кровоизлиянием.
Рисунок 32. ФА этого больного. Поздняя венозная фаза.
Рисунок 33. Тот же больной при естественном течении заболевания через 7 месяцев. Серозная отслойка нейроэпителия, геморрагическая отслойка пигментного эпителия, субретинальная неоваскулярная мембрана, осложненная интраретинальным кровоизлиянием, мелкие интраретинальные друзы.
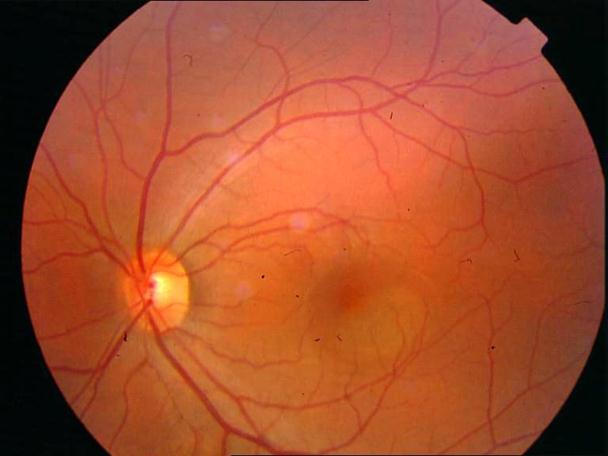
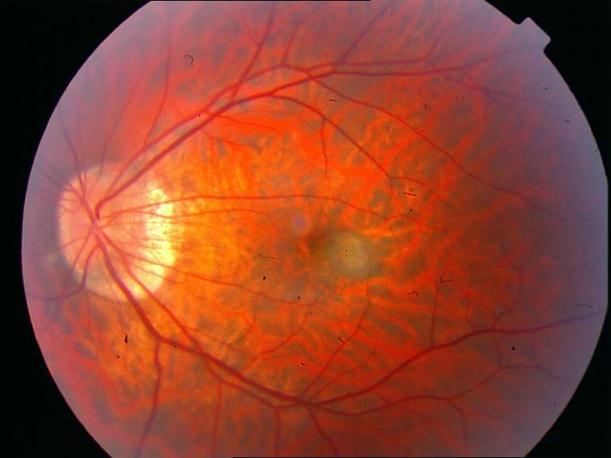
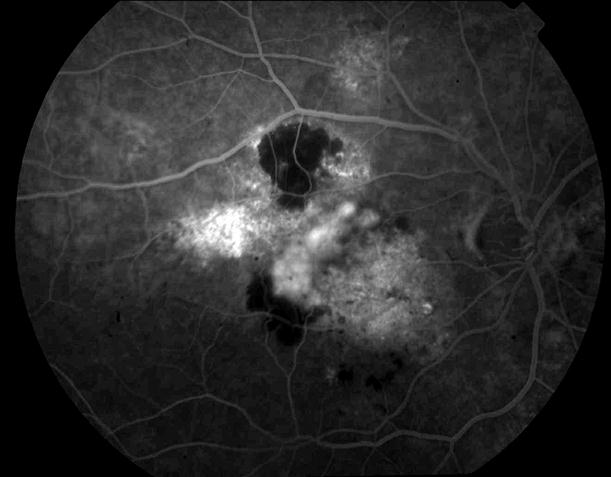
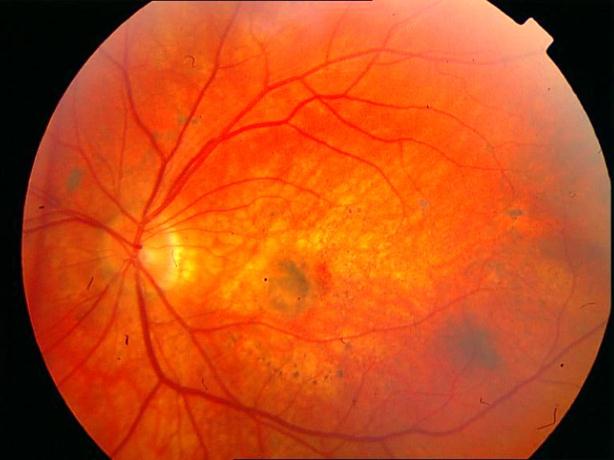
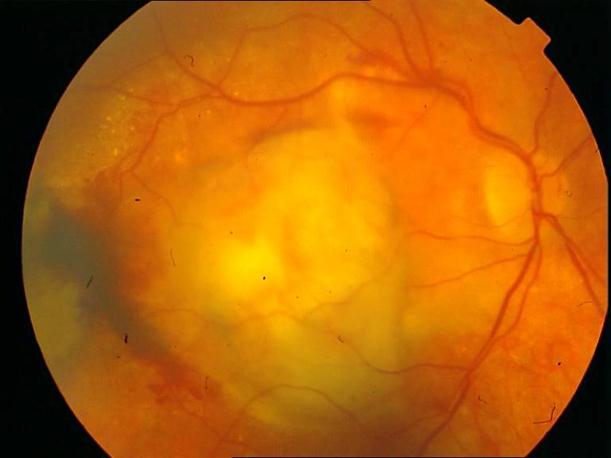
Рисунок 34. Большое количество интраретинальных друз. Отсутствие физиологических световых рефлексов. Рыхлость, отечность сетчатки в фовеа и парафовеа в верхне-наружном сегменте. Участок гиперпигментации хориоидеи на 6 – 6.30 на границе макулы. Острота зрения вдаль 0.1, с коррекцией +1,0 дптр 0,5. С +3,5 дптр при хорошем освещении читает вблизи текст № 9.
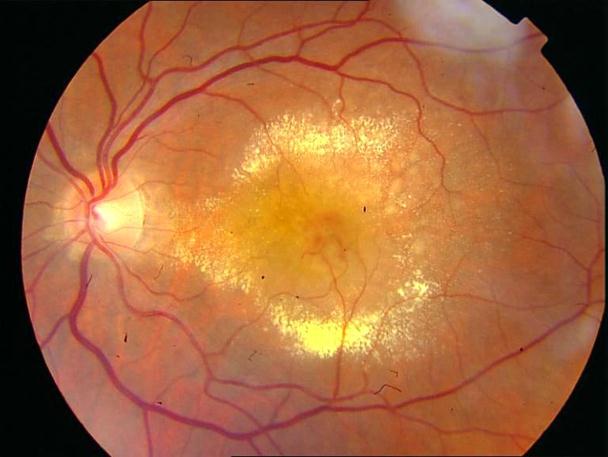
Рисунок 35. ФА этого же пациента. Множественные мелкие учатки гипо и гиперфлюоресценции в проекции друз. СНМ на 10.30 в фовеа-парафовеа. Участок гипофлюоресценции в области гиперпигментации хориоидеи. Проведена ФДТ с визудином. Через 2 недели острота зрения вдаль с коррекцией +1,0 дптр 0,9, читает текста № 3 с плюсовой коррекцией.
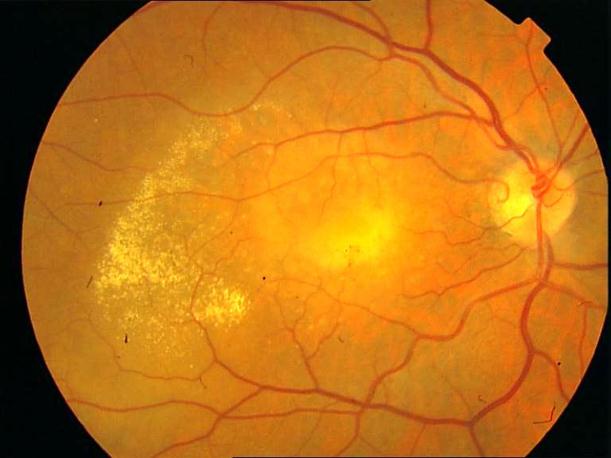
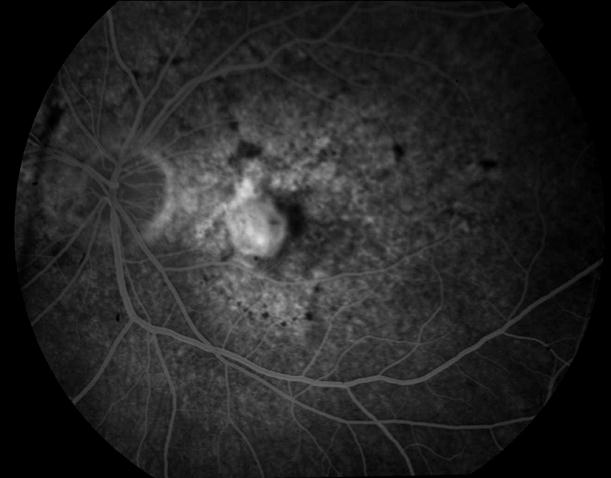
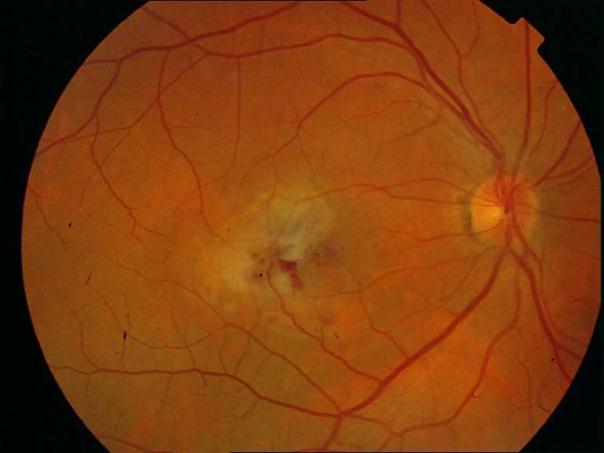
Рисунок 36. Картина глазного дна этого же пациента через 3 месяца после ФДТ. Жалобы на появление «пятна» перед глазом. Острота зрения вдаль с максимальной коррекцией 0,4, вблизи может прочитать текст №7, ощущает искажения.
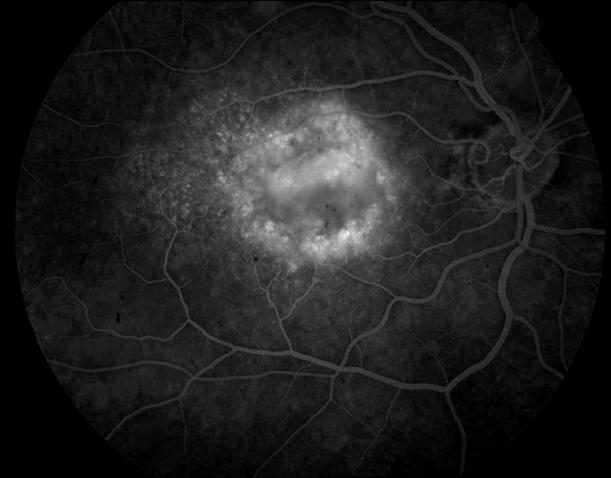
Рисунок 37. На ФА в фовеа видны два новых очага СНМ. Пролеченные ФДТ очаги СНМ, запустели. Выполнен повторный сеанс ФДТ. В течение 12 месяцев сохраняется зрение вдаль с максимальной коррекцией 0,5, вблизи при хорошем освещении читает текст № 5 (острота зрения 0,6).
Рисунок 38. Центральная хориоретинальная дистрофия, осложненная субретинальной неоваскулярной мембраной и интраретинальным кровоизлиянием. Острота зрения – сотые.
Рисунок 39. ФА этого больного в венозную фазу. ХНВ более 1 ДД в заднем полюсе.
Рисунок 40. Глазное дно этого больного через 3 месяца после ФДТ. Зрительные функции повысились, вдаль зрение до 0,3, но способности к чтению нет.
Рисунок 41. На ФА в фазу рециркуляции остатки неактивной СНМ. Показано консервативное лечение центральной хориоретинальной дистрофии, контроль состояния глазного дна и выполнение ФА (по показаниям) каждые 3 месяца. Состояние остается стабильным 12 месяцев.
Рисунок 42. Сенильная макулодистрофия, влажная форма с геморрагическим компонентом. Острота зрения 0,04.
Рисунок 43. На ФА у этого больного признаки скрытой ХНВ в наружной части макулы (35 секунда).
Рисунок 44. Со временем свечение в области ХНВ увеличивается (60 секунда). Показано консервативное лечение, направленное на поддержание трофических процессов в сетчатке, назначение кортикостероидов местно. Возможно проведение ФДТ. Прогноз неблагоприятный.
Рисунок 45. Исход СНМ в миопическом глазу. Интраретинальный, частично пигментированный рубец в фовеа (пятно Фукса). Остаточное центральное зрение.
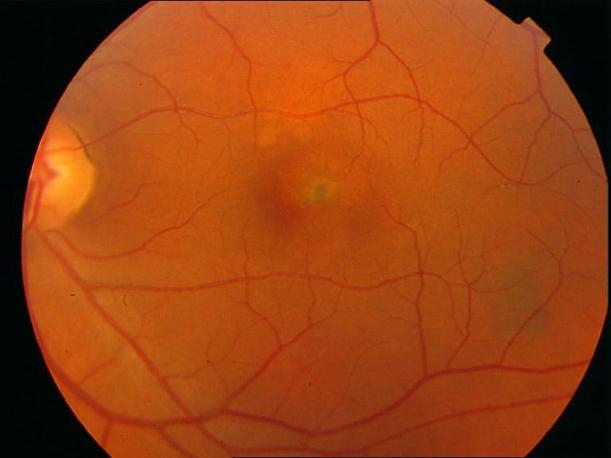
Рисунок 46. На фоне атрофических явлений в заднем полюсе пигментированный очаг в нижнее-внутреннем сегменте фовеа с интраретинальными кровоизлияниями по его краю.
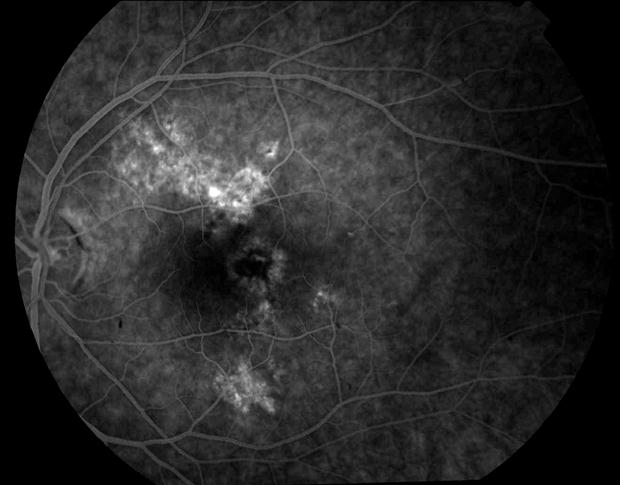
Рисунок 47. На ФА этого же больного признаки интраретинального рубца и скрытой СНМ. Показана консервативная ангиопротекторная и ферментная терапия. Эффективность ФДТ сомнительна. Острота зрения – сотые. Прогноз неблагоприятный.
Рисунок 48. Интраретинальный фиброз, кровоизлияния в макуле при естественном течении ХНВ на фоне СМД. Остаточная острота зрения. Лечебные мероприятия малоперспективны.
Рисунок 49. Обширная зона атрофии пигментного ретинального эпителия в заднем полюсе. По его краю в нижнее-наружной полусфере интраретинальный фиброз в исходе кровоизлияния. Острота зрения - сотые. Лечебные мероприятия малоперспективны.
Рисунок 50. В заднем полюсе виден интраретинальный очаг грязно-зеленого цвета и интраретинальные кровоизлияния вокруг него.
Рисунок 51. На ФА этого же больного определяется большой интраретинальный рубец, признаки скрытой ХНВ. Области гипофлюоресценции соответствуют интраретинальным кровоизлияниям. Показана консервативная ангиопротекторная и ферментная терапия. Эффективность ФДТ сомнительна. Острота зрения – сотые. Прогноз неблагоприятный.
Рисунок 52. Интраретинальный рубец в макулярной зоне. Интраретинальное кровоизлияние над нижнее височной веной.
Рисунок 53. Неоваскуляризация рубца на ФА у этого же пациента. ФДТ не показана.
Рисунок 54. Рубцовая форма СМД. Сетчатка в заднем полюсе резко утолщена, интраретинальный фиброз, интраретинальные кровоизлияния, твердые экссудаты по краю. Остаточная острота зрения. Лечебные мероприятия малоперспективны.
Рисунок 55. Фотография глазного дна пациента с жалобами на «пятно» перед глазом в течение 4 месяцев. Лечения не получал. Острота зрения 0,7. Коррекции не поддается. В фовеа темпоральнее фовеолярного рефлекса виден интраретинальный очаг с грязно зеленым оттенком и снижением плотности пигмента вокруг него. На 11 – 12 часах под уплотненной артерией видны хориоретинальные дистрофические очажки. На 4 – 4.30 парамакулярно определяется очаг гиперпигментации хориоидеи.
Рисунок 56. ФА этого же больного. Участки гиперфлюоресценции в заднем полюсе (дефекты пигментного эпителия сетчатки). В области фовеального очага и гиперпигментации хориоидеи определяются зоны гипофлюоресценции. Представлен случай самопроизвольного рубцевания субфовеальной СНМ. Больному показаны курсы тканевой, нейропротекторной терапии. Литература
1. Тhe Macular Photocoagulation Studу Group. Тhе use of fundus photographs and fluorescein angiograms in thе identification and treatment of choroidal neovascularization in thе Macular Photocoagulation Study. Ophthalmology 1989;96: 1526-1534. 2. Macular Photocoagulation Study Group. Subfoveal neovascular lesions in age-related macular degeneration. Guidelines for evaluation and treatment in the Macular Photocoagulation Study. Arch Ophthalmol 1991;109:1242-1257. 3. Macular Photocoagulation Study Group. Occult choroidal nеоvascularization. Influence оn visual outcome in patients with age-related macular degeneration. Arch Ophthalmol 1996; 114: 400-412. 4. Coscas G, Glaser B, Green WA. et al. Dégénerescences maculaires liées à l’âge et néovaisseaux rétiniens. Paris: Masson, 1991. 5. Gass JDM. Pathogenesis of disciform detachment of the neuroepithelium. IV. Fluorescein angiographic study of senile disciform macular degeneration. Аm J Ophthalmol 1967;63: 644-659. 6. Scheider А, Kaboth А, Neuhauser L. Detection of subrertinal nеоvascular membranes with indocyanine green and аnd infrared scanning laser ophthalmoscope. Аm J Ophthalmol 1992;113: 45-51. 7. Soubrane G, Arnold J, Quaranta М. Atteintes dégénératives de l'épithélium pigmentaire. In: Soubrane G, ed. Les affections acqиises de l'épithélium pigmeпtaire. Marseille: Fuery-Lamy, 1995: 169-204. 8. Treatment of Age-Related Macular Degeneration with Photodynamic Therapy (ТАР) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin. One-year results of 2 randomized clinical trials – TAP Report 1. Arch Ophthalmol 1999; 117: 1329-1345. 9. Patz A, Flover RW, Klein ML, et al. Clinical applications of indocyanine green angiography. Doc Ophthalmol Proc Series 1976;9:245-251. 10. Cherrick GR, Stein SW, Leevy CM, et al. Indocyanine green: observations on its physical properties, plasma decay. And hepatic extraction. J Clin Invest 1960;39:592. 11. Baker KJ. Binding of sulfobromophthalein (BSP) sodium and indocyanine green (ICG) by plasma al-lipiproteins. Proc Soc Exp Biol Med 1966;122:957. 12. Leevy CM, Bender J, Silverberg M, et al. Physiology of dye extraction by the liver: comparative studies of sulfobrophthalein and indocyanine green. Ann NY Acad Sci 1963;111:161. 13. Yannuzzi LA, Slakter JS, Sorenson JS, еt al. Digital indocyanine green videoangiography and choroidal neovascularization. Retina 1992; 12: 191-223. 14. Yannuzzi LA, Sorenson JS, Spaide RF еt al. Idiopathic polypoidal choroidal vasculopathy. Retina 1990;10:1-8. 15. Yannuzzi LA, Ciardella AP, Spaide RF, еt al. The expanding clinical spectrum of idiopathic polypoidal choroidal vasculopathy. Arch Ophthalmol 1999;115:478-485. 16. Kuhn D, Meunier I, Soubrane G, et al. Imaging а chorioretinal anastomoses in vascularized retinal pigment epithelium detachments. Arch Ophthalmol 1995; 113: 1392-1398. 17. Yannuzzi LA, Negrao S, Iida T, et al. Retinal angiomatous proliferation in age-related macular degeneration. Retina 2001;21:416-434. 18. Slakter JS, Yannuzzi LA,Scheider U, et al. Retinal choroidal anastomosis and occult choroidal neovascularization. Ophthalmology 2000;107:742-753. 19. Schwartz S, Guyer DR, Yannuzzi LA, et al. Indocyanine green videoangiography guided laser photocoagulation of primary occult choroidal neovascularization in age-related macular degeneration. Invest Ophthalmol Vis Sci 1995;36:186. 20. Guyer DR, Yannuzzi LA, Slakter JS, et al. Digital indocyanine-green videoangiography of occult choroidal neovascularizayion. Ophthalmology 1994;101:1727-1737. 21. Guyer DR, Yannuzzi LA, Slakter JS, et al. Classification of choroidal neovascularizayion by digital indocyanine green videoangiography. Ophthalmology 1996;103:2054-2060. 22. Giovanni А, Аmаto GP, Mariotti С, et al. ОСТ imaging of сhоroidal neovascularization and its role in thе determination of patients' eligibility for surgery. Br J Ophthalmol 1999;83:438-442. 23. Измайлов А.С., Балашевич Л.И. Хориоидальная неоваскуляризация (диагностика и лечение). С.-Петербург:СПбМАПО, 2001, C24-29. 24. Mainster M.A., Reichel E. Transpupillary thermotherapy for age-related macular degeneration: long-pulse photocoagulation, apoptosis, and heat shock proteins. Ophthalmic Surgery and Lasers 2000;vol. 31, № 5:359-373. 25. Thomas МА, Dickinson JD, Melberg NS, et аl. Visual results after surgical rеmоvаl оf subfoveal choroidal neovascular mеmbranes. Ophthalmology 1994;101:1384-1396. 26. Machemer R, Steinhorst UH. Retinal separation, retinotomy, and macular relocation, I: experimental studies in the rabbit еyе. Graefes Arch Clin Ехр Ophthalmol 1993;231:629-634. 27. Machemer R, Steinhorst UH. Retinal separation, retinortomy, and macular relocation II: surgical approach fоr age-related macular degeneration? Graefes Arch Clin Еxр Ophthalmol 1993;231:635-641. 28. Lindsey Р, Finkelstein D, D'Аnnа S. Experimental retinal rеlосаtion. ARVO аbstасts. Invest Ophthalmol Vis Sci 1983;24:242. 29. Tiedeman J, de Juan Е Jr, Machemer R, еt al. Surgical relocation оf the macula. ARVO abstracts. Invest Ophthalmol Vis Sci 1985;26:59. 30. Ninomiya Y, Lewis JM, Hasegawa Т, еt аl. Rerinotomy and fоvеаl translocation for surgical management оf subfoveal choroidal neovascular membranes. Аm J Ophthalmol 1996;I22:613-621. 31. Imai К, de Juan Е Jr. Experimental surgical macular relocation by scleral shortening. ARVO abstracts. Invest Ophthalmol Vis Sci 1996;37:S116. 32. de Juan Е Jr, Lowenstein А, Bressler NM, еt аl. Translocation оf the retina for management оf subfoveal choroidal neovascularization,II: а preliminary rероrt in humans. Аm J Ophthalmol 1998; 125:635-646. 33. Imai К, Loewenstein А, de Juan Е Jr. Translocation оf the retina for management оf subfoveal choroidal neovascularization. I: Experimental studies in the rabbit еуе. Аm J Ophthalmol 1998; 125:627-634. 34. Fujikado Т, Ohji M, Saito Y, еt аl. Visual function after Visual translocation with scleral shortening in patients with myopic neovascular maculopathy. Аm J Ophthalmol 1998; 125: 647-656. 35. Spikes J. Historical review. Photodynamic action: from paramecium to photochemotherapy. Photochem Photobiol 1997; 65S; 142S-147S. 36. Rabb C. Uber die Wirkung Fluroeszierenden Stoffe auf Infusoria. Z Biol 1900; 39:524-526. 37. von Tappeiner H, Jensionek A. Therapeutische Versuche mit fluorescierenden Stoffen. Munch Med Wochenshr 1903; 47:2042-2044. 38. Meyer-Betz F. Untersuchengen uber die biologische (photodynamische) Wirkung des Hamatopophyrins und anderer Derivative des Blut-und Gallenfarbstoffs. Dtsch Arch Klin Med 1913;112: 476-503. 39. Lipson R, Blades E. The photodynamic properties of a particular hematoporphyrin derivative. Arch Dermatol 1960; 82:508-516. 40. Diamond I, McDonagh A, Wilson C, et al. Photodymanic therapy of malignant tumors. Lancet 1972; 2: 1175-1177. 41. Dougherty T, Grindley G, Fiel R, et al. Photradiation therapy II: cure of animal tumors with hematoporphyrin derivative and light. J Natl Cancer Inst 1975; 55: 115-121. 42. Dougherty T, Lawrence G, Kaufman J, et al. Photoradiation in the treatment of recurrent breast carcinoma. J Natl Cancer Inst 1979; 62: 231-237. 43. Dougherty T. Photosensitization of malignant tumors. Semin Surg Oncol 1986; 2: 24-37 44. Weishaupt K, Gomer C, Dougherty T. Identification of singlet oxygen as the cytotoxic agent in photo-inactivation of murine tumor. Cancer Res 1976; 36: 2326-2329. 45. Buettner G, Oberly L. The apparent production of superoxide and hydroxyl radicals by hematoporphyrin and light as seen by spin-trapping. Fed Biol Sci Letts 1980; 121: 161-164. 46. Svaasand L, Ellingson R. Optical properties of human brain. Photochem Photbiol 1983; 38: 283-289. 47. Hasan T, Parish J. Photodynamic therapy of cancer. In: Holland JEA, ed. Cancer Medicine, vol 1, 4th ed. Baltimore: Williams & Wilkins, 1997: 739-751. 48. Figge F, Weiland G, Manganiello L, et al. Cancer detection and therapy. Affinity of neplastic, embryonic and traumatized tissues for porphyrins and metalloporphyrins. J Proc Soc Exp Biol Med 1948; 68: 640-641. 49. Jori G, Tomio L, Reddi E, et al. Rreferential delivery of liposomeincorporated porphyin to neoplastic cells in tumour-bearing rats. Br J Cancer 1983; 48: 307-309. 50. Allison BA, Watefield E, Richter AM, et al. The effects of plasma lipoproteins on in vitro tumor cell killing and in vivo tumo photosensitization with benzoporphtrin derivative. Photochem Ptotobiol 1991; 54: 709-715. 51. Jori G. Low Density Lipoprotein-liposome delivery system for tumor photodynamic therapy: basic principles and clinical applications. New York: Marcel Dekker, 1992: 173-186. 52. Kessel D. Porphyrin-lipoprotein association as a factor in porphyrin localization. Cancer Letts 1986; 33: 183-188. 53. Jiang F, Allison B, Liu D, Levy J. Enhanced photodynamic killing of target cells by either monoclonal antibody of low density lipoprotein mediated delivery systems. J Contolled Rel 1992; 19: 41-58. 54. Renno RZ. Miller JW. Photosensitizer delivery for photodynamic therapy of choroidal neovascularization. Adv Drug Deliv Rev 2001; 52: 63-78. 55. Kessel D, Luo Y. Mitochondrial photodamage and PDT-induced apoptosis. J Photchem Photobiol B Biol 1998; 42: 89-95. 56. Fingar V. Vascular effect of photodynamic therapy. J Clin Laser Med Surg 1996; 14: 323-328. 57. Miller H, Miller B. Photodynamic therapy of subretinal neovascularization in the monkey eye. Arch Ophthalmol 1993; 111: 855-860. 58. Miller JW, Walsh AW, Kramer M, et. Al. Photodynamic therapy of experimental choroidal neovascularization using lipoprotein-dilivered benzoporphyrin. Arch Ophthalmol 1995; 113: 810-818. 59. Kramer M, Miller J, Michaud N, et al. Liposomal BPD verteporfin photodynamic therapy: selective treatment of choroidal neovascularization in monkeys. Ophthalmology 1996; 103: 427-438. 60. Moulton RS, Walsh AW, Miller JW, et al. Response of retinal and choroidal vessels to photodynamic therapy using benzoporphyrin derivative monacid. Invest Ophthal Vis Sci 1993; 34: 1169. 61. Husain D, Miller J, Michaud N, et al. Intravenous infusion using liposomal benzoporphyrin derivative verteporfin for photodynamic therapy of experimental choroidal neovascularization. Arch Ophthalmol 1996; 114: 978-985. 62. Mori K, Ohta M, Katagiri T. Photodynamic therapy (PDT) with a combination of a new photsensitizer: NPe6 and a diode laser emitting at 664 nm. Invest Ophtahal Vis Sci 1996; 37: S3177. 63. Miller J, Schmidt-Erfurth U, Sickenberg M, et al. Photodynamic therapy with verteporfin for choroidal neovascularization caused by age-related macular degeneration. Results of a single treatment in a Phase 1 and 2 study. Arch Ophthalmol 1999; 117: 1161-1173. 64. Arbour J, Connolly E, Palmer J, et al. Digital angiography of CNV in the monkey using benzoporphyrin. Phthalocyanine, and rose Bengal. Invest Ophthal Vis Sci 1998; 39; S590. 65. Graham K, Arbour J, Connolly E, et al. Digital angiography using lutetium texaphyrin in a monkey model of choroidal neovascularization. Invest Ophthal Vis Sci (ARVO Abstract) 1999; 40: S402. 66. Kramer M, Kenney A, Delori F, et al. Imaging of experimental choroidal neovascularization (CNV) using liposomal benzoporphyrin derivative monoacid (BPD-MA) angiography. Invest Ophthal Vis Sci 1995; 36:S236. 67. Blumenkranz M, Woodburn K, Verdooner S. Lutex texaphyrin angiography: a new method for the evaluation and treatment of retinal and choroidal vascular disorders. Invest Ophthal Vis Sci 1998; 36: S468. 68. Bonnet R, Ridge R, Scourides P, et al. On the nature of hematoporphyrin derivative. J Chem. Soc Perkins Trans 1981; 1: 3135-3140. 69. Davidorf J, Davidorf F. Treatment of iris melanoma with photodynamic therapy. Ophthal Surg 1992; 23: 522-527. 70. Nelson J, Roberts W, Berns MW. In vivo studies on the utilization of mono-l-aspartyl chlorin (NPe6) for photodynamic therapy. Cancer Res 1987; 47: 4681-4685. 71. Schuitmaker J, van Best J, van Delft J, et al. Bacteriochlorin a, a new photosensitizer in photodynamic therapy. Invest Ophthal Vis Sci 1990; 31: 1444-1450. 72. Richter AM, Watefield E, Jain AK, et al. Photosensitising potency of structural analogues of benzoporhyrin derivative (BPD) in a mouse tumour model. Br J Cancer 1991; 63: 87-93. 73. Treatment of Age-related Macular Degeneration with Photodynamic Therapy (TAP) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin. Two-year vision results of two randomized clinical trials. Arch Ophthalmol 2001; 119:198-207. 74. Baumal C, Puliafito C, Piieroth L, et al. Photodynamic therapy (PDT) of experimental choroidal neovascularization with tin ethyl etiopurpurin. Invest Optthal Vis Sci 1996; 37:S122. 75. Obana A, Gohto Y, Miki T, et al. Photodynamic therapy of choroidal vessels using a newly developed chlorin derivative (ATX-S10). Invest Ophthal Vis Sci 1996; 37:S549. 76. Kreimer-Birnbaum M. Modified porphyrins, chlorines, phthalocyanines, and purpurins: second-generation photosensitizers for photodynamic therapy. Semin Hematol 1989; 26: 157-173. 77. Morgan A, Skalkos D. Second generation sensitizers: where are we and where are we and where should we be going? Proc SPIE 1990; 6:87-106. 78. Kliman G, Puliafito C, Stern D, et al. Phthalocyanine photodynamic therapy: new strategy for closure of choroidal neovascularization. Lasers Surg Med 1994; 15: 2-10. 79. Miller JW, Stinson WG, Gregory WA, et al. Phthalocyanine photodynamic therapy of experimental iris neovascularization. Ophthalmology 1991; 98: 1711-1719. 80. Panagopoulos JA, Svitra PP, Puliafito CA, et al. Photodynamic therapy for experimental intraocular melanoma using chloraluminum sulfonated phthalocyanine. Arch Ophthalmology 1989; 107: 892-897. 81. Young S, Woodburn K, Wright M, et al. Lutetium texaphyrin (PCI-0123): a near-infrared, water-soluble photosensitizer. Photochem Photobiol 1996; 63: 892-897. 82. Woodburn K, Fan Q, Kessel D, et al. Phototherapy of cancer and atheromatous plaque with texaphyrins. J Clin Laser Med Surg 1996; 14: 343-348. 83. Woodburn K, Fan Q, Miles D, et al. Localization and efficacy analysis of the phototherapeutic lutetium texaphyrin (PCI-0123) in the murine EMT6 sarcoma model. Photochem Photobiol 1997; 65: 410-415. 84. Arbour J, Graham K, Carson D, et al. Photodynamic therapy of experimental choroidal neovascularization in a monkey model using intravenous infusion of lutetium texaphyrin. Invest Ophthalmol Vis Sci (ARVO Abstract)1999; 40: S401. 85. Blumenkranz MS, Woodburn KW, Qing F, et al. Lutetium texaphyrin (Lutex): a potential new agent for ocular fundus angiography and photodynamic therapy. Am J Ophthalmol Mar 2000;129: 353-362. 86. Yoshikawa K, Kurata H, Iwahara S, et al. Photodynamic action of fluorescein dyes in DNA-damage and in vitro inactivation of transforming DNA in bacteria. Mutat Res 1978; 56: 359-362. 87. Gandin E, Lion Y, Van De Vorst A, et al. Quantum yield of singlet oxygen production by xanthene derivatives. Photochem Photobiol 1983; 37: 271-278. 88. Nanda S, Hatchell D, Tiedeman J, et al. A new method of vascular occlusion. Arch Ophthalmol 1987; 105: 1121-1124. 89. Wilson C, Hatchell D. Photodynamic retinal vascular throbosis. Invest Ophthal Vis Sci 1991; 32: 2357-2365. 90. Royster A, Nanda S, Hatchell D, et al. Photochemical initiation of thrombosis. Arch Ophthalmol 1988; 106: 1608-1614. 91. Tse D, Dutton J, Weingeist T, et al. Hematoporphyrin photoradiation therapy for intraocular and orbital malignant melanoma. Arch Ophthalmol 1984; 102: 833-838. 92. Sery T, Shields J, Augsburger J, et al. Photodynamic therapy of human ocular cancer. Ophthal 1987; 18: 413-418. 93. Chambers R, Arnson D, Davidorf F, et al. Treatment of iris melanoma with dehermatoporphyrin ether and an ophthalmic laser delivery system. Contemp Ophthal For 1986; 4: 70-84. 94. Lewis R, Tse D, Phelphs C, et al. Neovascular glaucoma after photoradiation therapy for uveal melanoma. Arch Ophthalmol 1984; 102: 839-842. 95. Gomer CJ, Jester JV, Razum NJ, et al. Photodynamic therapy of intraocular tumors: examination of hematoporphyrin derivative distribution and long-term damage in rabbit ocular tissue. Cancer Res 1985; 45: 3718-3725. 96. Sery T, Dougherty T. Photoradiation of rabbit ocular malignant melamona sensitized with hematopophyrin derivative. Curr Eye Res 1984; 3: 519-528. 97. Franken K, van Delft J, Dubelman T, et al. Hematoporphyrin derivative photoradiation treatment of experimental malignant melanoma in the anterior chamber of the rabbit. Curr Eye Res 1985; 4: 641-654. 98. Gomer C, Murphree A, Doiron D, et al. Preclinical evaluation of ocular photoradiation therapy. Paper presented at: Proceedings of the international symposium on porphyrins in tumor phototherapy, New York, 1984. 99. Liu H, Chuo N. Hematoporphyrin phototherapy for experimental intraocular malignant melanoma. Arch Ophthalmol 1983; 101: 901-903. 100. Franken N, Vrensen G, van Delft J, eta al. Early morphological changes induced by photodynamic therapy in amelanotic Greene melanoma implanted in the anterior eye chamber of rabbits. Laser Surg Med 1988; 3: 27-34. 101. Schmidt-Erfurth U, Flotte T, Gragoudas ES, et al. Benzoporphyrin-lipoprotin-mediated photodestruction of intraocular tumors. Exp Eye Res 1996; 62:1-10. 102. Bruce RJ. Evaluation of hematoporphyrin photoradiation therapy to treat choroidal malamoma. Sasers Surg Med 1984; 4: 59-64. 103. Bruce RJ. Photoradiation therapy for choroidal malignant melamoma. In: Mc Caughan JJ, ed. A clinical manual: photodynamic therapy of malignancies. Austin: RG Landes, 1993. 104. Muphree A, Cote M, Gomer C, The evolution of photodynamic therapy techniques in the treatment of intraocular tumors. Photochem Photobiol 1987; 46: 919-923. 105. Favilla I, Barry W, Gosbell A, et al. Phototherapy of posterior uveal melanomas. Br J Ophthalmol 1991; 75: 718-721. 106. Lingua R, Parel J. Photodynamic therapy for ocular tumors. J Phototchem Photobiol B Biol 1991: 119-122. 107. Schmidt-Erfurth U, Bauman W, Gragoudas E, et al. Photodynamic therapy of experimental choroidal melanoma using lipoprotein-delivered benzoporphyrin. Ophthalmology 1994; 101: 89-99. 108. Gomzalez V, Hu L, Theodossiadis P, et al. Photodynamic therapy of pigmented choroidal melanomas. Invest Ophthal Vis Sci 1995; 36: 871-878. 109. Phillips A, Browne B, Allan D. Haematoporphyrin photosensitization treatment of experimental choroidal melanoma. Eye 1987; 1: 680-685. 110. Ozler S, Nelson S, Liggett P, et al. Photodynamic therapy of experimental subchoroidal melanoma using cholraluminum sulfonated phthalocyanine. Arch Ophthalmol 1992; 110: 555-561. 111. Young L, Howard M, Hu L, et al. Photodynamic therapy of pigmented choroidal melanomas using a liposomal preparation of benzoporphyrin derivative. Arch Ophtalmol 1996; 114: 186-192. 112. Hu L, Huh K, Foster S, et al. Photodynamic therapy of pigmented choroidal melanomas in a rabbit model. Retina 1994; 14: 264-269. 113. Kim R, Hu L, Foster S, et al. Photodynamic therapy of pigmented choroidal melanomas of greater than 3 mm thichness. Ophthalmology 1996; 103: 3029-2036. 114. Ohnishi Y, Yamana Y, Minei M. Photoradiation therapy using argon laser and a hematoporphyrin derivative for retinoblastoma: a preliminary report. Jpn J Ophthalmol 1986; 30: 409-419. 115. Murphree A. Retionblastoma. In: Ryan S, Ogden T, eds. Retina, vol 1. St Louis: CV Mosby, 1989:544. 116. White L, Gomer C, Doiron D, et al. Ineffective photodynamic therapy (PDT) in a poorly vascularized xenograft model. Br J Cancer 1988; 57: 455-458. 117. Winther J, Porphyrin photodynamic therapy in an experimental retinoblastoma model. Ophthal Paedatr Gen 1987; 8: 49-52. 118. Winther J, Ehlers N. Histopathological changes in an intraocular-like tumour following photodynamic therapy. Acta Ophthalmol 1988; 66: 69-78. 119. Winther J, Overgaard J, Photodynamic therapy of experimental intraocular retinoblastoma: dose-response relationships to light energy and photofrin II. Acta Ophthalmol 1989; 67: 44-50. 120. Epstein R, Hendricks R, Harris D. Photodynamic therapy of corneal neovascularization. Cornea 1991; 10: 424-432. 121. Pallikaris I, Miltiades M, Iliaki O, eta al. Effectiveness of corneal neovascularization photothrombosis using phthalocyanine and a diode laser (675 nm). Lasers Surg Med 1993; 13: 197-203. 122. Tsilimbaris M, Pallikaris I, Naoumidi I, et al. Phthalocyanine mediated photodynamic thrombosis of expimental corneal neovascularization: effect of phthalocyanine dose and irradiation onset time on vascular occlusion rate. Lasers Surg Med 1994; 15: 19-31. 123. Gohto Y, Obana A, Kanai M, et al. Photodynamic therapy for corneal Neovascularization using topically administered ATX-S10 (Na). Ophthal Surg Lasers 2000; 31: 55-60. 124. Gohto Y, Obana A, Kanai M, et al. Treatment parameters for selective occlusion of experimental corneal neovascularization by photodynamic therapy using a water soluble photosensitizer, ATX-S10 (Na). Exp Eye Res 2001; 72: 13-22. 125. Schmidt-Errurth U, Hasan T, Schomacker K, et al. In vivo uptake of liposomal benzoporphyrin derivative and photothrombosis in experimental corneal neovascularization. Lasers Surg Med 1995; 17: 178-188. 126. Virdi PS, Hayreh SS. Ocular neovascularization with retinal vascular occlusion. I. Association with experimental retinal vein occlusion. Arch Ophthalmol 1982; 100: 331-341. 127. Miller JW, Adamis AP, Shima D, et al. Vascular endothelial growth factor/vascular permeability factor is temporally and spatially correlated with ocular angiogenesis in a primate model. Am J Pathol 1994; 145: 574-584. 128. Packer AJ, Tse DT, Gu X-Q, et al. Hematoporphyrin photoradiation therapy for iris neovascularization. A preliminary report. Arch Ophthalmol 1984; 102: 1193-1197. 129. Husain D, Miller J, Kenney A, et al. Photodynamic therapy and digital angiography of experimental iris neovascularization using liposomal benzoporphyrin derivative. Ophthalmology 1997; 104: 1242-1250. 130. Muller V, Ruokonen P, Schellenbeck M, et al. Treatment of rubeosis iridis with photodynamic therapy with verteporfin: a new therapeutic and prophylactic option for patients with the risk of neovascular glaucoma? Ophthal Res 2003; 35: 60-64. 131. Thomas EL, Langhofer M. Closure of experimental subretinal neovascular vessels with dihematoporphyrin either augmented argon green laser photocoagulation. Photobiol 1987; 46:881-886. 132. Тахчиди Х.П., Белый Ю.А., Терещенко А.В. и др. Экспериментальные результаты фотодинамической терапии в офтальмологии с использованием отечественных препаратов хлоринового ряда. Офтальмохирургия 2005; № 2: 30 -35. 133. Белый Ю.А., Семенов А.Д., Володин П.Л. и др. Фотодинамическая терапия (ФДТ) экспериментально-индуцированной хориоидальной неоваскуляризации с использованием отечественного препарата «Фотодитазин». VIII Съезд офтальмологов России. Тезисы докладов. Москва; 1 – 4 июля 2005г.: 376. 134. Володин П.Л. Экспериментальное изучение порогов фотодинамического повреждения сетчатки и хориоидеи с использованием отечественного фотосенсибилизатора «Фотодитазин». VIII Съезд офтальмологов России. Тезисы докладов. Москва; 1 – 4 июля 2005г.: 382. 135. Воронцов Г.Н., Кузьмин С.Г., Ермакова Н.А. и др. Использование Фотосенса и лазерно-спектроскопического комплекса для диагностики и фотодинамической терапии субретинальных мембран. VIII Съезд офтальмологов России. Тезисы докладов. Москва; 1 – 4 июля 2005г.: 384. 136. Moulton RS, et al. Response of retinal and choroidal vessels to photodynamic therapy using benzoporphyrin derivative monoacide. Invest Ophthalmol Vis Sci 1993;34:1169A. 137. Husain D, Kramer M, Kenny AG, et al. Effects of photodynamic therapy using verteporfin on experimental choroidal neovascularization and normal retina and choroids up to seven weeks after treatment. Invest Ophthalmol Vis Sci 1999;40:2322-2331. 138. Schmidt-Егfuth U, Miller JW, Sickenberg М, et al. Photodynamic thеrаpy with vеrtерогfin for choroidal neovascularization caused bу age-related macular degeneration: results of retreatments in а phase 1 and 2 studу. Arch Ophthalmol 1999;117: 1177-1187. 139. Treatment of Age-Related Macular Degeneration with Photodynamic Therapy (ТАР) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin. Two-year results of 2 randomized clinical trials – TAP Report No. 2. Arch Ophthalmol. (in press), 2000. 140. Тreatment of Age-related Macular Degeneration with Photodynamic Therapy (ТАР) Study Group. Verteporfin (Visudyne) therapy of subfoveal choroidal neovascularization in patients with age-related macular degeneration: Additional information regarding baseline lesion composition's impact оп vision outcomes-TAP Report No. 3. Аrch Ophthalmol 2002;120:1443-1454. 141. Vеrtерогfin in Рhоtodynamic Therapy Studу Group. Verteporfin therapy of subfoveal choroidal neovascularization in age-related macular degeneration: two year results of а randomized clinical trial including lesions with occult,with nо classic choroidal nеоvascularization. Аm J OphthalmoI 2001; 131:541-560. 142. Verteporfin in Photodynamic Therapy (VIP) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in pathologic myopia with verteporfin: one-year results of а randomized clinical trial. Ophthalmology 2001;108:841-852. ОБЩАЯ ИММУНОЛОГИЯ Дата добавления: 2014-12-12 | Просмотры: 1412 | Нарушение авторских прав |