|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
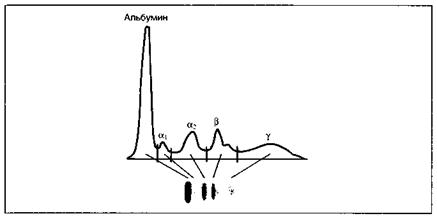
Электрофорез1. Зональный электрофорез — полуколичественный метод, позволяющий разделить смесь белков в зависимости от их молекулярной массы и электрического заряда. Суть метода заключается в следующем: исследуемую смесь белков на носителе (например, пластине с гелем) помещают в камеру для электрофореза, заполненную буферным раствором и подключенную к источнику постоянного тока. При электрофорезе белков сыворотки обычно получается 5 основных полос, которые соответствуют фракциям альбумина, а, а2, β- и γ -глобулинов (рис. 19). Иммуноглобулины мигрируют преимущественно во фракцию γ-глобулинов. Относительное содержание каждой фракции сывороточных белков можно оценить с помощью денситометра. С помощью зонального электрофореза можно исследовать не только сыворотку, но и другие биологические жидкости, например спино-мозговую жидкость и мочу. Этот метод позволяет оценить белковый состав исследуемой пробы и выявить моноклональные антитела.
Рис. 19. Зональный электрофорез нормальной сыворотки. На электрофореграмме и денситограмме нормальной сыворотки видны пять основных полос, которые соответствуют альбумину, а, а2, β- и γ - глобулинам
2. Иммуноэлектрофорез. Суть метода заключается в следующем: I) проводят электрофоретическое разделение белков в геле; 2) по окончании электрофореза в геле параллельно направлению электрофореза вырезают бороздки; 3) в бороздки вносят антитела (антисыворотку), например к тяжелым или легким цепям иммуноглобулинов. Эти антитела и разделенные при электрофорезе белки диффундируют навстречу друг другу. В тех местах, где антитела связываются с белками, образуются дуги преципитации. Иммуноэлектрофорез позволяет оценить лишь качественный состав исследуемой смеси белков. Оценка результатов исследования требует высокой квалификации. Чаще всего этот метод применяется для выявления и характеристики моноклональных антител. 3. Электрофорез с иммунофиксацией. Этот метод основан на электрофоретическом разделении белков сыворотки в геле с последующей инкубацией геля в присутствии антител к тяжелым и легким цепям иммуноглобулинов. При связывании белков с антителами образуются иммунные комплексы, которые можно увидеть после окрашивания. Иммунные комплексы, содержащие нормальные иммуноглобулины откладываются в виде широкой, размытой полосы, моноклональные — в виде более узкой и четко очерченной. Этот метод также является качественным, однако более чувствителен и прост, чем иммуноэлектрофорез. Электрофорез с иммунофиксацией часто применяется в сочетании с иммуноэлектрофорезом для определения моноклональных или олигоклональных иммуноглобулинов.
Рис. 20. Иммуноэлектрофорез сыворотки здорового (3) и больного с моноклональной гаммапатией (Б), сопровождающейся повышением уровня γ - и к- цепей. Антитела к γ - и к-цепям образуют более широкие дуги преципитации с сывороткой больного, чем с сывороткой здорового (Г. Лолор, Т. Фишер, 2000).
Рис. 21. Электрофорез с иммунофиксацией (нормальная сыворотка). На полосках геля видны размытые полосы преципитации, соответствующие тяжелым (γ, a и m) и легким (к и l) цепям иммуноглобулинов. Тяжелые и легкие цепи моноклональных иммуноглобулинов откладываются в виде более узких и четко очерченных полос (на рисунке не показано). Контроль — электрофорез нормальной сыворотки без иммунофиксации (Г. Лолор, Т. Фишер, 2000).
Б. Двойная радиальная иммунодиффузия — полуколичественный метод, с помощью которого можно не только выявить антигены, но и оценить степень сходства между ними. Суть метода заключается в следующем: 1) в лунки, вырезанные в агаре, вносят исследуемую смесь антигенов и антитела с известной специфичностью (обычно в центральную лунку вносят антитела, а в расположенные вокруг нее — антигены); 2) антигены и антитела диффундируют по направлению друг к другу; 3) в том месте, где произошло связывание антител и антигенов, образуются полосы преципитации. По взаимному расположению и форме полос преципитации можно оценить степень сходства между антигенами, находящимися в соседних лунках. В настоящее время этот метод применяется в диагностике аутоиммунных заболеваний для выявления аутоантител к экстрагируемым ядерным антигенам. Хотя по чувствительности метод двойной радиальной иммунодиффузии уступает многим количественным методам, технически он прост, не требует высокоочищенных антител, специфичен и может использоваться при проведении массовых исследований. В. Простая радиальная иммунодиффузия позволяет количественно определить содержание антигена в исследуемой пробе. Суть метода заключается в следующем. В слое агара, содержащего антитела, вырезают лунки, в одни из которых вносят исследуемый антиген, в другие — стандартный. Антигены диффундируют из лунок в агар, образуя радиальные зоны преципитации. Диаметр зоны преципитации пропорционален концентрации антигена. Это простой и надежный метод количественной оценки иммуноглобулинов (включая подклассы IgG), компонентов комплемента (например, СЗ, С4, фактора В) и других белков сыворотки. Существуют готовые наборы, позволяющие определить антиген в низкой концентрации — не более 3 мкг/мл. Определяя содержание иммуноглобулинов, необходимо учитывать, что изменение их свойств может искажать результаты исследования. Так, если в сыворотке содержатся мономерные IgM (например, при макроглобулинемии Вальденстрема, атаксии-телеангиэктазии), уровень IgM будет искусственно завышен, поскольку мономерный IgM диффундирует быстрее, чем пентамерный. Присутствие ревматоидного фактора в исследуемой пробе, напротив, искусственно снижает уровень IgG, поскольку иммунные комплексы, состоящие из IgG и ревматоидного фактора, диффундируют медленнее, чем несвязанный IgG. Сыворотка многих больных с дефицитом IgA содержит антитела к белкам животного происхождения, например к козьим иммуноглобулинам, поэтому при использовании козьих антител для определения уровня IgA в этом случае получаются завышенные результаты. Техника реакции: Разведение (титр) моноспецифической антисыворотки. которое обеспечивает четкое кольцо преципитации со стандартной сывороткой, указывается предприятием-изготовителем. При этом разведение моноспецифических сывороток подбирают таким образом, чтобы с цельной стандартной англобулиновой сывороткой формировалось кольцо: диаметром 11 – 12 мм с анти-lgA-сывороткой 8 – 9 мм и анти-lgM-сывороткой – 6 – 7 мм. В каждой серии опытов стандартную моноспецифическую сыворотку с известным содержанием иммуноглобупинов испытывают в разведениях 1:2, 1:4, 1:8, цельная. Приготовленный 2% агар на буфере перед опытом растапливают на кипящей бане, затем помещают в термостат при 48°С. Количество агара, необходимое для одного стекла рассчитывают таким образом, чтобы толщина застывшего слоя была 1 – 2 мм. Моноспецифические сыворотки разводят тем же буферным раствором из расчета вдвое меньше указанных титров и нагревают на водяной бане до 50°С, После этого разведения антисыворотки тщательно смешивают с агаром в равном объеме. Смесь агара с антисывороткой разливают на предварительно подогретые стекла, лежащие строго горизонтально. После застывания агара в нем металлическим штампом с внутренним диаметром 2 мм выбивают лунки на расстоянии 1 – 1,5 см друг от друга. Четыре первые лунки заполняют сывороткой в различных разведениях (цельная, 1:2, 1:4, 1:8), в остальные вносят испытуемые сыворотки. Во избежание ошибок при учете результатов лунки заполняют очень аккуратно с помощью микрошприца или капилляра. Стекла помещают во влажную камеру при комнатной температуре. Учет результатов проводят через 24 часа для иммуноглобулинов G и А, через 48 часов для IgM. Учет реакции: По окончании времени реакции измеряют диаметры образовавшихся колец преципитации. На графике по оси ординат откладывают квадраты радиусов колец преципитации, а по оси абсцисс – известное количество иммуно-глобулинов (г/л), содержащихся в эталонной сыворотке соответствующего разведения. Полученные точки соединяют прямой. Содержание иммуноглобулинов в испытуемом образце определяют по построенной прямой, отдельной для каждого класса иммуноглобулинов. Г. Нефелометрия — определение концентрации взвешенных частиц и высокомолекулярных веществ в растворе, основанное на оценке интенсивности рассеяния света, проходящего через этот раствор. Нефелометрия может быть использована для определения концентрации антигенов, поскольку при добавлении к ним антител образуются иммунные комплексы, рассеивающие проходящий свет. Нефелометрия позволяет с высокой точностью определить концентрацию IgG, IgA, IgM, подклассов IgG, СЗ, С4, фактора В, С-реактивного белка и некоторых других сывороточных белков. Этот метод подходит для определения белков в низкой концентрации, например IgE, уровень которого в сыворотке не превышает 1 мкг/мл. В настоящее время многие лаборатории используют нефелометрию в качестве стандартного метода количественного определения иммуноглобулинов. Д. Радиоиммунный анализ. Этот высокочувствительный метод разработан более 30 лет назад и сначала использовался для определения концентрации инсулина и других гормонов. Сейчас он используется и для определения антигенов и антител. Существует несколько модификаций метода. Одна из них основана на конкурентном связывании меченного радиоактивным изотопом и немеченого антигена с антителами. Суть метода заключается в следующем: 1) известное количество антител смешивают с известным количеством меченого антигена и исследуемой пробой (содержащей неизвестное количество антигена); 2) антиген, содержащийся в пробе, и стандартный меченый антиген связываются с антителами; 3) чем выше содержание немеченого антигена, тем меньше меченого антигена свяжется с антителами. Концентрацию антигена в исследуемой пробе оценивают по уровню радиоактивности иммунных комплексов. Тот же подход может быть использован для определения концентрации антител в пробе. В этом случае известное количество антигена смешивают с известным количеством стандартных меченых антител и исследуемой пробой (содержащей неизвестное количество антител). Другая модификация метода основана на иммобилизации антигена или антитела на твердой подложке. Основные недостатки метода — необходимость дорогостоящего оборудования и реактивов, а также условий для работы с радиоактивными изотопами. Е. Твердофазный иммуноферментный анализ. В качестве твердой фазы чаще всего используются полистироловые планшеты с сорбированными на них антигенами или антителами. Определение антител к какому-либо антигену проводят следующим образом: 1) исследуемую жидкость вносят в лунки планшета с сорбированным на них антигеном; 2) во время инкубации антитела связываются с антигеном; 3) планшет отмывают от несвязавшихся антител и добавляют антитела к иммуноглобулинам (вторые антитела), меченные ферментом; 4) планшет вновь отмывают, добавляют субстрат фермента и хромоген (вещество, меняющее окраску в процессе химической реакции); 5) под действием продукта ферментативной реакции хромоген меняет окраску. Чем больше меченных ферментом вторых антител связывается с комплексами антиген—антитело, тем выше активность фермента и интенсивность окраски раствора. Концентрацию антител в пробе определяют спектрофотометрически — по оптической плотности окрашенного раствора. Такой же подход применяется для определения антигена в пробе. В этом случае используются планшеты с сорбированными антителами к исследуемому антигену, меченные ферментом вторые антитела также направлены к этому антигену (рис. 20.5). Твердофазный иммуноферментный анализ применяют для количественной оценки антител и антигенов. По чувствительности он сопоставим с радиоиммунным анализом, но более прост, дешев и не требует применения радиоактивных изотопов. Многие лаборатории используют твердофазный иммуноферментный анализ в качестве стандартного метода определения противовирусных антител, включая антитела к ВИЧ, цитокинов и иммуноглобулинов (IgE и подклассов IgG).
Рис. 22. Твердофазный иммуноферментный анализ. А. Определение антител. Б. Определение антигенов. При радиоиммунном анализе в качестве метки используется радиоактивный изотоп, при иммунофлюоресцентном анализе — флюорохром (Г. Лолор, Т. Фишер, 2000).
Дата добавления: 2014-12-12 | Просмотры: 1854 | Нарушение авторских прав |