 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
РАБОТА 5ОСМОС Явление осмоса и осмотическое давление играют исключительно важную роль в процессах регуляции биологических систем. Осмотическое давление – один из факторов, регулирующих состав крови и других жидкостей в организме. Осмос – диффузия растворителя через полупроницаемую перегородку (мембрану) из растворителя в раствор или из раствора с меньшим осмотическим давлением в раствор с большим осмотическим давлением. Осмотическим давлением называют силу, приходящуюся на единицу площади, под действием которой осуществляется этот перенос растворителя. Для разбавленных растворов неэлектролитов осмотическое давление связано с концентрацией согласно закону Вант-Гоффа:
где С – молярная концентрация раствора, моль/л, Т – температура, К, R – универсальная газовая постоянная, равная 8,31 Для разбавленных растворов электролитов в выражение для осмотического давления включается изотонический коэффициент i:
Изотонический коэффициент показывает, во сколько раз увеличивается число частиц растворенного вещества в результате диссоциации. Для растворов электролитов i>1. Определяя в эксперименте осмотическое давление растворов электролитов, можно найти степень диссоциации
В случае сильных электролитов эта величина является кажущейся степенью диссоциации. В настоящее время установлено, что сильные электролиты в растворах диссоциируют практически нацело. Однако в эксперименте, в частности при измерении осмотического давления, вычисленное значение оказывается меньше 1 (100 %), что объясняется наличием взаимодействий ионов между собой и с молекулами растворителя. Растворы, у которых осмотическое давление одинаково, называются изотоническими. При их контакте через полупроницаемую мембрану осуществляется равновесный обмен молекулами растворителя. Если в контакте находятся два раствора с разным осмотическим давление, то раствор с большим осмотическим давлением называется гипертоническим, соответственно раствор с меньшим осмотическим давлением называется гипотоническим. Растворитель из гипотонического раствора диффундирует через мембрану в гипертонический раствор, стремясь выровнять осмотическое давление. Система, отделенная от окружающей среды мембраной с избирательной проницаемостью, называется осмотической ячейкой. Все клетки живых организмов являются осмотическими ячейками, которые способны всасывать растворитель из окружающей среды или отдавать его в зависимости от концентраций растворов, разделенных мембраной. При помещении клетки в гипотонический раствор вода проникает из окружающей среды в клетку, происходит набухание с появлением напряженного состояния клетки, называемого тургор. В растительном мире тургор помогает растению сохранять вертикальное положение и определенную форму. Если разница в концентрациях и соответственно осмотическом давлении наружного и внутреннего растворов достаточно велика, а прочность оболочки невелика, то осмос приводит к разрушению клеточной мембраны и лизису клетки. Если речь идет конкретно об эритроцитах, то такое разрушение клеточной мембраны с выделением гемоглобина в плазму называется гемолизом. При помещении клетки в гипертонический раствор вода диффундирует из клетки, и происходит сжатие и сморщивание оболочки клетки, называемое плазмолизом. Гипертонические растворы способствуют плазмолизу микроорганизмов, что используется при консервировании овощей и фруктов, когда их помещают в концентрированные растворы соли или сахара. Особенностью высших животных и человека является постоянство осмотического давления во многих физиологических системах и, прежде всего, в системе кровообращения. Постоянство осмотического давления называется изоосмией. Осмотическое давление в организм человека довольно постоянно и составляет 740-780 кПа. В медицинской и фармацевтической практике изотоническими (физиологическими) растворами называют растворы, характеризующиеся таким же осмотическим давлением, как и плазма крови. Такими растворами являются 0,9%-ный раствор NaCl и 5%-ный раствор глюкозы. В клинической практике при исследовании сыворотки крови и мочи для учета их осмотических свойств используют осмолярность (осмолярную концентрацию) или осмоляльность (осмоляльную концентрацию). Осмолярная концентрация (осмолярность) – суммарное молярное количество всех кинетически активных, т.е. способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы. Осмолярность раствора связана с его молярной концентрацией соотношением Сосм.= iС. Ее выражают в миллиосмолях в литре раствора (мОсм/л). Осмоляльная концентрация (осмоляльность) характеризует содержание кинетически подвижных частиц в миллиосмолях в 1 кг растворителя (мОсм/кг). Биологические среды – разбавленные растворы, поэтому разница между их осмолярностью и осмоляльностью незначительна. Дата добавления: 2015-01-12 | Просмотры: 888 | Нарушение авторских прав |
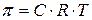 (5.1),
(5.1), . При подстановке величин концентрации и R в указанных единицах осмотическое давление получают в кПа.
. При подстановке величин концентрации и R в указанных единицах осмотическое давление получают в кПа. (5.2).
(5.2). (5.3)
(5.3)