 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
РАБОТА 7
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ
Скорость химической реакции определяется как изменение концентрации одного из реагирующих веществ или продуктов реакции в единицу времени. Среднюю скорость реакции в промежутке времени от t1 до t2 рассчитывают следующим образом:
где с1 и с2 – концентрация вещества в моменты времени t1 и t2 соответственно. Знак плюс берется при расчете скорости по продукту реакции, в ходе реакции концентрация продукта возрастает, с2 > с1, Dс>0. Знак минус берется при расчете скорости по одному из исходных реагентов, концентрация его при протекании реакции убывает, с2 < с1, Dс<0. Мгновенная скорость, т.е. скорость реакции в данный момент времени и соответственно при данной концентрации с, есть
Значение концентрации в выражении для скорости берется в моль/м3 либо в моль/дм3 (моль/л), время – в секундах, минутах, часах. Для всякой химической реакции зависимость скорости реакции от концентраций реагирующих веществ выражается законом действующих масс:
где Сi – концентрация i-го реагента. Показатель степени при концентрации называется порядком реакции по i-му веществу. Для простых реакций показатель степени совпадает со стехиометрическим коэффициентом в уравнении реакции. Коэффициент пропорциональности k в законе действующих масс называется константой скорости. Константа скорости химической реакции является характеристикой каждой конкретной реакции, зависит от температуры и не зависит от концентраций. Уравнения, связывающие скорость химической реакции с концентрациями, а также выражающие зависимость концентраций от времени, называются кинетическими уравнениями (см. таблицу). Для определения численного значения константы скорости необходимо тем или иным методом определить концентрацию реагирующего вещества в различные моменты времени и подставить эти значения в выражение для константы скорости (см. таблицу). Константу скорости можно также найти графически. Важнейшей кинетической характеристикой является период полураспада (t1/2) – время, в течение которого превращению подвергается половина взятого вещества. В приведенных в таблице уравнениях: С0 – начальная концентрация вещества, С – концентрация этого вещества в момент времени t. Таблица 1 Дата добавления: 2015-01-12 | Просмотры: 811 | Нарушение авторских прав |
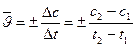 , (7.1)
, (7.1)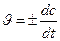 (7.2)
(7.2)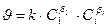 , (7.3)
, (7.3)