 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Кинетические уравнения реакций первого, второго и нулевого порядка
Изучаемая в данной работе реакция окисления иодид-ионов пероксидом водорода в водном растворе в кислой среде протекает по уравнению: H2O2 + 2I– + 2H+ = I2 + 2H2O (1) Механизм реакции сложный, включает несколько стадий. В целом в реакции участвуют три вида частиц, и в реакционной смеси могут изменяться концентрации всех этих частиц, влияя на скорость реакции. При избытке кислоты (ионов H+) концентрация [H+] может считаться постоянной. Концентрацию иодид-ионов [I–] можно поддерживать постоянной. Для этого в ходе опыта к реакционной смеси периодически добавляют одинаковые количества тиосульфата натрия Na2S2O3. Тиосульфат реагирует с выделяющимся при реакции (1) иодом по уравнению I2 + 2S2O32– = 2I– + S4O62– (2) Таким образом, пероксид водорода расходуется в реакции, а концентрация иодид-ионов остается практически постоянной. Кинетическое уравнение реакции окисления
где Дата добавления: 2015-01-12 | Просмотры: 1162 | Нарушение авторских прав |
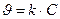
 или
или 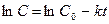
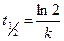
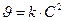

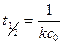
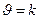
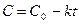
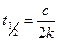
 ,
,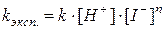 есть величина постоянная при соблюдении вышеуказанных условий, n – порядок реакции по I–. kэксп – экспериментально наблюдаемая константа скорости реакции первого порядка по пероксиду водорода.
есть величина постоянная при соблюдении вышеуказанных условий, n – порядок реакции по I–. kэксп – экспериментально наблюдаемая константа скорости реакции первого порядка по пероксиду водорода.