 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ИЗМЕРЕНИЕ рН РАСТВОРОВ ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ. ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕВодородным показателем (рН) называется число, определяемое следующим образом
где а (Н+) – активность ионов водорода, моль/л. В разбавленных растворах активность можно считать равной концентрации, и тогда водородный показатель определяется как
где [Н+] – концентрация ионов водорода в растворе, моль/л. Например, если концентрация ионов водорода [Н+]= 0,0001 моль/л, то рН = –lg0,0001 = –lg10–4 = 4. Наоборот, если рН = 6,4, тогда [Н+]= 10–6,4= 3,98∙10–7 моль/л. Вода является слабым электролитом, т.е. незначительно диссоциирует на ионы по уравнению 2Н2О «ОН– + Н3О+ или упрощенно Н2О «ОН– + Н+ Диссоциация воды называется автопротолизом. Константа равновесия, характеризующая равновесие, называется константой автопротолиза:
Экспериментально установлено, что при температуре 25ºС (298К) константа автопротолиза воды равна 1,8∙10–16 моль/л. При такой малой величине Ка(Н2О) активности ионов водорода и гидроксид-ионов можно считать равными концентрациям, а концентрацию недиссоциированной воды постоянной и равной 55,56 моль/л ([Н2О]= n (Н2О)/V(Н2О) моль/л или 1000 г/18 г/моль = 55, 56 моль/л). Отсюда [Н+]∙[OH–] = Kа(Н2О) ∙ [Н2О] = 1,8∙10–16∙ 55,56 =10–14. Произведение Кw = [Н+]∙[OH–] называется ионным произведением воды. При 25ºС (298К)
В нейтральном растворе концентрации ионов водорода и гидроксид-ионов равны и [Н+] = [OH–] = 10–7 моль/л. В таком растворе рН = – lg [Н+] = – lg10–7 = 7. В растворе, где концентрация ионов водорода выше, чем концентрация гидроксид-ионов [Н+] > [OH–], и [Н+] > 10–7 моль/л, т.е. в кислой среде pH < 7. Соответственно в щелочной среде pH > 7.
Дата добавления: 2015-01-12 | Просмотры: 865 | Нарушение авторских прав |
 (6.1),
(6.1), (6.2),
(6.2), (6.3).
(6.3).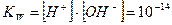 (6.4).
(6.4).