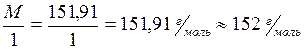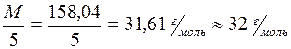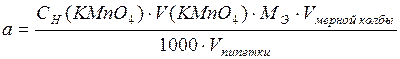|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Группа VIIБОпыт 4. Окислительные свойства перманганата калия Мn, Тc, Re – элементы, образующие группу VIIБ. Конфигурация валентных электронов этих элементов ns2(n-1)d5: Mn 4s23d5, Tc 5s24d5, Re 6s25d5. Из элементов этой группы наиболее распространен в природе марганец. Он относится к жизненно необходимым элементам – металлам жизни. Рений и технеций не являются биогенными элементами. Рений содержится в земной коре в незначительных количествах, технеций – радиоактивный элемент, в природе практически не встречается, получен искусственным путем. Марганец в своих соединениях проявляет степени окисления: +2, +3, +4, +6, +7. В природе наиболее распространены соединения марганца со степенью окисления +2. Из них наиболее важны оксид, гидроксид и соли. В медицинской практике из соединений марганца наиболее широко используют перманганат калия KMnO4. Перманганатами называются соли марганцевой кислоты HMnO4. В них Mn имеет высшую положительную степень окисления +7, поэтому перманганаты являются сильными окислителями. В зависимости от реакции среды они образуют различные продукты восстановления:
Как видно из уравнений, окислителями являются анионы MnO4–. Однако в таких формах марганец в биологических системах не существует. Очевидно, это связано с тем, что сильные окислители неприемлемы для организма как постоянные компоненты. Для организма перманганаты являются ядами. Обезвреживание их как ядов может идти за счет окислительно-восстановительной реакции. Например: 2KMnO4 + 5H2O2 + 6CH3COOH = 2Mn(CH3COO)2 + 2CH3COOK + 8H2O + 5O2. В уксуснокислой среде 3%-ный раствор Н2О2 действует как восстановитель. Эта реакция используется для лечения острых отравлений перманганатом. Перманганат калия взаимодействует с органическими компонентами клеток тканей и органическими веществами протоплазмы микробов. При этом KMnO4 восстанавливается до MnO2, который также может взаимодействовать с белками, образуя комплекс бурого цвета. Бактерицидные и прижигающие свойства перманганата обусловлены его окислительным и коагулирующим действием на белки. Вследствие того, что белки коагулируют, перманганат калия является препаратом наружного действия. Его противомикробное действие проявляется только на поверхности кожи и слизистых оболочек. Раствор KMnO4 применяют также для окисления токсичных органических веществ, переводя их в менее токсичные формы. Например, морфин окисляется в малотоксичный оксиморфин. KMnO4 используют в клиническом и биохимическом анализе для определения некоторых ферментов. В санитарно-гигиенической практике используют метод перманганатометрии для определения окисляемости природных вод, а также промышленных сточных вод. Метод основан на высоких окислительных свойствах перманганата, которые проявляются во взаимодействии его с примесными органическими компонентами воды. Перманганатометрия относится к методам окислительно-восстановительного титрования. Сущность метода заключается во взаимодействии раствора восстановителя (титруемый раствор) с раствором окислителя (рабочий раствор). В окислительно-восстановительных реакциях молярная масса эквивалента вещества равна молярной массе, деленной на число отданных или присоединенных в данной реакции электронов. Например, в реакции окисления сульфата железа (II) перманганатом калия: 2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
Каждый ион Fe2+ отдает один электрон, а каждый ион MnO4– принимает пять электронов. Поэтому: МЭ (FeSO4) = МЭ (KMnO4) = Выполнение опыта 4.1. В три пробирки налейте по 1-2 мл раствора KMnO4. В первую пробирку добавьте немного разбавленной серной кислоты, во вторую – столько же дистиллированной воды, в третью – раствор щелочи. Во все три пробирки добавьте по 1-2 мл раствора сульфита натрия. Что наблюдается? Отметьте, как изменился цвет раствора. Напишите уравнения окислительно-восстановительных реакций, определите окислитель и восстановитель, расставьте коэффициенты методом электронного баланса. 4.2. В две пробирки налейте по 1-2 мл раствора KMnO4. В первую добавьте немного разбавленной серной кислоты, во вторую – немного раствора уксусной кислоты CH3COOH. В обе пробирки добавьте по 1-2 мл 3%-ного раствора Н2О2. Что наблюдается? Напишите уравнения окислительно-восстановительных реакций и расставьте коэффициенты методом электронного баланса. Чем можно объяснить различие, наблюдаемое в двух случаях? 4.3. Возьмите две пробирки. В одну налейте 20 мл водопроводной воды, в другую – 20 мл воды из природного водоема, предположительно загрязненного органическими примесями. В каждую из этих пробирок прибавьте 1 мл 2н H2SO4 и содержимое пробирок взболтайте. Затем в воду по каплям из бюретки прибавляйте 0,1 н раствор KMnO4 до появления слабо-розовой окраски. Если проба окрашивается тремя и менее каплями раствора, то воду можно считать чистой. Если на это требуется более 3-х капель, то вода сильно загрязнена органическими веществами. Сделайте вывод о загрязнении исследуемой воды. Опыт 5. Окислительно-восстановительно титрование (перманганатометрия). Определение железа в растворе сульфата железа (II) или в растворе соли Мора (NH4)2S04×FeS04×6H20 Определение железа в растворе сульфата железа (II) или в растворе соли Мора (NH4)2SО4×FeSО4×6H2О основано на реакции: 2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O Для проведения этой реакции индикатор не нужен. Точку эквивалентности при титровании раствора сульфата железа (II) раствором перманганата калия определяют по изменению окраски титруемого раствора. Избыточная капля раствора перманганата калия вызывает заметное окрашивание титруемого раствора. Содержание железа в граммах в анализируемом растворе вычисляют по формуле:
где Сн (КМnO4) – нормальность раствора КМnO4, V(KMnO4) – объем (в миллилитрах) раствора КМnO4, пошедшего на титрование, Мэ — молярная масса эквивалента железа (56 г/моль ), Vмерной колбы – объем мерной колбы с раствором соли железа (в миллилитрах), Vпипетки — объем раствора соли Мора (в миллилитрах), взятый для титрования (он равен объему пипетки). Выполнение опыта 1. Для выполнения работы используют раствор FeSO4 или раствор соли Мора, приготовленный лаборантом в колбе на 250 мл. Пипетку перед отбором пробы предварительно ополаскивают раствором FeSO4.Отбирают пипеткой 20 мл раствора FeSO4 или соли Мора, переносят его в коническую колбу, добавляют 5-10 мл 2н H2SO4. 2. Бюретку ополаскивают рабочим раствором КМnO4 (0,1н), используя для этого 5–6 мл его. После этого бюретку заполняют 0,1н КМnO4 до нулевого деления. 3. Производят титрование, добавляя из бюретки раствор КМnO4 до появления заметного на глаз бледно-розового окрашивания. Полученный результат записывают в тетрадь и повторяют титрование еще несколько раз до тех пор, пока разница в объеме раствора КМnO4, идущего на титрование, будет около 0,1 мл. Внимание! Скорость титрования должна быть всегда одинакова, только тогда можно добиться точных результатов. Нужно учитывать, что иногда окислительно-восстановительные реакции протекают медленнее, чем реакции нейтрализации. Поэтому при добавлении первой капли раствора КМnO4 обесцвечивание может наступить не сразу. Следующую порцию раствора КМnO4 нужно добавлять только после того, как исчезнет окраска. Если титровать быстро, раствор может окраситься в бурый цвет (окраска МпО2). В таком случае титрование прекращают и берут новую порцию анализируемого раствора. Дата добавления: 2015-01-12 | Просмотры: 903 | Нарушение авторских прав |