 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ИХ БИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕНЕНИЕ В МЕДИЦИНЕЭлементы d-семейства (d-элементы) – это элементы, у которых последний электрон заполняет d-орбиталь предвнешнего электронного слоя (2-го снаружи слоя). К ним относятся элементы, находящиеся в середине больших периодов (между s- и р-элементами). Их называют также переходными элементами. Так как d-орбиталей пять, и на каждой может быть по два электрона, то всего на d-подуровне может быть 10 электронов. Им соответствуют 10 d-элементов. Например, в IV периоде к d-элементам относятся элемента от Sc (№21) до Zn (№30) включительно. d-Элементы находятся в побочных подгруппах периодической системы, все они металлы. На внешнем электронном слое у большинства из них находятся по 2 электрона. Если наблюдается «провал» («проскок») электрона с s-орбитали внешнего слоя на d-орбиталь предвнешнего слоя, то на внешнем слое остается 1 электрон, как например, у Cr и Сu (элементов IV периода). Таким образом, на внешнем электронном слое у них мало электронов, они их легко отдают и являются металлами. Валентными электронами у них могут быть не только электроны внешнего слоя (ns-электроны), но и предвнешнего слоя ((n–1)d-электроны). Поэтому подавляющее большинство из них проявляет переменную валентность. По содержанию в организме человека d-элементы относятся к микроэлементам (10–3 масс. % и ниже). Среди них есть жизненно необходимые (незаменимые) элементы – это Mn, Cu, Co, Fe, Zn, Mo, V (по классификации В.В. Ковальского). Другие, такие как, Cd, Cr, Ni, Ag, Hg и другие, относятся к примесным элементам, биологическая роль которых мало выяснена или неизвестна. Шесть d-элементов (Fe, Zn, Cu, Mn, Mo, Co) наряду с четырьмя s-элементами (Ca, K, Na, Mg) относятся к металлам жизни. У d-элементов сильно выражена способность к комплексообразованию (слово «комплексные» означает сложные, составные). Комплексные соединения - ярко окрашенные солеобразные вещества были известны химикам еще в XVIII веке. Одними из первых были открыты комплексные соли железа и кобальта. Многие биокатализаторы – ферменты также являются комплексными соединениями. Изучением их занимается бионеорганическая химия. Рассмотрим образование комплексной соли на конкретном примере. Если к голубому водному раствору CuSO4 прибавить раствор аммиака NH3, то при этом раствор приобретает красивый ярко-синий цвет. Происходит реакция образования комплексной соли [Cu(NH3)4]SO4: CuSO4 + 4NH3 → CuSO4×4NH3 Строение комплексных соединений объясняет теория А. Вернера. В молекулах комплексных соединений выделяют центральный атом или ион (М) и непосредственно связанные с ним молекулы (или ионы), называемые лигандами (L), в количестве n. Центральный ион и окружающие его лиганды образуют внутреннюю сферу комплекса [MLn]. Внутренняя сфера связана электростатическими силами притяжения с внешней сферой, которая состоит из m частиц Х (молекулы или ионы). Общая запись формулы комплексного соединения имеет вид [MLn]Xm. Центральный атом координирует лиганды, геометрически правильно располагая их в пространстве. Поэтому комплексные соединения называют также координационными. Число лигандов n называется координационным числом, а внутренняя сфера – координационной. В соответствии с этим формулу комплексного соединения меди с аммиаком можно записать в виде [Cu(NH3)4]SO4, где ион меди Cu2+ – центральный ион; молекулы NH3 – лиганды; 4 – координационное число; сульфат анион SO42- – внешняя сфера. Называется данная соль сульфат тетраамминмеди (II). Комплексные соли диссоциируют на внутреннюю и внешнюю сферу по типу сильных электролитов: [Cu(NH3)4]SO4 «[Cu(NH3)4]2+ + SO42-. Образующийся комплексный ион [Cu(NH3)4]2+ диссоциирует как очень слабый электролит: [Cu(NH3)4]2+ «Cu2+ + 4NH3. Концентрация образующихся ионов Cu2+ очень мала. Константа равновесия этого процесса называется константой нестойкости комплексного иона (комплекса):
Обратная ей величина называется константой устойчивости комплекса:
Чем больше константа устойчивости комплекса, тем более прочным он является, в меньшей степени диссоциирует на комплексообразователь и лиганды. Многие жизненно необходимые d-элементы содержатся в организме в виде комплексов с лигандами – аминокислотами, белками, нуклеиновыми кислотами, гормонами, витаминами и т.д. Так ион Fe2+ в качестве комплексообразователя входит в состав гемоглобина, Со2+ – в витамин В12. Токсичность соединений тяжелых металлов (Hg, Pb, Cd, Cr, Ni) объясняется взаимодействием катионов тяжелых металлов (МТ) с бионеорганическими комплексами. Реакция, описывающая это взаимодействие, может быть записана в виде уравнения: МБL + МТ = МБ + МТL, где МБL – комплекс иона биогенного металла МБ (Fe, Zn, Cu, Co) с биоорганическими лигандами L (например, с порфирином); МТ – ион тяжелого металла. Если устойчивость комплекса МТL больше, чем устойчивость МБL, происходит смещение равновесия указанной обратимой реакции вправо, и в организме накапливаются токсичные соединения МТL. Свойства ионов металлов образовывать прочные связи с серосодержащими лигандами используются и при подборе лекарств, применяемых для лечения при отравлениях. Такие лекарства имеют общее название – антидоты. Например, в нашей стране применяется отечественные препараты унитиол, сукцимер, которые образуют с ртутью прочные комплексы. В качестве антидотов при отравлении Zn, Cd, Hg применяют также комплексон этилендиаминтетрауксусную кислоту (ЭДТА) и ее натриевую соль (трилон Б). Применение комплексонов основано на том, что они, выступая в качестве лигандов, образуют более прочные комплексы с ионами металлов, чем эти ионы с серосодержащими группами белков, ферментов, аминокислот. Дата добавления: 2015-01-12 | Просмотры: 1429 | Нарушение авторских прав |
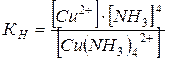 .
. ; КУ = 1×1012.
; КУ = 1×1012.