 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Способы выражения концентрации растворовКонцентрацией раствора называется отношение массы, количества растворенного вещества к определенной массе или объему раствора или растворителя. 1. Массовая доля растворенного вещества в растворе w – это отношение массы растворенного вещества к массе раствора. Она может выражаться в долях от единицы (формула 1.1) или в процентах (формула 1.2).
Массовую долю растворенного вещества, выраженную в процентах, называют процентной концентрацией. Процентная концентрация показывает, сколько граммов вещества содержится в 100 г раствора. Например, 15%-ный раствор – это такой раствор, в 100 г которого содержится 15 г вещества. 2. Моляльная концентрация (моляльность) Сm – количество растворенного вещества (моль), содержащееся в единице массы растворителя (кг).
3. Молярная концентрация (молярность) СМ – это количество растворенного вещества (моль), содержащееся в единице объема раствора (л).
С учетом
где m – масса растворенного вещества, г, М – молярная масса растворенного вещества, г/моль, V – объем раствора, л. Используется сокращенная форма указания молярной концентрации, например, 0,5М – раствор с концентрацией 0,5 моль/л. Раствор, содержащий 1 моль вещества в 1 литре раствора, называется одномолярным (1М). Децимолярный раствор (0,1М) содержит 0,1 моль в 1 литре, сантимолярный раствор (0,01М) – 0,01 моль в 1 литре, миллимолярный – 0,001 моль в 1 литре раствора. 4. Молярная концентрация эквивалента СН – число моль-эквивалентов растворенного вещества в единице объема раствора.
Сокращенное обозначение единиц молярной концентрации эквивалента – н (нормальность). Раствор, содержащий 1 моль-экв. вещества в 1 литре, называется однонормальным 1 н. Децинормальный раствор (0,1н) содержит 0,1 моль-экв. в 1 литре, сантинормальный раствор (0,01н) – 0,01 моль-экв. в 1 литре раствора. Понятие «эквивалент» подразумевает равноценный, равнозначный. Под химическим эквивалентом понимают количество вещества, равноценное количеству другого вещества в химической реакции. За эталон химического эквивалента принимают 1 моль атомов водорода или 1/2 моль атомов кислорода. Тогда, эквивалент элемента или сложного вещества – это такое его количество, которое может взаимодействовать (присоединяться или замещаться) с одним молем атомов водорода или 1/2 моля атомов кислорода. Например, Э(HCl) = 1 моль, Э(H2SO4) = 1/2 моль, Э(NaOH) = 1 моль, Э(Al(OH)3) = 1/3 моль и т.д. Молярная масса эквивалента МЭ выражается в Молярные массы эквивалентов сложных веществ рассчитывают, как указано в таблице. Таблица
Молярная масса эквивалента не является постоянной величиной в отличие от молярной массы и может быть различной в зависимости от реакции. Сравнение формул для определения молярной и нормальной концентраций
показывает, что в случае, когда эквивалент растворенного вещества Э=1 моль, молярная и нормальная концентрации растворов совпадают. Это относится к растворам одноосновных кислот (HCl, HNO3 и т.д.), однокислотных оснований (NaOH, KOH и т.д.), солей с однозарядными катионами и анионами (KCl, NaNO3 и т.д.). Например, СМ(HNO3) = СН(HNO3); СМ (KCl) = СН(KCl) и т.д. Если же эквивалент растворенного вещества не равен 1 моль, то молярная концентрация его раствора во столько же раз меньше нормальной, во сколько раз эквивалент этого вещества меньше 1 моль. 5. Титром раствора называют массу растворенного вещества, содержащегося в 1 мл раствора.
6. Мольная (молярная) доля растворенного вещества и растворителя в растворе N (или x) – отношение количества растворенного вещества или растворителя к сумме количеств веществ, содержащихся в растворе.
где n1 – количество растворенного вещества, n2 – количество растворителя. N – величина безразмерная, выражается в долях от единицы или в процентах. Сумма мольных долей всех компонентов раствора равна единице или 100%.
Дата добавления: 2015-01-12 | Просмотры: 1213 | Нарушение авторских прав |
 (1.1)
(1.1) (1.1а)
(1.1а) (1.2)
(1.2)  .
. (1.3)
(1.3)  .
. , формула (1.3) приобретает вид
, формула (1.3) приобретает вид (1.4),
(1.4), (1.5)
(1.5) 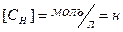 .
. . Например, молярная масса эквивалента МЭ (HCl)=36,5 г/моль, МЭ (H2SO4) = 1/2 ∙ 98 = 49 г/моль, МЭ (Al(OH)3) = 1/3 ∙ 78 = 26 г/моль.
. Например, молярная масса эквивалента МЭ (HCl)=36,5 г/моль, МЭ (H2SO4) = 1/2 ∙ 98 = 49 г/моль, МЭ (Al(OH)3) = 1/3 ∙ 78 = 26 г/моль.


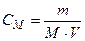 и
и  ,
, (1.6)
(1.6)  .
. , (1.7)
, (1.7)