 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Для подготовки к семинарским занятиям и контрольным работам
Тема: Способы выражения концентрации растворов 1. Массовая доля сахара в сиропе для варенья должна составлять 70%. Какие массы сахара и воды следует взять для приготовления 1 кг сиропа? 2. Рассчитайте, какая масса поваренной соли и какой объем воды требуются для приготовления 10 л раствора, массовая доля соли в котором составляет 8%, а его плотность 1,06 г/мл. 3. В рецептах маринадов для овощей рекомендуется готовить заправку из расчета 200 г уксусной эссенции (80%-й водный раствор уксусной кислоты) на 9 л воды. Какова массовая доля уксусной кислоты в таком растворе? 4. Используемый в медицинских целях раствор пероксида водорода («перекись») представляет собой 3%-ный раствор. Промышленностью выпускается 30%-ный раствор – пергидроль. В каком отношении надо взять пергидроль и воду, чтобы получить раствор, используемый в медицине? 5. В медицинских целях обычно используется 3%-ная йодная настойка. Рассчитайте, какой объем этилового спирта С2Н5ОН необходим для приготовления такой настойки из 15 г иода. Плотность спирта 0,8 г/мл. 6. К 160 г 20%-ного раствора щелочи добавили еще 40 г твердой щелочи. Чему равна массовая доля растворенного вещества в полученном растворе? 7. Какой объем воды надо выпарить из 500 мл 4%-ного раствора соли (ρ=1,04 г/мл), чтобы получить раствор с массовой долей соли 0,16? 8. Для нейтрализации щелочи, попавшей на кожу, после промывания водой используется 2%-ный раствор борной кислоты. Какая масса насыщенного раствора этой кислоты с концентрацией 4,7% нужна для приготовления 500 г 2%-ного раствора. 9. Какова будет массовая доля азотной кислоты в растворе, если к 40 мл 96%-ного (плотность 1,5 г/мл) прилить 30 мл 48%-ного раствора HNO3 (плотность 1,3 г/мл)? 10. Смешали 2,3 кг 12%-ного раствора нитрата калия и 2,3 л раствора с концентрацией этой соли, равной 2,24 моль/л (плотность 1,133 г/мл). Вычислите массовую долю соли в полученном растворе. 11. Вычислите массу хлорида натрия, необходимую для приготовления 250 мл 0,1 М раствора NaCl. 12. Найдите массу медного купороса, необходимую для приготовления 0,3М раствора. Чему равна нормальность этого раствора (молярная концентрация эквивалента)? 13. В медицинской практике часто пользуются 0,9%-ным изотоническим (физиологическим) раствором NaCl. Вычислите а) молярную, моляльную концентрацию и титр раствора; б) массу соли, введенную в организм при вливании 500 мл этого раствора. 14. В медицинской практике при кожных заболеваниях пользуются 10%-ным раствором СаСl2. Вычислите: а) молярную, моляльную концентрацию и титр раствора; б) массу соли, введенную в организм при вливании 20 мл этого раствора. 15. Найдите процентную концентрацию 0,25М раствора фосфорной кислоты, плотность которого 1,01 г/мл. 16. Плотность 40%-ного раствора серной кислоты равна 1,300 г/мл. Рассчитайте молярность и нормальность (молярную концентрация эквивалента) этого раствора. 17. Определите моляльную концентрацию хлорида кальция в 5%-ном растворе. Определите мольные доли веществ в этом растворе. 18. Определите мольную долю растворенного вещества, а также молярность, нормальность, моляльность и титр следующих растворов: а) 70%-ной серной кислоты, б) 20%-ного гидроксида натрия. Необходимые значения плотности растворов найдите в приложении. 19. Определите мольную долю растворенного вещества, а также молярность, нормальность, моляльность и титр следующих растворов: а) 20%-ной фосфорной кислоты, б) 25%-ного едкого кали. Необходимые значения плотности растворов найдите в приложении. 20. Определите моляльность раствора, полученного при растворении 5 г толуола в 225 г бензола. Определите мольную долю толуола в этом растворе и молярную концентрацию, если плотность раствора 0,876 г/мл. 21. Раствор аммиака NH3 с концентрацией 20% имеет плотность 0,92 г/мл. Определите молярную концентрацию такого раствора и найдите объем аммиака, измеренный при 19°С и давлении 102 кПа, необходимый для приготовления 300 мл раствора. 22. В колбе вместимостью 250 мл находится хлороводород НС1 при температуре 18°С и под давлением 100 кПа. В колбу ввели 10 мл воды, которая полностью поглотила хлороводород. Найдите процентную и молярную концентрации полученного раствора, полагая его плотность равной 1. 23. Какая масса серной кислоты содержится в растворе, который полностью нейтрализован 60 мл 0,5 н раствора гидроксида калия? 24. Какой объем 0,1 н раствора гидроксида натрия требуется для полной нейтрализации 50 мл 40%-ного раствора серной кислоты (плотность 1,300 г/мл)?
Тема: Химическая термодинамика и химическое равновесие 1. При сгорании 21,5 г ацетона выделяется 660,72 кДж. Составьте термохимическое уравнение этой реакции. 2. В калориметрической бомбе в избытке хлора сожгли 0,0123 г алюминия. В результате выделилось 320,8 Дж теплоты. Вычислите энтальпию образования хлорида алюминия. 3. Определите энтальпию реакции COCl2 + ½ O2 = CO2 + Cl2 по следующим данным: COCl2 = CO + Cl2, ΔHo = 112,5 кДж CO2 = CO + ½ O2, ΔHo = 282,8 кДж 4. Подберите коэффициенты в уравнениях реакций. Используя табличные данные энтальпий образования участников, рассчитайте тепловые эффекты следующих реакций: SiCl4(г) + H2O(г) → SiO2(кр) + HCl(г) H2O(г) + Br2(г) → HBr(г) + O2(г) NH3(г) + NO2(г) → N2(г) + H2O(г) Al(кр) + CuO(кр) → Cu(кр) + Al2O3 (кр) Запишите термохимические уравнения реакций. 5. Одной из стадий количественного определения антиангинального препарата нитроглицерина является реакция:
Вычислите тепловой эффект реакции. Экзо- или эндотермической она является? 6. Энтальпия сгорания мочевины с образованием углекислого газа и жидкой воды равна –635 кДж/моль. Рассчитайте энтальпию образования мочевины из простых веществ, если известны энтальпии образования углекислого газа и жидкой воды ΔHo f (CO2) = –393,51 кДж/моль, ΔHo f (H2O) = –285,8 кДж/моль. 7. Энтальпии сгорания α-глюкозы, β-фруктозы и сахарозы при 25°С равны соответственно –2802, –2810 и –5644 кДж/моль. Рассчитайте теплоту гидролиза сахарозы. 8. В организме человека в результате метаболизма образуется глицерин, который далее превращается в СО2(г) и Н2О(ж). Пользуясь справочными данными энтальпий образования, определите, какое количество теплоты выделяется при окислении 1 г глицерина. 9. Рассчитайте энтальпию реакции получения мочевины в организме из аммиака и оксида углерода (IV) 2NH3(г) + СО2(г) = СO(NH2)2(т) + Н2О(г). 10. Вычислите стандартные энтропии реакций радикального хлорирования метана до хлорметана и этана до хлорэтана. Какая из реакций характеризуется более существенным приращением стандартной энтропии? 11. Какая из реакций гидрирования: а) пропена; б)1,2–бутадиена будет характеризоваться максимальным значением энтропии. 12. Оцените роль энтальпийного и энтропийного фактора для реакции диспропорционирования нитрита натрия:
Возможно ли самопроизвольное протекание этой реакции при стандартных условиях? 13. Оцените роль энтальпийного и энтропийного факторов для реакции ферментативного гидролиза мочевины.
Возможно ли самопроизвольное протекание этой реакции при стандартных условиях? 14. Для реакции гидратации яичного альбумина при 25ºС ΔHo=–6,58 кДж/моль, ΔSo=–9,5 Дж/моль∙К. Найдите константу равновесия для этой реакции. 15. Вычислить константу равновесия и начальные концентрации веществ для реакции Тема: Коллигативные свойства растворов 1. Найдите температуры замерзания и кипения следующих водных растворов: а) 5%-ный раствор глюкозы; б) 10%-ный раствор мочевины: в) 10%-ный раствор сахара. Криоскопическая и эбуллиоскопическая константы воды соответственно равны 1,86 К∙кг/моль и 0,512 К∙кг/моль. 2. При какой температуре закипит 2%-ный спиртовой раствор салициловой кислоты, применяемый как антисептическое средство? Эбулископическая константа этанола 1,11 К×кг/моль. Температура кипения этанола 78ºС. 3. Гормон адреналин состоит (по массе) из 59% углерода, 26,2 % кислорода, 7,1% водорода и 7,6% азота. Температура кипения раствора, содержащего 6,4 г адреналина в 360 г, на 0.49 К выше температуры кипения чистого СCl4. Какова молярная масса и молекулярная формула адреналина (Эбулископическая константа для СCl4 равна 5,02 К×кг/моль)? 4. Для определения молекулярной массы белого фосфора его навеску 0,7590 г растворили в 30 г бензола, температура кристаллизации полученного раствора равна 4,5 0С. Найдите, сколько атомов входит в молекулу белого фосфора. Температура кристаллизации чистого бензола равна 5,50С, К=4,9 К×кг/моль. 5. Определите температуру замерзания раствора хлорида натрия массовой долей 5 %, если кажущаяся степень диссоциации NaCl в этом растворе равна 84,5 %. Криоскопическая постоянная воды 1,86 К×кг/моль. 6. Найдите, при какой температуре закипит и замерзнет 5%-ный раствор перманганата калия, считая степень его диссоциации в этом растворе равной 83%. 7. Вычислите изотонический коэффициент в 0,15 М растворе NaCl, который изотоничен 5%-му раствору глюкозы (плотность раствора глюкозы считать равной 1г/мл). 8. Определите молярную концентрацию раствора сахарозы, который изотоничен крови. 9. Чему равна осмоляльная концентрация крови лягушки, если температура замерзания крови равна –0,41°С? 10. Определить осмотическое давление крови лягушки, если осмотическая концентрация ее крови при 7°С равна 220 мОсмоль/л. 11. Определить процентную концентрацию раствора NaCl, который изотоничен крови лягушки, если осмотическая концентрация ее крови равна 220 мОсмоль/л. 12. Какое явление (лизиса или плазмолиза) эритроцитов при 20°С будет наблюдаться в 30%-ном растворе тиосульфата натрия (ρ=1,274 г/мл), если осмотическое давление крови составляет 730–780 кПа? Степень диссоциации Na2S2O3 считать равной 0,9.
Тема: Протолитические равновесия. рН растворов. Буферные системы Необходимые для решения задач значения констант диссоциации кислот и оснований приведены в приложении.
1. В таблице приведены значения рН некоторых жидкостей. Найдите концентрацию ионов водорода и гидроксид-ионов.
2. В нормальном желудочном соке содержание соляной кислоты колеблется в пределах от 0,07 до 0,15%. Рассчитать пределы изменения рН. Плотность желудочного сока принять равной 1 г/мл. 3. К 49 мл воды добавлено 5 мл 0,1 н NaOH. Как изменилось значение рН? 4. К 49 мл воды добавлено 3 мл 0,1 н HCl. Как изменилось значение рН? 5. Три кислоты имеют следующие значения рКа: масляная кислота – 4,82, барбитуровая кислота – 5,0, молочная кислота – 3,85. Какая из них является самой слабой и какая самой сильной? Найдите значения констант ионизации кислот. 6. Найдите значение рН раствора молочной кислоты с концентрацией 0,15 моль/л. Чему равна степень диссоциации молочной кислоты в этом растворе? 7. Вычислите рН раствора, полученного при растворении таблетки аскорбиновой кислоты массой 0,5 г в таком количестве воды, чтобы объем раствора достигал 0,4 л (К а = 8,0∙10–5 моль/л, молекулярная формула аскорбиновой кислоты С6Н8О6). 8. Найдите значение рН нашатырного спирта (10%-ного водного раствора аммиака). Плотность раствора принять равной 0,96 г/мл. 9. Найдите значения рН буферных смесей, содержащих эквимолярные количества (а) Н3ВО3 и Н2ВО3–;(б) НСО3– и СО32–; (в) H3PO4 и H2PO4–. 10. Рассчитайте рН буферного раствора, полученного растворением 0,1 моль муравьиной кислоты и 0,1 моль формиата натрия в 1 литре воды. Рассчитайте массы реагентов для получения такого раствора. 11. рН раствора, полученного растворением 1 моль пропионовой кислоты и 1 моль пропионата натрия в 1 л воды, составляет 4,85. Каково будет значение рН при использовании по 0,1 моль каждого из реагентов? 12. Рассчитайте рН водных растворов, содержащих: а) 0,58 моль/л уксусной кислоты и 0,18 моль/л ацетата натрия; б) 0,8 моль/л молочной кислоты и 0,4 моль/л лактат-иона; в) 0,42 моль/л фтороводородной кислоты и 1,38 моль/л фторида натрия; г) 0,3 моль/л NH4OH и 1,48 моль/л NH4+. 13. Сколько граммов твердого Na2HPO4 необходимо добавить к 1 л 0,01 M раствора NaH2PO4, чтобы получить раствор с рН равным 8,21? 14. Каково соотношение концентраций H2CO3 и гидрокарбонат-анионов, а также анионов H2PO4– и HPO42– в плазме крови при физиологически нормальном значении рН?
Тема: Химическая кинетика 1. Для лечения некоторых опухолей применяют изотоп иод-131. Период полураспада составляет 8,1 сут. Какое время должно пройти, чтобы количество радиоактивного иода в организме больного уменьшилось в 100 раз. 2. Период полураспада радиоактивного изотопа 90Sr, который попадет в атмосферу при ядерных испытаниях, составляет 28,1 лет. Предположив, что организм новорожденного поглотил 1,00 мг этого изотопа и что он не выводится из организма, рассчитайте, сколько радиоактивного стронция останется в организме через: а) 18 лет, б) через 70 лет. 3. Константа скорости разложения анальгина при 20 °С составляет 1,5∙10–9 с–1. Определите срок хранения таблеток (время разложения 10% вещества) при 20°С. 4. Температурный коэффициент скорости некоторой ферментативной реакции равен 7. Во сколько раз увеличится скорость этой реакции при изменении температуры от 37°С до 42°С? 5. Реакция при температуре 40°С протекает за 180 с при температурном коэффициенте равном 3. За сколько времени завершится эта реакции при 60°C? 6. Энергия активации реакции, приводящей к скисанию молока, равна 75 кДж/моль. При температуре 21ºС молоко скисает за 8 часов. Как долго можно хранить молоко в холодильнике при 5ºС? Время реакции можно считать обратно пропорциональным константе скорости. 7. Раскручивание двойной спирали ДНК – реакция первого порядка с энергией активации 420 кДж/моль. При 37ºС константа скорости равна 4,90∙10–4 мин–1. Найдите константу скорости при 40ºС. 8. Для реакции гидролиза сахарозы при температуре 298,2 К константа скорости равна 0,765 л∙моль–1∙мин–1, а при температуре 328,2 К – 35,5 л∙моль–1∙мин–1. Найдите энергию активации этой реакции и константу скорости при температуре 343 К. 9. Константа скорости гидролиза новокаина при 313 К равна 0,66 мин–1. Энергия активации равна 55,2 кДж/моль. Какая массовая доля новокаина разложится за 10 дней хранения при 193 К? Дата добавления: 2015-01-12 | Просмотры: 1619 | Нарушение авторских прав |
 .
. .
.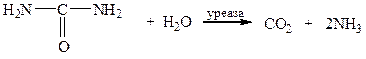
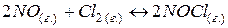 , если равновесные концентрации веществ участников реакции равны: 2, 1, 3,2 моль/л соответственно.
, если равновесные концентрации веществ участников реакции равны: 2, 1, 3,2 моль/л соответственно.