|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Адъювантная гормонотерапия
Значительная часть больных после радикальной простатэктомии имеет высокий риск рецидива заболевания, факторами неблагоприятного прогноза являются высокий предоперационный ПСА, Глисон > 7, прорастание капсулы (рТ3), наличие опухоли по краю резекции и инвазия опухоли в семенные пузырьки. Прогрессирование может проявляться по-разному: либо в виде местного рецидива, либо появления метастазов. Наличие опухоли по краю разреза указывает на высокий риск местного рецидива. С другой стороны, инвазия семенных пузырьков обычно связана с высоким риском появления отдаленных метастазов. Обнаружение ПСА в сыворотке крови у больных после радикальной простатэктомии обычно указывает на местный рецидив или появление метастазов. Однако следует отметить, что не каждый больной с определяемым ПСА имеет клиническое подтверждение прогрессии и у 15% таких пациентов при биопсии уретровезикального анастомоза находят элементы доброкачественной гиперплазии простаты. Тем не менее у большинства больных с биохимическим рецидивом в течение 18-24 месяцев появляются клинические признаки болезни. У большинства больных появление определяемого ПСА более чем через год после операции связано с местным рецидивом. Напротив, у половины больных с появлением ПСА в течение первого года после операции выявляются отдаленные метастазы. Скорость нарастания ПСА может также косвенно указывать на причину биохимического рецидива. Общие рекомендации ведения больных с высоким риском рецидива. Больные с прорастанием капсулы простаты только на небольших участках и Глисоном < 6 имеют хороший прогноз и могут просто наблюдаться с регулярным контролем ПСА. Напротив, пациенты с высоким Глисоном (> 8), явным наличием опухоли по краю разреза, ненулевым ПСА и с инвазией опухоли в семенные пузырьки вряд ли получат пользу от лучевой терапии и являются кандидатами для ранней гормональной терапии. Группа больных с наличием опухоли по краю разреза и нулевым ПСА, умеренно- и низкодифференцированной аденокарциномой представляется наиболее подходящей для проведения адъювантной лучевой терапии.
1.13.5. Лучевая терапия Выделяют дистанционную (по радикальной программе) и внутритканевую (брахитерапия) лучевую терапию. Дистанционная лучевая терапия проводится пациентам, которым противопоказано хирургическое лечение, и тем, кто отказывается от операции. Перед началом лучевой терапии составляют топометрические карты, определяя поля облучения по костным ориентирам на рентгенограммах или объем мишени по КТ. Дистанционное облучение РПЖ осуществляется тормозным излучением высокоэнергетических ускорителей (4-23 МВ) или, что хуже, на телегаммаустановках (1,25 МВ). Рекомендуется не менее чем 3-4-польное или конформное облучение. При конформном (3D) облучении СОД может составлять 76 Гр и больше без риска увеличения осложнений. Увеличение дозы лучевой терапии улучшает отдаленные результаты лечения. Стандартная доза облучения: РОД 2 Гр, СОД 65-70 Гр на предстательную железу и 44 Гр на таз. Чаще всего применяется облучение до СОД 40 Гр с последующим перерывом на 3 недели и продолжением курса до достижения необходимой суммарной дозы. Противопоказаниями к лучевой терапии являются: наличие цистостомы, обострение цистита или ректита, камни мочевого пузыря, выраженная доброкачественная гиперплазия простаты с наличием остаточной мочи. У больных, подвергшихся трансуретральной резекции, лучевая терапия должна быть отложена примерно на 4 недели, в противном случае возможно развитие недержания мочи и структуры уретры. Брахитерапия (от греческого слова «brachios» - короткий быстрый) – современный безоперационный метод лечения рака предстательной железы, когда микроисточники на основе I-125,Pd-103 вводятся внутрь пораженного органа. При этом максимальная доза излучения составляется непосредственно в опухоль без поражения прилегающих органов и тканей (рис. 6). Впервые брахитерапия была применена в 1910 году, когда D. Pasteau и Р.Degrais ввели капсулы радия 226 в предстательную железу через уретру. Далее в 1917 году в США R.H. Barrinder ввел микроисточники в железу через иглы. Затем Flocks вместе с соавторами в 1930 году применили в качестве имплантов радиоактивное золото. Возрождение брахитерапии РПЖ началось в 1970 году с развитием ретропубикальной (открытой) имплантации зерен I-125 в мемориальном госпитале Нью-Йорка, однако при выполнении данной методики зерна йода располагались мануально, вследствие чего не достигалось оптимального, гомогенного распределения дозы, вследствие чего оставались холодные очаги. В 1981 году Holm и Gammergaard применили технологию имплантации микроисточников I-125 в ткань предстательной железы под контролем трансректального ультразвукового датчика.
Рис.6. Схема проведения брахитерапии.
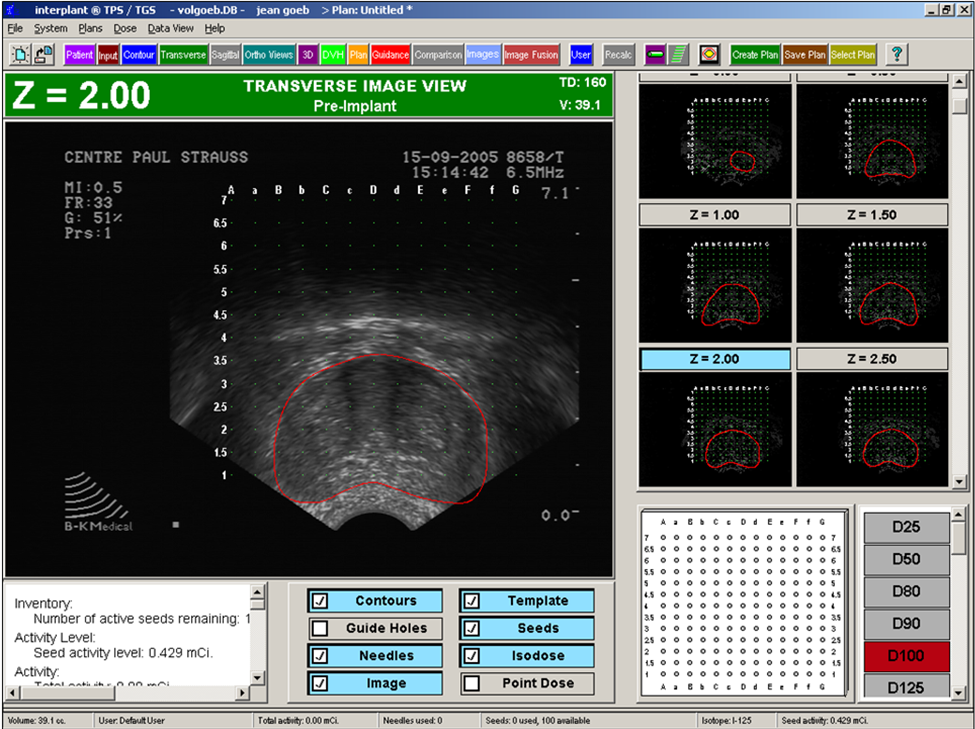
В 1990 году P.Koutrouvelis использовал трехмерную стереотаксическую приставку к компьютерному томографу для лечения больных с раком предстательной железы, которым невозможно введение источников под контролем ТРУЗИ. В 2000 году в России проведена первая брахитерапия больному с раком предстательной железы на базе НИИ урологии МЗ города Москва. Наиболее высокие результаты достигают 100% безрецидивного 5-летнего течения у больных в стадии Т1-2 с высокодифференцированными опухолями. Значительно худшие результаты брахитерапии у пациентов с более распространенным процессом, множественными метастазами в регионарные лимфатические узлы и низкодифференцированной формой рака. В связи с этим для внутритканевой лучевой терапии отбираются больные раком предстательной железы в стадии Т1-2 , показателем Глиссона 2-6, объемом железы не более 60 см3. У пациентов с умеренным риском прогрессирования заболевания - стадия Т2б, показатель Глиссона 7, уровнем ПСА 10-20 нг/мл четких показаний к применению брахитерапии, сочетанного и комплексного лечения нет. На подготовительном этапе брахитерапии за 3-4 недели до операции пациенту проводят исследование на мультиспиральном компьютерном томографе либо с помощью ТРУЗИ (рис. 7).
Рис. 7. Брахитерапия. Подготовительный этап. Выполнение разметки (контур предстательной железы). На основании полученных данных оценивается состояние предстательной железы и семенных пузырьков. С помощью специальной компьютерной программы производится трехмерная объемная реконструкция анатомических структур (рис. 8). Это необходимо для расчета дозиметрии и оценки последующей лучевой нагрузки на органы. Затем проводится предварительное планирование расположения источников и анализ распределения дозы. Главная цель - достичь равномерного распределения дозы излучения. Местный рецидив отмечается у 5% больных с гомогенным распределением дозы и у 24% с негомогенным.
Рис. 8. Брахитерапия. Расчет количества имплантов. Анализ данных с помощью специальной компьютерной программы, в которой определяются места введения проводников.
Второй этап – процедура имплантации (рис. 9). Имплантация радиоактивных зерен проводится в операционной под общим наркозом и длится около 1-2 часов. В простату под контролем ультразвукового аппарата или КТ, через кожу промежности, между мошонкой и прямой кишкой, специальными иглами вводят небольшие металлические капсулы, содержащие радионуклиды. Обычно вводится около 60-90 капсул, в зависимости от размера железы. Положение игл и зерен контролируется на экране монитора. Указанные изотопы образуют при распаде бета-изучение с максимальным пробегом в тканях не более 8 мм. Суммарная очаговая доза одной внутритканевой лучевой терапии составляет в среднем 140-160 Гр при использовании I-125, 115-120 Гр для Pd-103. Расстояние между радиоактивными источниками составляет от 0,5 до 1 см. I-125 имеет период полураспада 60 дней.
Рис. 9. Брахитерапия, имплантация радиоактивных зерен в простату
Третий этап - постимплантационная дозиметрия и общий контроль расположения источников. Проводится оценка лучевой нагрузки на пораженную ткань и «органы риска»: мочевой пузырь, уретру, прямую кишку. Через 4-6 недель после операции пациенту проводится компьютерная томография предстательной железы с целью дополнительного контроля за расположением источников. Дата добавления: 2015-02-05 | Просмотры: 1151 | Нарушение авторских прав |