|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
M.D.S. Глазные капли
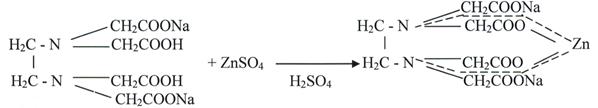
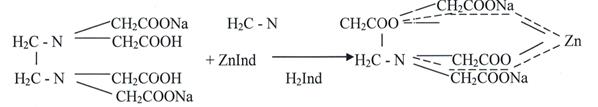
Свойства: Цинка сульфата: Бесцветные, прозрачные кристаллы или мелкокристаллический порошок, вяжущего вкуса, без запаха, при нагревании плавится, при дальнейшем нагревании переходит в твердую массу. Очень легко растворимый в воде, медленно в глицерине, нерастворим в спирте. Водный раствор имеет слабокислую реакцию. На воздухе выветривается. Плотность 3,74 г/см³. Растворимость в воде (%): 29,4 (0 °C), 37,7 (99 °C). Из растворов при температуре ниже 38,8 °C кристаллизуется ZnSO4·7H2O (цинковый купорос), в пределах от 38,8 °C до 70 °C — ZnSO4·6H2O, выше 70 °C образуется моногидрат ZnSO4·H2O. Последний обезвоживается при 238 °C. Сульфат цинка в интервале 100 - 2000 разлагается на ZnO и SOHYPERLINK "https://ru.wikipedia.org/wiki/%D0%9E%D0%BA%D1%81%D0%B8%D0%B4_%D1%81%D0%B5%D1%80%D1%8B(VI)"3. Слабые растворы сульфата цинка мутнеют при гидролизе вследствие выделения осадка 3Zn(OH)2·ZnSO4·4H2O. Получение: Получают путем растворения цинка или его оксида в разбавленной серной кислоте. Затем производят соответствующую очистку. Zn + H2SO4 →ZnSO4 + H2↑ ZnО + H2SO4 →ZnSO4 + H2О Подлинность: 1. С ферроцианидом калия образует белый студенистый осадок, не растворяется в разведенной хлороводородной кислоте. 3 ZnSO4 + 2K4 [Fe(CN)6] → K2Zn3 [Fe(CN)6]2↓ + 3K2SO4 желтая кровяная соль 2. С сульфидом натрия образует белый осадок, нерастворимый в уксусной кислоте, легко растворим в разведенной хлороводородной кислоте. ZnSO4 + Na2S → ZnS↓ + Na2SO4 3. С хлоридом бария образует белый осадок, нерастворимый в разведенных кислотах и щелочах. ZnSO4 + BaCI2 → BaSO4 4↓ + ZnCl2 Количественное определение: • Комплексонометрический метод. Точную навеску препарата растворяют в воде, прибавляют аммиачно – буферную смесь, индикатор – кислотный хром темно – синий и титруют 0,05 М раствором трилона Б до синего окрашивания. 1. ZnSO4 + Ind →[Zn· Ind] + H2SO4 Комплексное соединение неустойчивое, растворимое в воде, вишнево – красного цвета.
2.
3.
динатриевая соль этилендиаминтетрауксусной кислоты Э=Mr/2
• Йодометрия. Метод основан на восстановлении феррицианида калия йодидом калия до ферроционида. Последний, реагирует с ионом Zn2+,образуют нерастворимую комплексную соль, а присутствие SO42- ионов предотвращает обратимость реакции:
K3[Fe(CN)6 ] + 2KI →2K4[Fe(CN)6 ] + I2
Выделившееся эквивалентное количество йода титруют натрия тиосульфатом с индикатором - крахмал:
I2+2Na2S2O3→2NaI+Na2S4O6
Расчет: Vср = 0,69 Х = 0,00719*0,69*10/2 = 0,0248 Допустимые отклонения: 0,025±15% (0,021525 - 0,02875)
Вывод: Данная лекарственная форма удовлетворяет требованиям приказа №305 от 16.10.1997г.
Дата добавления: 2015-12-15 | Просмотры: 876 | Нарушение авторских прав |