|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Химический анализ №12Rp.:Sol. Calcii chloridi 1% - 200ml.
Описание: Кальция хлорид (CaCl2) - бесцветные призматические кристаллы без запаха, горько-соленого вкуса, очень гигроскопичные, расплавляются на воздухе, переходя при 34°С в дигидрат. Очень легко растворим в воде, легко растворим в спирте. Растворы нейтральной реакции. При растворении сильно охлаждают растворы.
Подлинность: Ca2+: 1) Кристаллы вещества внесенные в бесцветное пламя горелки, окрашивают его в кирпично-красный цвет. 2) Проводят реакцию с оксалатом аммония в нейтральной или уксуснокислой среде: CaCl2 + (NH4)2C2O4 + CH3COOH → CaC2O4↓ + 2 NH4Cl белый 3) С натрия сульфатом соли кальция образуют белый осадок кальция сульфата: CaCl2 + 2 Na2SO4 → CaSO4↓ + 2 NaCl белый Cl-: CaCl2 + 2 AgNO3 + HNO3 разв.→ 2 AgCl↓ + Сa(NO3)2 белый Количественное определение: Комплексонометрия, прямое титрование трилоном Б в среде аммиачного буфера. Метод основан на способности ионов кальция образовывать комплексы с трилоном Б. К 1 мл раствора прибавляем несколько капель аммиачного буфера и хроматомного-синего, титруем трилоном Б до перехода окраски раствора из малинового в синий. N CH2COONa N CH2COONa | CH2COOH | CH2COO CH2 CH2 | + CaCl2 → | Ca + 2HCl CH2 CH2 | | N CH2COOH N CH2COO CH2COONa CH2COONa
V = a/T 1,0 – 100,0 a – 1 a = 0,01
T = (C*f*Mr)/1000 T = (0,1 * 0,5 * 219,08)/1000 T = 0,01095г/мл V = 0,01/0,01095 V = 0,913мл К = (V*T/a)*100% K = (0,9*0,01095/1)*100% K = 0,99% (0,99-1)/1*100% = -1% Вывод:Данная лекарственная форма приготовлена удовлетворительно.
Химический анализ №13 Rp: Sol. Laevomycetini 0,25%-10,0 D.S: Глазные капли. Состав: Левомицетина 0,025 Натрия хлорида 0,09 Воды очищенной 10 мл
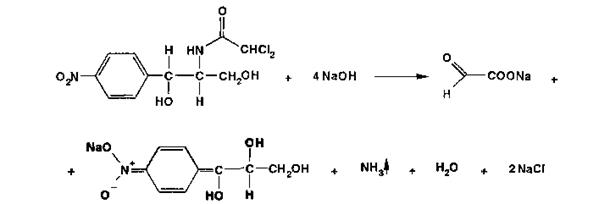
Описание. Левомицетин - белый или белый со слабым желтовато-зеленоватым оттенком кристаллический порошок без запаха, горького вкуса. Мало растворим в воде, легко растворим в 95% спирте, растворим в этилацетате, практически нерастворим в хлороформе. Натрия хлорид- белые кубические кристаллы или белый кристаллический порошок без запаха, соленого вкуса. Растворим в воде, мало растворим в спирте. Подлинность. Левомицетин. К 0,1 г препарата прибавляют 5 мл раствора едкого натра и нагревают; появляется желтое окрашивание, переходящее при дальнейшем нагревании в красно-оранжевое. При кипячении этого раствора окраска усиливается, выделяется кирпично-красный осадок и появляется запах аммиака.
Na+ • Окрашивание пламени горелки в желтый цвет. • С цинкуранил ацетатом, образуется желто-зеленый кристаллический осадок. NaCl+ Zn[(UO2)3(CH3COO)]8 + CH3COOH+ 9H2O → → NaZn[(UO2)3(CH3COO)]9. 9H2O↓+ HCl Cl- К 2 мл раствора добавляем 0,5 мл HNO3 и 0,5 мл AgNO3, образуется белый творожистый осадок, растворимый в растворе аммиака. NaCl + AgNO3 →AgCl↓ + NaNO3
Дата добавления: 2015-12-15 | Просмотры: 1026 | Нарушение авторских прав |