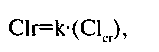|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Контроль концентрации ЛС в клинической практикеСведения о фармакокинетических параметрах ЛС дают возможность определить адекватные пути введения ЛС, режим дозирования, а также внести коррективы для больных с нарушением экскреции ЛС (почечная и печеночная недостаточность).
5Mj ■* Клиническая фармакология и фармакотерапия •> Глава 5 Насыщающая доза. Для многих ЛС известна терапевтическая концентрация в крови, обеспечивающая, с одной стороны, постоянство и должный уровень фармакологического действия, а с другой — отсутствие нежелательных эффектов. Например, в результате клинических исследований стало известно, что терапевтическая концентрация дигоксина составляет 15 мкг/кг, а теофил-лина - 10-15 мкг/мл. В концентрации < 10 мкг/кг теофиллин не оказывает терапевтического действия (расширение бронхов), а при концентрации > 15 мкг/кг отмечается нежелательное действие в виде увеличения числа сердечных сокращений, повышения потребности миокарда в кислороде, могут возникнуть нарушения сердечного ритма, а также тошнота и рвота. Поддерживающая доза. Так как определенная часть препарата постоянно выводится из организма, для поддержания концентрации требуются его повторные введения. Если период полуэлиминации равен 40 ч (дигоксин), то поддерживающая доза будет равна 0,45 мг (т.е. 0,5 насыщающей дозы) каждые 40 ч или (чтобы обеспечить более постоянный уровень концентрации в крови) (0,45 мг • 24 ч)/40 ч = 0,27 мг каждые 24 ч. В другом примере насыщающая доза теофиллина оказалась равной 200 мг, а Т1/2 для этого ЛС равен 6 ч (от 3 до 9 ч). Следовательно, каждые 6 ч больной должен дополнительно получить примерно 100 мг теофиллина. Однако Т1/2 теофиллина неодинаков для всех больных, например у детей он равен 3,5 ч, у курильщиков — 5,5 ч (индукция никотином цитохрома Р450 в печени). Заболевания печени и почек, а также прием эритромицина увеличивают Т1/2 до 20 ч, поэтому в каждом случае потребуется коррекция поддерживающей дозы. Дозы ЛС п р и почечной недостаточности. Как уже было сказано, заболевания почек с их функциональной недостаточностью существенно влияют на фармакокинетику ЛС. Более того, повышение концентрации некоторых ЛС у больных с хронической почечной недостаточностью может привести к усилению их действия и появлению нежелательных эффектов. Универсальным показателем СКФ является клиренс креатинина. Для ЛС, выделение которых происходит в основном благодаря клубочковой фильтрации, между клиренсом ЛС и клиренсом креатинина существует прямо пропорциональная зависимость:
где к — константа пропорциональности, С1сг — клиренс креатинина. Таким образом, количество выделяемого ЛС в процентах общей дозы ЛС за единицу времени равно: Выделение ЛС (%) = выделение ЛС через почки (%) + выделение ЛС другими путями (%) или выделение Л С (%) = k-(Gcr) + выделение ЛС другими путями (%). Пример расчета: гентамицин (антибиотик с выраженным токсическим действием на почки) выводится практически только путем клубочковой фильтрации, и лишь 2% его количества удаляется из организма, минуя почки. Константа пропорциональности клиренса креатинина и клиренса гентамицина составляет 0,3. Как должна измениться доза гентамицина у больного с хронической почечной недостаточностью (клиренс креатинина - 20 мл/мин)? Фарчакокюштнка <■ 75 У здорового человека доля гентамицина, выделяемая за сутки из организма, составляет: (100 мл/мин • 0,3) + 2% = 32% содержания гентамицина в крови. При снижении клиренса креатинина до 20 мл/мин эта величина составит: (20 мл/мин • 0,3) + 2% = 8%. Выведение гентамицина у больного с хронической почечной недостаточностью будет происходить в 32%: 8% = 4 раза медленнее, следовательно, поддерживающую дозу этого препарата следует уменьшить в 4 раза по сравнению с обычной. Другой пример: дигоксин выводится из организма как почками, так и (на 14%) печенью. Константа пропорциональности клиренса креатинина и клиренса дигоксина составляет 0,2. Как следует изменить поддерживающую дозу дигоксина у больного с хронической почечной недостаточностью (клиренс креатинина = 20 мл/мин)? У здорового человека доля дигоксина, выделяемая за сутки, составляет: (100 мл/мин • 0,2) + 14% = 34% содержания дигоксина в крови. При снижении клиренса креатинина до 20 мл/мин эта величина составит: (20 мл/мин • 0,2) + 14% = 18%. Таким образом, в рассмотренном примере дозу дигоксина нужно уменьшить в 34%: 1 8 % = 1, 9 раза. В общем случае при хронической почечной недостаточности предпочтение отдают тем ЛС, которые выводятся из организма преимущественно печенью. Представление о фармакокинетических параметрах ЛС позволяет предсказать концентрацию ЛС в плазме в любой момент, хотя в ряде случаев результаты могут оказаться неточными. Например, больной несистематически принимал назначенное ЛС (пропуски в приеме ЛС, ошибки в дозах) или на концентрацию ЛС влияли факторы, не поддающиеся математическому моделированию (одновременный прием нескольких препаратов, различные заболевания, способные изменять показатели фармакокинетики). В связи с этим часто приходится прибегать к экспериментальному исследованию концентрации ЛС в крови. Необходимость экспериментальных исследований возникает также при внедрении в клиническую практику новых ЛС или их форм, а также при исследовании биоэквивалентности препаратов от различных производителей. В клинической практике концентрацию ЛС измеряют в основном когда: — концентрация в плазме четко коррелирует с клиническим эффектом ЛС, но его эффективность трудно оценить клинически, например если препарат назначают для профилактики редких проявлений заболевания (эпилептический припадок или пароксизм аритмии). В этих случаях целесообразнее однократно оценить уровень концентрации ЛС, чем ожидать клинического эффекта или неудачи лечения неопределенно долгое время. В ряде случаев оценка клинического эффекта может быть затруднена из-за неадекватного контакта с больным; — трудно различить клиническое и нежелательное действие одного и того же средства. Например, дигоксин, назначенный для профилактики аритмий, при превышении терапевтической концентрации сам способен вызвать аритмию. В этом случае тактика дальнейшего лечения (отмена дигоксина или уве- 76 ♦ Клиническая фармакология и фармакотерапия * Глава 5 личение его дозы для достижения большего антиаритмического эффекта) полностью зависит от концентрации препарата в крови; — препарат вызывает потенциально опасные побочные эффекты (ами- - передозировка ЛС (для оценки тяжести и выбора тактики лечения); — нарушения метаболизма или элиминации ЛС (печеночная недостаточ Необходимости в исследовании концентрации ЛС нет, если: - ЛС представляется вполне безопасным и обладает большим терапевтическим диапазоном; - эффект ЛС легко поддается клинической оценке; — эффект ЛС мало зависит от концентрации и/или долго продолжается - действие ЛС происходит в результате образования активных метаболитов; — для действия препарата более важна тканевая концентрация (антибио В последнее время появилась возможность оценить эффективность лечения, исходя из концентрации ЛС в моче (антибиотики при мочевой инфекции), мокроте, а также концентрации ЛС непосредственно в тканях и органах человека, определенной радионуклидными методами. Однако эти способы исследования фармакокинетики используются только в научных исследованиях и пока не введены в клиническую практику. Дата добавления: 2015-12-15 | Просмотры: 738 | Нарушение авторских прав |