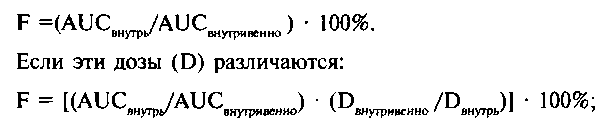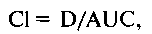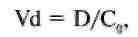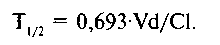|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
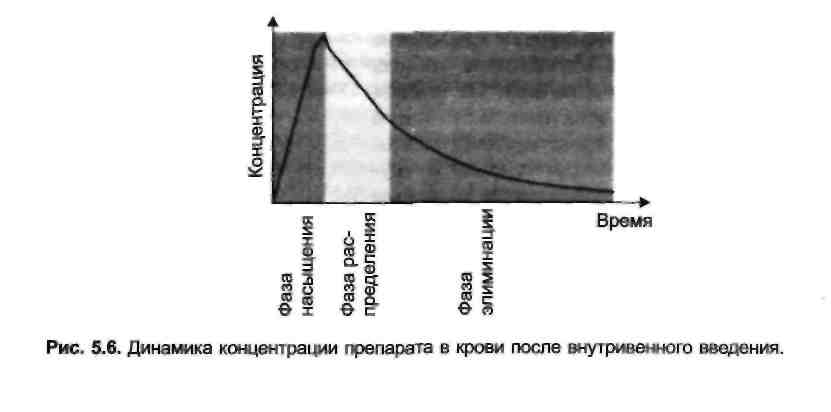
Период полуэлиминации препарата в плазме и его равновесная концентрация.После однократного внутривенного введения ЛС его концентрация в крови быстро (в течение нескольких секунд) повышается. В дальнейшем концентрация быстро снижается вследствие перераспределения ЛС в тканях и жидкостях организма (фаза распределения), которое сменяется более медленным снижением концентрации в процессе экскреции препарата (фаза элиминации) (рис. 5.6). Для анализа особенностей фармакокинетики используют условную модель, в которой организм представлен в виде камеры. ЛС поступает в эту камеру (равномерно распределяясь по всему ее объему) и затем постепенно выводится согласно законам кинетики первого порядка. Понятие камеры условно, так как за ним не стоит какое-либо анатомически ограниченное пространство. В некоторых случаях для фармакокинетических расчетов применяют многокамерные модели, при этом за центральную (обычно меньшую) камеру принимают плаз-
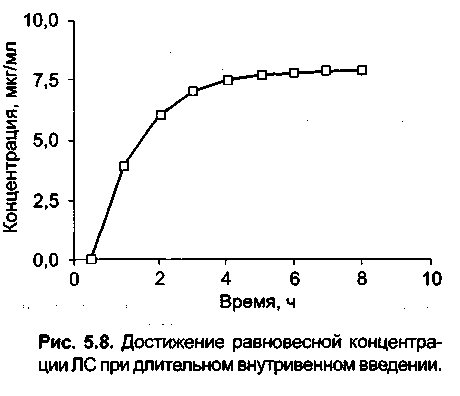
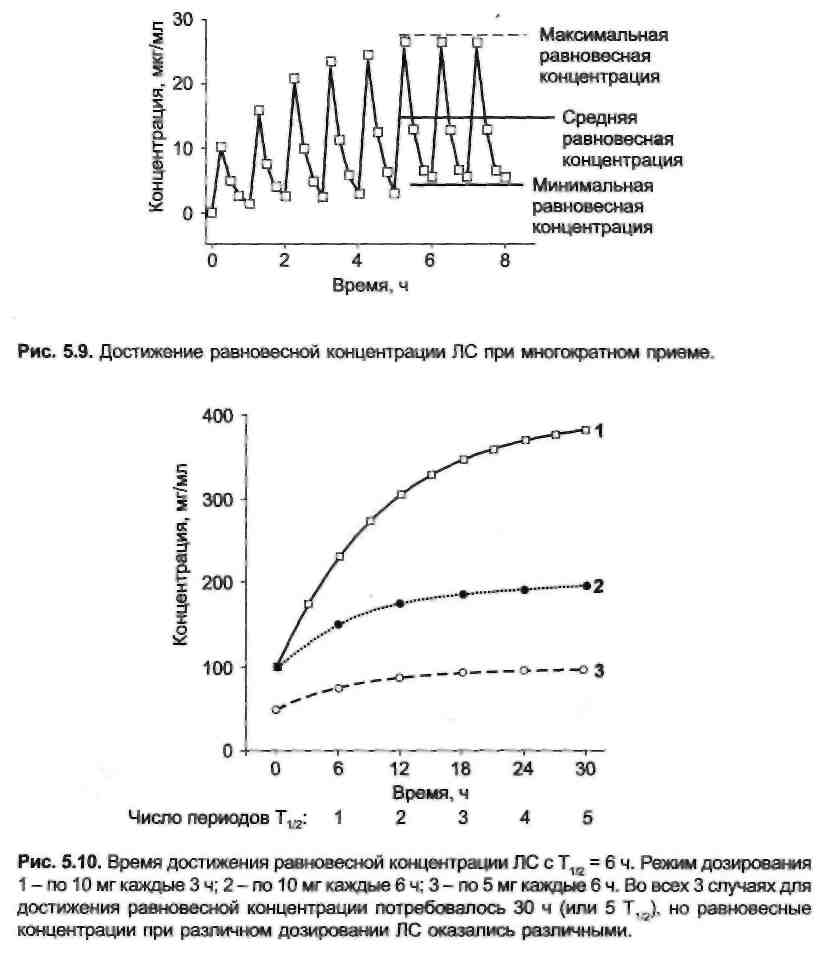
му крови и органы с хорошим кровоснабжением (сердце, легкие, печень, почки,эндокринные железы), за периферическую — органы и ткани (мышцы, кожа, жировая ткань) с низким кровотоком. Однако для практических целей часто бывает достаточно однокамерной модели. В однокамерной модели после введения ЛС начинается его элиминация согласно законам кинетики первого порядка. Снижение концентрации на 50% исходной происходит за равные промежутки времени, получившие название периода полуэлиминации ЛС в плазме (Т1/2) (рис. 5.7). Период полуэлиминации ЛС является наиболее важным из математических параметров, с помощью которых описывается фармакокине-тика ЛС и производятся расчеты концентрации препарата. Несколько другая картина наблюдается при продолжительной внутривенной инфузии или после повторных назначений ЛС (как внутривенно, так и внутрь). В этом случае концентрация препарата повышается линейно при длительной инфузии (рис. 5.8) или скачкообразно при многократных назначениях (рис. 5.9). Концентрация ЛС увеличивается до тех пор, пока не будет достигнуто равновесие между поступлением препарата и скоростью его элиминации. Такое состояние (поступление препарата в организм равно его элиминации) называют равновесным. При назначении препарата в виде отдельных доз колебания концентрации сохраняются и при равновесном состоянии, но средняя концентрация остается неизменной (см. рис. 5.9).
Для достижения равновесной концентрации требуется время, равное 5 периодам полуэлиминации. Время достижения равновесной концентрации зависит только от величины Т1/2 и не зависит ни от дозы ЛС, ни от частоты его назначения (рис. 5.10). При применении различных доз одного и того же препарата равновесие наступает в одно и то же время, хотя равновесные концентрации различаются. Равновесная концентрация ЛС имеет большое практическое значение, так как она обеспечивает постоянство фармакологического эффекта ЛС. Зная величину Т1/2, можно не только рассчитать время наступления равновесного состояния,
но и предсказать снижение концентрации препарата в плазме после прекращения его введения. Препараты с малым Т1/2 (несколько минут) имеют высок у ю управляемость: у ж е спустя 10 мин после отмены добутамина или лидока-ина их концентрация в плазме становится ничтожной и действие прекращается. Понятно, что назначать эти ЛС можно только в виде постоянных внутривенных инфузий. Препараты с длительным периодом полуэлиминации (фенобарбитал - 85 ч, дигитоксин - 1 5 0 ч, амиодарон - 7 0 0 ч) сохраняют свои эффекты даже через несколько суток после прекращения их введения, что следует учитывать при их назначении. Например, после отмены барбитуратов или бен- Фармако кинетика ♦ 59 зодиазепинов несколько суток сохраняются снижение внимания и сонливость, что заставляет на это время отказаться от управления автомобилем и выполнения точной и ответственной работы. Если после достижения равновесного состояния потребовалось увеличить или уменьшить дозу ЛС, равновесие нарушается. Концентрация препарата в плазме изменяется (уменьшается или увеличивается) до тех пор, пока равновесие не будет достигнуто вновь, но уже на другом уровне концентрации. Для достижения нового равновесия также требуется время, равное 5 периодам полуэлиминации препарата. Естественно, что быстрая реакция организма больного на увеличение или уменьшение дозы возможна только при коротком периоде полуэлиминации Л С (хорошо управляемые средства). Иногда равновесная концентрация может изменяться, даже если режим дозирования ЛС не менялся. Например, при использовании аминогликозид-ных антибиотиков возможно развитие почечной недостаточности (побочный эффект Л С этой группы), при этом скорость элиминации Л С уменьшается, а их концентрация в плазме возрастает (возрастает и токсическое действие препаратов). Известны ЛС, которые вызывают индукцию (усиление активности) или ингибирование (подавление активности) ферментов микросомального окисления в печени. Так, например, на фоне применения циметидина или эритромицина (ингибиторы цитохрома Р 450) концентрация теофиллина в плазме может существенно увеличиваться. Показатель Т1/2 является одним из важнейших фармакокинетических параметров. Основываясь на величине Т1/2 можно рассчитать время наступления равновесного состояния, время полной элиминации препарата или предсказать концентрацию ЛС в любой момент (если препарат обладает кинетикой первого порядка). Однако существуют и другие фармакокинетические параметры, речь о которых пойдет ниже: — максимальная концентрация (С^). Применение препарата безопасно только тогда, когда величина Ста1 находится в пределах терапевтического диапазона для данного ЛС; — время наступления максимальной концентрации (Т), часто (но не всегда) совпадает с максимумом фармакологического действия" Л С при однократном назначении;
- площадь под фармакокинетической кривой (AUC) - величина, пропорциональная общему количеству препарата в системном кровотоке; - биодоступность (F) - доля препарата (% обшей дозы), достигшая системного кровотока. При внутривенном введении весь препарат достигает системного кровотока, о биодоступности говорят лишь тогда, когда препарат назначают каким-либо другим путем (внутрь, внутримышечно, ректально и т.д.). Эта величина определяется как отношение AUC после внесосудистого введения к AUC после внутривенного введения. При одинаковых дозах, принятых внутрь и введенных внутривенно:
60 -Ф- Клиническая фармакология и фармакотерапия ■*■ Глава 5 — биоэквивалентность - сравнительная величина, которая показывает различия в биодоступности различных лекарственных форм (таблетки и сироп) одного и того же ЛС или форм ЛС, выпускаемых различными фирмами; — общий клиренс (С1) - объем плазмы или крови, который полностью очищается от препарата в единицу времени. Этот параметр отражает элиминацию препарата из организма и выражается в миллилитрах в минуту или в литрах в час. Клиренс можно выразить как:
где D - доза, AUC - площадь под фармакокинетической кривой. Выведение ЛС в основном осуществляют почки и печень, поэтому общий клиренс представляет собой главным образом сумму почечного и печеночного клиренса (под печеночным клиренсом подразумевается метаболический клиренс в печени и выведение препарата с желчью). Например, почечный клиренс циметидина составляет около 600 мл/мин, метаболический - 200 мл/мин и желчный - 10 мл/мин, следовательно, общий клиренс равен 810 мл/мин. Другие пути выведения или внепеченочный метаболизм не имеют существенного практического значения и при расчете общего клиренса во внимание обычно не принимаются. Величину клиренса в основном определяют функциональное состояние основных систем организма и объем и скорость кровотока в органе. Например, клиренс лидокаина, который интенсивно метаболизируется ферментами печени, зависит прежде всего от скорости его доставки к печени, т.е. от объема притекающей к печени крови. При снижении печеночного кровотока на фоне сердечной недостаточности клиренс лидокаина снижается. В то же время клиренс других препаратов может зависеть в основном от функционального состояния метаболизирующих ферментов. При поражении гепатоцитов (гепатит, цирроз) клиренс ЛС будет резко снижаться, а концентрация в крови — возрастать; - объем распределения (Vd) - это гипотетический объем жидкости организма, необходимый для равномерного распределения всей введенной дозы ЛС в концентрации, аналогичной концентрации в плазме крови. Таким образом:
где D — доза, С() - начальная концентрация. Высокие значения объема распределения свидетельствуют о том, что препарат активно проникает в биологические жидкости и ткани. Если препарат активно связывается (например, жировой тканью), его концентрация в крови может быть очень низкой, а объем распределения будет достигать нескольких сотен литров, намного превышая реальный объем организма человека. В связи с этим Vd также называют кажущимся объемом распределения. На основании объема распределения можно рассчитать нагрузочную дозу, т.е. дозу, необходимую для создания эффективной концентрации ЛС в крови (чем больше Vd, тем большей должна быть нагрузочная доза: L)=Vd,C). Объем распределения зависит от многих факторов (молекулярная масса ЛС, его ионизация и полярность, растворимость в воде и жирах). Возраст, пол, беременность, общее количество жира в организме также влияют на ве- Фармакокинетика •*• 61 личину объема распределения. Объем распределения изменяется при некоторых патологических состояниях, особенно при заболеваниях печени, почек и сердечно-сосудистой системы. Существует взаимосвязь м е ж д у периодом полуэлиминации, объемом распределения и общим клиренсом, которая выражается формулой:
Уровень равновесной концентрации (Css) также можно рассчитать математически. Ее величина прямо пропорциональна дозе ЛС [вернее, произведению дозы на биодоступность (F), т.е. реальному количеству препарата, поступившему в организм] и величине Т1/2. Css обратно пропорциональна объему распределения: Css - 1-44FDТ'-'. Vd*t где t — интервал времени. Дата добавления: 2015-12-15 | Просмотры: 1107 | Нарушение авторских прав |