|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
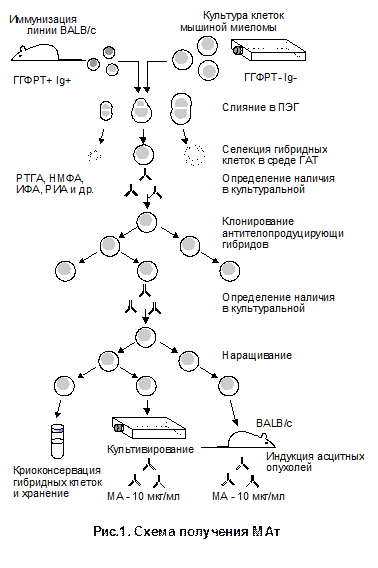
Основные принципы получения моноклональных антител.В основу метода наработки МАт положена способность нормальных плазматических клеток иммунного организма сохранять продукцию антител после слияния с перевиваемыми опухолевыми клетками. В результате образуется популяция гибридных клеток (гибридом), которой родительские селезеночные клетки передали способность вырабатывать специфические антитела, а родительские миеломные – способность к неограниченному росту и индукции асцитных и солидных опухолей. В настоящее время предложено несколько модификаций метода получения гибридом, но все они сводятся в целом к проведению следующих этапов (рис.1): · иммунизация животных; · слияние иммунных лимфоцитов животных с миеломными клетками; · селекция гибридных клеток; · наращивание клонов и скрининг их на способность продуцировать специфические антитела; · клонирование гибридом и наращивание клонов гибридом в культуре и организме сингенных мышей; · изучение свойств полученных МАт. Большое значение при получении гибридом придается опухолевой линии клеток – одному из партнеров, участвующему в гибридизации, – которая должна отвечать определенным требованиям. Существует ряд критериев для выбора опухолевой линии клеток в качестве партнера для слияния.
Во-первых, природа клеток должна быть такова, чтобы объединение их хромосом с хромосомами нормальных лимфоцитов не сопровождалось дисфункциональными расстройствами биосинтеза антител. Этому требованию лучше всего удовлетворяют генетически (т.е. сингенные) и эпигенетически (т.е. клетки того же типа тканевой дифференцировки) родственные клетки. Для В-лимфоцитов таковыми являются плазмацитомы (миеломы), а для Т-лимфоцитов – Т-лимфомы. Во-вторых, они должны легко расти в культуре in vitro, иметь время генерации около 12 часов и, по возможности, пролиферировать на минимальных питательных средах. В-третьих, желательно, чтобы опухолевые клетки-партнеры были способны расти в брюшной полости сингенных животных, обеспечивая по этому признаку хорошую наследственность гибридным клеткам в плане получения асцитов, как источника больших количеств МАт. В-четвертых, они должны обладать высокой гибридизуемостью, обеспечивая частоту гибридизации около 10–2 (т.е. каждая сотая клетка из общей смеси должна давать жизнеспособный гибрид). И, наконец, опухолевые клетки должны быть мутантны по определенным генам, контролирующим экспрессию жизненно-необходимых ферментов, для того, чтобы опухолевый партнер по гибридизации наверняка погибал на специальных селективных средах и не маскировал рост гибридов. Наиболее широко используемый метаболический дефект – отсутствие фермента гипоксантин-гуанини-фосфорибозилтрансфераза (ГГФРТ). В клетках млекопитающих существует два пути синтеза нуклеотидов – основной, при котором нуклеотиды синтезируются de novo из аминокислот и углеводов, и запасной, так называемый метаболический шунт, для которого характерно использование предшественников пуринов – гипоксантина и тимидина. Синтез нуклеотидов по второму пути может происходить лишь в том случае, когда в клетках присутствует фермент ГГФРТ. Этот фермент обеспечивает включение в ДНК и РНК и таких антиметаболитов, как 8-азагуанин или 6-тиогуанин, что приводит клетку к гибели. Поэтому, если опухолевые клетки культивировать на среде, содержащей 8-азагуанин, то смогут выжить только мутанты, у которых отсутствует функционально активная ГГФРТ. Этот простой прием широко используется для получения опухолевых клеточных линий – партнеров для гибридизации. Клетки таких линий способны расти, синтезируя свои нуклеотиды de novo из углеводов и аминокислот. Аналог фолиевой кислоты аминоптерин блокирует синтез de novo. Однако клетки, имеющие ГГФРТ и его субстраты – гипоксантин и тимидин, сохраняют жизнеспособность в присутствии аминоптерина. Поэтому гибридные клетки, вобравшие в себя геном нормального лимфоцита, содержащий нормальный ген ГГФРТ, выживают в отличие от родительских опухолевых клеток на селективной среде, содержащей гипоксантин-аминоптерин-тимидин (НАТ). Второй партнер по гибридизации – лимфоциты, как правило, в культуре не размножаются и отмирают через 7-14 дней. В настоящее время существует множество различных типов маркированных (дефектных по ГГФРТ) миеломных линий клеток лабораторных животных (мышь, крыса) и человека. Наиболее широкое распространение получили мышиные миеломы в основном генотипа ВАLB/с (табл. 2). Большинство из них являются субклонами давно известной миеломной линии Р3-Х63. В 1978 г. Г. Келер с сотрудниками получили несекретирующую иммуноглобулины линию NS1/1Ag4.1, а Шульман с сотрудниками из гибридного клона Sp 2/HLGK, секретирующего МАт к эритроцитам барана, получили линию Sp 2/0-Ag 14.1, обладающую повышенной гибридизуемостью и пролиферативной активностью. В 1979 году исследователями из ФРГ получена миеломная линия P3-X63-Ag8.653, ставшей одной из самых популярных в мире линий, используемых для гибридизаций. В 1983 г. сотрудниками фирмы «Nunclon» Таггортом и Сальмофом получена миелома FOX-NY. Эта линия является дефектной по двум ферментам: ГГФРТ и АФРТ (аденин-фосфорибозилтрансфераза), поэтому при слиянии со спленоцитами от Робертсоновских мышей RB (8.12), у которых активный локус тяжелой цепи IgG на 12-й хромосоме и селективный локус ферментного маркера АФРТ на восьмой генетически связаны, дальнейшая селекция может проводиться как на среде НАТ, так и на среде, содержащей азасерин, который блокирует синтез пуринов de novo в клетках, дефектных по АФРТ. Причем гибридомы, полученные селекцией по АФРТ, более стабильны и в 100% случаев являются антителопродуцентами, поскольку несекретирующие антител гибриды, погибают в селективной среде в связи с транслокацией 8 и 12 хромосом. Правильный выбор и подготовка опухолевой линии клеток для слияния является безусловно ответственным моментом, однако подготовка иммунных лимфоцитов – второго партнера по гибридизации имеет не менее важное значение при получении МАт. . Миеломные линии, используемые для получения гибридом
Дата добавления: 2015-12-16 | Просмотры: 698 | Нарушение авторских прав |