 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Перспективы лечения наследственных болезней. Генотерапия. Медико-генетическое консультирование.известно около 2000ген заб. Изучение и возможное предотвращение последствий ген дефектов Ч — предмет мед Г. Наследственные болезни можно подраздёлить на 3 гр: болезни обмена веществ (альбинизм, алкаптонурия, тирозиноз, фенилкетонурия), молекулярные болезни, кот вызываются генными мутациями (гемоглобинопатия), и хромосомные болезни (тип нас заб связан с изменениями числа или структуры хромосом). Моносомия всего организма для Х-хромосомы (синором Щерешевского). Женщины-трисомики с кариотипом 47, XXX нормальны в умственном и физическом отношении, плодовиты и не обнаруживают отклонений в половом развитии. С увеличением числа Х увеличивается частота отклонения от нормы: умственная неполноценность, аномалии зубов, нарушения формы черепа, изменения других частей скелета, нарушение:системы половых органов. Различные комбинации Х- и У-хромосом при полисемии по половым хромосомам, кроме ХУУ, объединяют под общим названием синдрома Клайнфельтера. Из числа аутосомных болезней наиболее подробно изучена трисомия по 21-й хромосоме, или синдром Дауна. Меры, принятые при раннем выявлении наследственных болезней, могут предотвратить их развитие. Диетологические меры позволяют избежать патологических последствий, например при галактоземии, фенилкетонурии и других наследственных болезнях обмена. Плейотропия, специфические проявления мутантных признаков характерны для наследственной изменчивости, говорить об излечении нельзя, поскольку причина болезни — изменение генетического материала. пренаталъная диагностика, метод амниоцентеза (можно опр более 100 хромосомных и генных аномалий в первые недели беременности, возможно прерывание беременности.) Выяснение метаболических и молекулярных причин наследственного заболевания дает возможность компенсировать дефект в порядке модификационных изменений — фенокопировать норму. (при гемофилииА синтетич фактор свёрт кр VIII,ген его рекордно большой, след ввели выделенный по частям и сшитый из кусочков в кл китайского хомячка) Выделение и клонирование нормальных генов человека все больше позволяет надеяться на то, что возникнет новая отрасль медицины — генотерапия. Генотерапия позволит заменять дефектные гены нормальными и тем самым устранять причину болезни, а не ее симптомы. Медико-генетическое консультирование определение гетерозиготного носительства, т. е. выявление в популяции индивидуумов, которые сами не страдают от наследственного заболевания, но гетерозиготны по рецессивной мутации, которая способна его вызвать. вычислить вероятность появления у них потомка — гомозиготного по рецессивной аллели. 38 Близнецовый метод в генетике человека. Моно‑ и дизиготные близнецы. Конкордантность и дискордантность. Близнецовый метод — изучение генотипических и фенотипических особенностей однояйцевых и разнояйцевых близнецов. Результат изучения — определение относительного значения наследственности и окружающей среды в формировании и развитии человеческого организма. Монозиготные близнецы образуются из одной зиготы, разделившейся на стадии дробления на две (или более) части. Они обладают одинаковыми генотипами. Монозиготные близнецы всегда одного пола. Дизиготные близнецы развиваются в том случае, если одновременно две яйцеклетки оплодотворены двумя сперматозоидами. Естественно, дизиготные близнецы имеют различные генотипы. Они сходны между собой не более, чем братья и сестры, т.к. имеют около 50 % идентичных генов. Общая частота рождения близнецов составляет примерно 1 %, из них около 1/3 приходится на монозиготных близнецов. Известно, что число рождений монозиготных близнецов сходно в разных популяциях, в то время как для дизиготных это число существенно различается. Например, в США дизиготные близнецы рождаются чаще среди представителей негроидной расы, чем среди представителей европеоидной расы. В Европе частота появления дизиготных близнецов составляет 8 на 1000 рождений. Однако в отдельных популяциях их бывает больше. Самая низкая частота рождения близнецов присуща монголоидным популяциям, особенно в Японии. Полагают, что многоплодие генетически обусловлено. Однако это справедливо лишь для дизиготных близнецов. Факторы, влияющие на частоту рождения близнецов, в настоящее время мало изучены. Есть данные, показывающие, что вероятность рождения дизиготных близнецов повышается с увеличением возраста матери, а так же порядкового номера рождения. Влияние возраста матери объясняется, вероятно, повышением уровня гонадотропина, что приводит к учащению полиовуляции. Имеются также данные о снижении частоты рождения близнецов почти во всех индустриальных странах. Отмечается, что частота врожденных уродств у близнецов, как правило, выше, чем у одиночно рожденных. Основоположник близнецового метода – Ф. Гальтон, который предложил сравнивать близнецов для выяснения влияния наследственности на проявление признаков. Близнецовый метод основан на 3 положениях: 1. ОБ имеют идентичные генотипы, а РБ – различные генотипы. 2. Среда, в которой развиваются близнецы и под действием которой появляются различия признаков ОБ, может быть одинаковой и неодинаковой для одной и той же пары ОБ. 3. Все свойства организма определяются взаимодействием генотипа и среды. ОБ и РБ обычно сравнивают по ряду показателей на большом материале. На основе полученных данных вычисляют показатели конкордантности(частоты сходства) и дискордантности(частоты различий). Данные показывают, что у ОБ конкордантность значительно выше, чем у РБ, однако степень сходства различных признаков варьирует. Н=(М%-Д%)/(100-Д%), где Н – доля наследственности, М – конкордантность у ОБ, Д – конкордантность у РБ.
39. В настоящее время ген определяют как структурную единицу генетической информации, далее неделимую в функциональном отношении. Ген представлен участком молекулы ДНК (реже РНК). Понятие гена как дискретной единицы, выявляемой менделевским гибридологическим анализом, ввел В. Л. Иоганнсен в 1909 году. Т. Х. Морган 1926 “Теория гена”: ген это – 1. единица мутации, т. е. Ген изменяется как целое 2. ед. рекомбинации, т.е. кроссинговер никогда не наблюдается в пределах гена 3. ед. функции, т.е. все мутации гена нарушают одну и ту же генетическую ф-ю, что выражается в их некомплементарности у особей F1 при попарном скрещивании мутантов. Геномика – наука о геноме. Геном – вся совокупность генов (бывает ядерный, пластидный, митохондриальный геном). Геномика бывает: 1. Структурная – структурная организация генома в целом 2. Функциональная 3. Эволюционная Геном состоит из: · Гены 3-5% · Подвижные элементы 20-45% · Сателлитные ДНК, микросателлитные ДНК Метод Microarray – изучает экспрессию всех генов.
40. Трансформация (ТФ) Трансформация баков - перенос ДНЛ, изолированной из одних клеток в другие. При ТФ ДНК, выдел. из кл. одного штамма, поглощают кл. др. штамма - реципиента. С пом. генет. маркеров об этом м. судить по измен. фенот. реципиента. ТФ не возможна у некот. бактерий: Diplococcus, Hemophilus, Neisseria, Bacillus, актиномицетов, циано-бакт. Лучше всего изуч. у D/ pneumonia, B. subtilis, H. influenzae. Для того чтобы ДНК проник. в бак. кл, кл. долж наход. в сост. компетентности. Компет-сть приобрет. лишь частью кл. обыч. в серед. логарифмической стад. роста (способ. особ. белок)(если есть хлорамфеникола – ингибитор. белк. синтеза комп. не разв; добавл. антибиотик к компетентн.- не подавл.). => белок, стим. комп-сть, вырабат. в ходе роста. ДНК связ. с -тью компет. кл,эта ДНК имеет Mr= 1 • 107 Д, 0,5 % бак. хромос..-> связан. ДНК расщепл. спец. нуклеазами до фрагмент. с Mr= 4—5- 106Д. -> Фрагменты ДНК проник. в кл. Некот. (пневмококки) могут неспец. поглощать ДНК из разл. источн. Некот (Hemophilus) поглощ. лишь свою(гомологическую ДНК). Фрагменты менее 5- 105 Д в клетку не проникают. В баке 2цепоч. ДНК превращ. в 1цепоч.: 1 нить деградирует. На заключительной стадии происх. интеграция 1цепоч. трансформирующего фрагмента с ДНК клетки-реципиента. Репликация не треб.,включаемый фрагм. физич. объед. с ДНК реципиента. Весь процесс 10—30 мин. Частота 1 %. Для некот. бак. показ. ТФ в естеств. усл. (в инфицир. жив. Diplococcus, в культуре - для Bacillus subtilis.) =>ТФ естеств. биологический процесс. В то же время в последние годы в связи с развитием генной инженерии широко применяется плазмидная, или векторная, трансформация, которая заключается во введении в кл. бакт., а также эукариот генов, интегрирован. в естеств. или искусств. плазмиды.
41-42. Трансдукция(ТД) перенос генов из одних бакт. кл. в др. при помощи бактериофага(БФ).В 1951 г. откр. Зиндер. БФ(вирусы бакт.), делят на 2 категор.: вирулентные и умеренные. Вирулен. БФ (фаг), проник. в кл., вызыв. лизис. Умеренные БФ м. вызыв. как литич., так и лизоген. ре-цию. Лизогенн. р-ция: инфицирующ. фаг переход. в сост. профага, кот. воспроизв. синхронно с хромос. бакт. (баки с профагом –лизогенными). Лизоген. баки приобрет. устойчивость к доп. заражению тем же бактериофагом.. Лизогенное сост.устойчиво воспроизв. Профаг теряется с частотой 1 на 105—106 кл. делений. В культурах может происходить индукция бактериофага=> массовый лизис бакт-ий. Такое явление стимулируется: ультрафиол и рентг. лучами, алкилирующими соед-ми. Умерен. фаг м. вызвать и лизогенную реакцию. Завис.от физиол. сост. культуры. Умеренные БФ м. мутационным путем превращаться в вирулентные. Общая, или неспецифическая ТД. ТД осущ. умер. БФ. (Р22 -Зиндер впервые обнаружил транс-дукцию у Salmonella typhimurium) Два штамма это бакт., нуждавш. в ам.к-тах (phe trp tyr + + и - + + + met his) в смешанной культуре на min среду.=> прототрофные колонии с частотой око 1 X 10-4. Для их образования не нужен контакт между клетками, как при конъюгации. Фильтрующийся агент, переносящий гены – умерен. БФ Р22, по кот. был лизогенным один из штаммов. Фаг Р22 мог трансдуцировать любые гены сальмонеллы => общая или неспецифич. ТД. (так. же способн. у Р1 Е. coli - переносит небол. фрагм. хромосомы Е. coli.. Напр. совмест. ТД генов thr и leu 1 % случаев, хотя на ген. карте Е. coli, построенной при конъюгации, эти локусы тесно сцеплены и находятся на расст. 2 % общей длины генома. Общая ТД -следствием включения фрагментов ДНК Е. coli, зараженной фагом Р1, в инфекц. частицы БФ. Такие частицы не сод. или мало фаговой ДНК. => трансдуктан-ты не обладают иммунитетом к фагу Р1. ТД могут осущ. даже вирулентные мутанты Р1. => что ТДющие частицы не способны инициировать норм. цикл развития фага. Иначе кл. д.б. погибнуть. Перенос генов при Общ.ТД привод.: привнесенный ген наследуется стабильно, т.к интегрирует с хромосомой реципиента -полная ТД. При абортивной ТД внесенный фагом фрагмент генома не реплицируется и передается по одной линии при размножении.Т.е одна кл. при делении получает трансдуцированный ген. Так можно трансдуцировать ген, опред. наличие жгутика у S. typhimurium.-подвижность сохраняет только одна клетка. Абортивная чаще, чем полная, иногда в 10 раз. Спец ТД отличается от неспец. тем, что БФ может переносить лишь опред. гены (хар-но для фага λ Е. coli - только гены локуса gal, ответств. за усвоен. галактозы, и bio -синтез биотина). Умерен. БФ λ при лизогенизации Е. coli интегрирует в ее хромосому на участке между локусами gal и bio(конъюгацион/ скрещив/ лизогенных Hfr и нелизогенных F—бакт.. Gal+-трансдукт. возник. I X 10-5 —10-6 (генет. нестабильны, выщепляют клетки Gal-1 с частотой около 2 X 10-3 на кл. деление, т.к. трансдуктанты Gal+ частично гетерозиготны gal/gal+, т. е. несут дополнительный фрагмент gat+ вместе с участком gal реципиента(гетерогенота). При облуч. гетерогенот ультрофиол.-> фаголизаты (частота ТД очень выс.) ½ частиц λ могла передав. признак Gal+при ТД. Фаги из этих лизатов HFT(high frequently ТД). Гены переносят дефектные фаги λ (кот. лизогенизируя бактерии, сообщ. им устойчивость к суперинфекции λ, но баки не продуц. инфекц. частицы БФ. деф. трансдуц. част. λ не образуют стерильных пятен на газоне Е. coli..Самостоятельно не размнож. Требуется фаг-помощник(не спос. к ТД) У дефект. фагов λ gal от 1/4 до 1/3 собств. генома замещ. на gal — участок бактериальной хромосомы. Сайт-специфическая рекомбинация(ССР). Геном фага λ проник. в бак. в линейной форме,на концах ДНК есть липкие концы — однонитевые участки по 12 нуклеотидов, комплементарные друг другу. В клетке ДНК замык. в кольцо-> интегрирует в геном бактерии. Принцип интеграции: кольцо генома λ реципрокно рекомбинир. с кольц. бакт. хром.. Один обмен-> интеграции ДНК фага λ с ДНК бакт.. Интеграция профага может происх. только в одном месте на хромосоме E. coli, названном att A. (attachment site A.). Аналогичный уч. есть в геноме БФ. Рекомбинация происх. в отсут. протяженной гомологии. Общим у фага и бактерии оказался участок в 15 ам.ост. Вырезание (эксцизия) профага из хромосомы-по тому же мех-му реципрокной, сайт-специфической рекомбинации. Как интеграцию и эксцизию профага А, контролируют два фаговых гена: int и xis. ССР- точно, но не безошибочно. 1на 1 млн. при эксцизии профага рекомбинация осуществляется не в аtt, а захватывает участки gal или bio. Так возникают трансдуцирующие частицы, у кот. часть генетического материала профага замещена генами бактерии. В рекомбинацию вовлек. те же 15 пар нуклеотидов, кот. встр. в генах gal и bio. За пределами этих 15 п. н. гомология отсутствует. CCР проводит фермент интеграза, кодируемый локусом int фага λ. Использование в ген. анализе: при картировании 1-2 мин карты, где необх. катрирование по 3 точкам., катрирование на коротких. участках(P1). Об относительном расположении маркеров при ТД судят по частоте совмест. включения в част БФ при селекции трансдуктантов по одному из них (коТД).Аналогично при ТФ.
43.Плазмиды — дополнительные факторы наследственности, расположенные в клетках вне хромосом и представляющие собой кольцевые замкнутые) или линейные молекулы ДНК. Плазмиды способны удваиваться (реплицироваться) автономно, но при этом они эксплуатируют репликационную систему клетки хозяина. Большинство плазмид кодирует специальные белки — инициаторы репликации. Эти белки начинают процесс репликации, который затем подхватывается и продолжается репликационной системой клетки. Для кольцевых плазмид известны несколько механизмов (способов) репликации: - механизм катящегося кольца (rolling cycle) - тетта-механизм (механизм «глазка») - D-механизм Некоторые плазмиды могут с определенной частотой интегрироваться в бактериальный геном и размножаться затем вместе с ним как его составная часть. - R-плазмиды - резистентность. - Hly-плазмиды - гемолизины - Ent-плазмиды - энтеротоксины - Плазмиды бактериоциногении кодируют синтез бактериоцинов — белковых продуктов, вызывающих гибель бактерий того же или близких видов - Плазмиды патогенности контролируют вирулентные свойства многих видов, особенно энтеробактерий - Скрытые (криптические) плазмиды плазмиды не содержат генов, которые можно было бы обнаружить по их фенотипическому проявлению. Плазмиды бывают трансмиссивные и нетрасмиссивные. Трансмиссивные плазмиды (F-плазмиды) более крупные и наряду с генетической областью, контролирующей их репликацию, содержат также так называемую tra-область (tra-оперон). Эта область определяет способность клетки быть генетическим донором, т.е. вступать в конъюгацию с клеткой-реципиентом и передавать ей свой генетический материал (плазмидную либо хромосомную ДНК). Под контролем tra-генов синтезируются F-пили клетки-донора, необходимые для ее конъюгации с клеткой-реципиентом, а также ферменты, обеспечивающие метаболизм ДНК в процессе конъюгации.
44. Коньюгация(К) непосредственный контакт между кл. бактерий, сопровождаемый переносом ген. материала из кл. донора в кл. реципиента. К у бакт. Escherihia coll была открыта в 1946 г. Дж. Ледер-бергом и Е. Тэйту-мом на осн. генетич. подхода. Классические принципы при обнаружении полового процесса у любых микроорганизмов:1. Необходимо работать со штаммами одного вида бакт 2. След. учит. различия по нескол. стабильным признакам. 3. Для получ гибридов или рекомбинантов необх. применять метод селективных сред, для того чтобы регистрировать даже очень редкие события. Взяли два штамма Е. coli, маркированные несколькими мутациями ауксотрофности: (thr leu thi + + и + + + bio met). 1-ый нужд. в thr, leu… Восстановление прототрофности по отдельным признакам, наблюдали с частотой около 1 X 10-7=>штаммы могли бы ревертировать к дик. типу, т. е. к полной прототрофности с частотой 1- 10-14—1 •10-21, если реверсии независимы. Штаммы смешали в жид. полноцен. сред. Смесь высеяли на min среду. Прототрофы появились с частотой 1 •10-7, что превосх. частоту спонтанного ревертирования. => эфф. обусловлен именно совместным инкубированием двух штаммов и явл. каким-то вариант. пол. процесса. Необходимо было выяснить, не трансформация? Обработка 1-ого штамма фильтратом среды, в кот. выращивали др., не приводила к появлен. прототрофов, так же как и выращивание двух штаммов в разных отсеках-U образной трубки, разделенной посередине бактериальным фильтром. Эффект только при непосредствен. контакте бакт. и не подавлялся ДНКазой. Перенос генетического материала от донора к реципиенту. В 1952 г. У. Хейс провел реципрокные скрещивания между штаммами Е. coli, устойчивыми и чувствительными к стрептомицину (Strr и Strs):I StrS thr leu thi + + X Stfr + + + bio met и II Stfr thr leu thi + + X StrS + + + bio met Для учета рекомбинантов смесь кл. высевали на 2 среды: со стрептомицином и без него. 1 скрещ- только на среде без стрептомиц., 2-ое на 2 средах. => для образ рекомбинантов необх. сохранение клеток родителя: thr leu thi + +, кот. обозначили как женский (F-), а штамм + + + bio met — как мужской (F+). Рекомбинация происходит в клетках F- — реципиентах, а клетки F+ — доноры — передают генетический материал в клетки F-. Клетки F- круглые, a F+ — продолговатые. Изолируя кл после ко коньюг., удалось показать, что только в потомстве бакт. F- появляются рекомбинанты.
45. Генетический код и его свойства Генети́ческий код — свойственный всем живым организмам способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов. Триплетность — значащей единицей кода является сочетание трёх нуклеотидов (триплет, или кодон). Непрерывность — между триплетами нет знаков препинания, то есть информация считывается непрерывно. Неперекрываемость — один и тот же нуклеотид не может входить одновременно в состав двух или более триплетов. (Не соблюдается для некоторых перекрывающихся генов вирусов, митохондрий и бактерий, которые кодируют несколько белков, считывающихся со сдвигом рамки). Однозначность (специфичность) — определённый кодон соответствует только одной аминокислоте. (Свойство не является универсальным. Кодон UGA у Euplotes crassus кодирует две аминокислоты — цистеин и селеноцистеин)[1] Вырожденность (избыточность) — одной и той же аминокислоте может соответствовать несколько кодонов. Универсальность — генетический код работает одинаково в организмах разного уровня сложности — от вирусов до человека (на этом основаны методы генной инженерии) (Из этого свойства также есть ряд исключений, см. таблицу в разделе «Вариации стандартного генетического кода» в данной статье). Помехоустойчивость — мутации замен нуклеотидов не приводящие к смене класса кодируемой аминокислоты, называют консервативными. Мутации замен нуклеотидов, приводящие к смене класса кодируемой аминокислоты, называют радикальными. Ф.Крик – гипотеза последовательности – посл-ть эл-тов гена опред. посл-ть АК-ост. в полипепт. цепи. Код триплетен. 4пары осн-й – 4 АК. Если 1АК – 2 пары осн-й, томожно закодировать 16 АК, 1 АК-3 пары – 64 кодона. Ф. Крик: код триплетен; между кодонами нет «запятых», т.е. разделяющих знаков; считывание кода в пределах гена происходит с фиксированной точки в одном направлении. Код неперекрывающийся, т.к. 1 мутация приводит к замене 1АК. Код вырожден. Во многих случаях для кодирования АК существенны две первые позиции кодона. Для восьми АК замена осн-й в третьем положениикодона будет нейтральной: не приведет к замене АК в белке. А в тех случаях, когда это все же произойдет, такая замена не изменит свойства полярности АК. Эти особенности кода, по-видимому, отражают его эволюцию. Все кодоны опознаются антикодонами тРНК, за искл. трех нонсенсов, или бессмысленн. кодонов, они предст. собой знаки терминации трансляции (UAA, UAG, UGA).
46.. Генетические и биохимические доказательства триплетности генетического кода. Эксперимент. док-ва тирплетности кода еще Криком в 1961г. Исп. систему rll фага Т4 и профлавина (производное акридина) в качестве мутагена. Акридин внедряется между осн-ями ДНК, увеличивая расстояние между сосед. осн-ями в 2 раза: с 0.34 до 0.7 нм. Далее такая исскуств. удлиненная ДНК вступает в неравный кроссинговер с интактной мол-лой, в рез-те обр-ся мол-лы с лишней парой осн-й или с делецией пары осн-й. В кач-ве исход. мутанта Крик использ. мутант FCO, индуцированный профлавином и несущий изменения в левой части гена rll B фага Т4. В рез-те спонтанного ревертирования мутанта FCO были получены ревертанты, способные образовывать негативные колонии на штамме E.coli K12. Больш-во этих мут. имели промежуточный фенотип между диким (r+) и мутантным (r). Генет. анализ показал, что ревертанты возникли за счет внутригенных супрессорных мутаций, т.е. повторных мутаций того же гена (rll B). При срещ-ии с фагом д.т. каждый псевдодикий ревертант выщеплял два класса рекомбинантов типа rll. Один нес исходную мутацию FCO, другой – мутации, к-рые супрессировали FCO, но сами по себе тоже приводили к появлению фенотипа rll. Далее у этих рекомбинантов, неущих только супрессор. мут-ии, вновь получили рев-ты псевдодик. типа, тоже супрессор. Новые внутриген. супрессоры втор. порядка отдел. от супрессор. перв. пор., убедились в том, что они тоже приводят к возник-ю мутант. фенотипа, и с двумя из них повтор. процедуру еще раз. В рез-те – 80 независимых мутаций rll, к-рые – супрессоры мут-ии FCO или супр. супр-в этой мут-ии или супр. супр-в мут-ии FCO. Не знали, была ли мут-я рез-том вставки или вып-я осн-й. Условно ей приписали знак “+”, супр-м перв. пор. – знак “-“, втор. пор. – “+”, супр. третьего пор. – “-“. Теперь путем рекомбинации стали объдин. их в одном гене. Оказалось, что при объединении трех мут-ий одинак. знака были получ. фаги псевдодик. типа. Получ. рез-ты подтверд. исходные предположения. Так,если предст. посл-ть пар осн-й: …ABC ABC ABC ABC ABC ABC ABC … считываемая слева направо – участог гена rll, то втсавка лишней пары осн-й исказит записанную информацию вследствие сдвига рамки гипотетического читающего устройства:
… ABC AAB CAB CAB CAB CAB CAB C… Если выпадет пара осн-й вблизи вставки (слева или справа), то за пределами уч., огранич. вставкой или выпадением (прямой мут-й или супр-м) нуклеот. пар, исход. инф-я будет восст. Благодаря сдвигу рамки(сдвигу считывания) в обратн. напр-ии: A B
… ABC AAB CAB CAC ABC ABC ABC…
Очевидно, такое восст-е прежней записи невозм. при двух последоват. втсавках или двух последоват. выпадениях. В то же время три вставки и три вып-я должны нормализовать запись за пред. уч., огранич. крайними мут-ями: A B C
… ABC AAB CAB BCA BCC ABC ABC ABC или
A B C Все подобные рассуждения осн. на том, что ген rllB кодирует белок, что позже док. Кроме того все рассм. взаим-я между мут-ями могли быть только при усл., что левая частьгена может изм-ся без особых нарушений функций генного продукта. Сейчас обнар. в генах ибелках уч., допускающие вариации по составу. Код неперекрывающийся, т.к. 1 мутация приводит к замене 1АК. Если бы код не был вырожденным, между вставкой и выпадением с большой вероятностью должны были возникать бессмысленные триплеты, и тогда нормальное считывание было бы невозможно. Дата добавления: 2015-12-16 | Просмотры: 941 | Нарушение авторских прав |
 A
A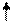
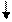

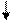

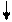
 … ABC BCA BCA CAB ABC ABC
… ABC BCA BCA CAB ABC ABC