|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Схема типичного эксперимента по клонированию ДНК. Общие принципы конструирования рекомбинантных молекул ДНК.Клонирование – процесс получения генетически идентичной группы клеток (клонов), основанный на бесполом размножении одной клетки. Клонирование – процесс получения генетически идентичной группы клеток (клонов), основанный на бесполом размножении одной клетки. Схема типичного эксперимента по клонированию фрагмента ДНК: 1)Получение фрагмента или фрагментов ДНК 2)Конструирование in vitro рекомбинантных молекул (встраивание фрагмента в вектор) 3)Ведение их в клетку 4)Отбор клонов, несущих рекомбинантную молекулу. Суть конструирования рекомбин. ДНК заключается во встраивание фрагментов ДНК, среди кот. находится интересующий нас участок ДНК, в так называемые векторные мол-лы ДНК (векторы) – плазмид. или вирусные ДНК, кот. могут быть перенесены в клетки про- и эукариот и там автономно реплицироваться. На след. этапе проводится отбор тех клеток, кот. несут в себе рекомбинант. ДНК (с помощью маркерных признаков, кот. обладает сам вектор), и затем индивидуал. клонов с интересующим нас сегментом ДНК (используя признаки или пробы специфич. для данного гена или участка ДНК). Существует три основных способа встраивания чужеродной ДНК: 1 случай. 3’-концы фрагментов ДНК, среди кот. находится интересующий нас участок ДНК (ген или его сегмент, регуляторный район), с помощью фермента терминальной нуклеотидилтрансферазы наращиваются гомополинуклеотидной последовательностью (например, поли (Т)). 3’-концы линейной формы векторной ДНК тем же способом наращиваются комплиментарной ей гомополинуклеотидной послед-тью (т.е. поли(а)). Это позволяет соединить две молекулы ДНК путем комплементарного спаривания искусственно полученных «липких» концов. 2 случай. «Липкие» концы создаются с помощью расщеплений мол-л ДНК (как вектор., так и содерж. интересующей нас фрагмент ДНК) одной из эндонуклеаз рестрикции (рестриктаз). Рестриктазы высоко специфичны. Они «узнают» в ДНК последоват-ть из нескольких нуклеотидных остатков и расщепляют в них строго определенные межнуклеотидные связи. Поэтому даже в ДНК больших размеров они вносят ограниченное число разрывов. 3 случай. Смесь 1 и 2ого. Когда «липкие» концы ДНК, обр. рестриктазой удлиняются синтетическими последоват-ми. Концы фрагментов можно превратить в «липкие», наращивая их двутяжевыми олигонуклеотидами («линкерами»), в состав кот. входит участок узнавания рестриктазой. Часто в качестве «линкера» используется полинуклеотидные фрагменты, кот. содержат специф. участки для нескольхих рестриктаз («полилинкер»-сайт множественного клонирования, включает сайты узнавания многих рестриктаз). После встраивания чужеродной ДНК в вектор, их ковалентное сшивание осущ-тся ДНК-лигазой. Если же размер бреши в рекомбинир. мол-ле больше, чем одна фосфодиэфирная связь, то она встраивается in vitro с помощью ДНК-полимеразы или in vivo с помощью репарационной системы.
Принцип конструирования рекомбинантных молекул:
№80. Методы введения рекомбинантных молекул в клетки. 1. Трансформация — процесс поглощения клеткой организма свободной молекулы ДНК из среды и встраивания её в геном, что приводит к появлению у такой клетки новых для неё наследуемых признаков, характерных для организма-донора ДНК. Иногда под трансформацией понимают любые процессы горизонтального переноса генов, в том числе трансдукцию, конъюгацию и т. д. В любой популяции лишь часть бактерий способна к поглощению из среды молекул ДНК. Состояние клеток, при котором это возможно, называют состоянием компетентности. Обычно максимальное число компетентных клеток наблюдается в конце фазы логарифмического роста. Поглощаемая ДНК должна быть двухнитевой (эффективность трансформации однонитевой ДНК на порядки ниже, однако несколько возрастает в кислой среде), её длина — не менее 450 пар оснований. Для некоторых бактерий поглощаемая ДНК должна содержать определённые последовательности. ДНК необратимо адсорбируются на ДНК-связывающем белке, после чего одна из нитей разрезается эндонуклеазой на фрагменты длиной 2—4 тыс. пар оснований и проникает в клетку, вторая полностью разрушается. В случае, если эти фрагменты имеют высокую степень гомологии с какими-либо участками бактериальной хромосомы, возможна замена этих участков на них. Поэтому эффективность трансформации зависит от эволюционного расстояния между донором и реципиентом. Общее время процесса не превышает нескольких минут. Впоследствии, при делении, в одну дочернюю клетку попадает ДНК, построенная на основе исходной нити ДНК, в другую — на основе нити с включённым чужеродным фрагментом (выщепление). 2. Микроинъекции. Принципиальное преимущество микроинъекций в том, что они позволяют эффективно создать трансгенные животные, но их серьезные недостатки: нельзя вводить гены в клетки на более поздних стадиях, в процессе интеграции происходит множество перегруппировок, в геноме оказывается множество копий встраиваемой ДНК, и, наконец, интеграция происходит в произвольное место генома случайным образом. 3. Инфицирование (рекомбинантные фаги и вирусы). ДНК фага встраивается в геном и воспроизводится с каждым циклом репликации. 4. Электропорация. Электропорация – воздействие на клетки электрическим импульсом. При этом в клетках образуются поры, через которые проникает ДНК. 5. Бомбардировка микрочастицами с адсорбированной ДНК. ДНК или РНК преципитируется на микрочастицах золота. Стреляет сжатым гелием, ДНК с носителем находится в микрокапсуле. 6. Липосомы (комплекс ДНК с липидами). Гидрофобная частица, состоящая из двойного слоя липидов,без труда проходит в клетку эндоцитозом. ДНК защищена от разрушения ферментами эндосом. Метод применяется для получения трансгенных животных.
81. Методы получения фрагментов ДНК для клонирования. ПЦР – это один из методов синтеза определенных последовательностей ДНК in vitro. В реакции используются два праймера, которые гибридизуются (отжигаются) с противоположными нитями и фланкируют последовательность ДНК, которую необходимо амплифицировать. Поскольку фрагмент ДНК, синтезированный в данном цикле может служить в качестве матрицы в следующем цикле, то количество копий заданной последовательности ДНК удваивается в каждом цикле. Повторные серии циклов, включающие денатурацию матрицы, отжиг праймеров и их последующее наращивание с помощью ДНК-полимеразы приводят к экспоненциальному накоплению специфического фрагмента ДНК, концы которого заданы 5’-концами праймеров. Синтез кДНК (cDNA) Синтез кДНК – это ферментативный синтез двуцепочечной ДНК с использованием в качестве матрицы поли(А)-мРНК. Первичным субстратом служит биологически активная поли(А)-мРНК, изолированная из эукариотических тканей или культуры клеток и очищенная на олиго (dT)-целлюлозе (афинная хроматография). Обратные транскриптазы Это РНК-зависимые ДНК-полимеразы у некоторых РНК-содержащих вирусов, которые на матрице геномной РНК синтезируют ДНК-копии РНК. Обычно используют обратные транскриптазы, кодируемые вирусом миелобластоза птиц (AMV) или вирусом лейкемии мышей Малони (MMLV).
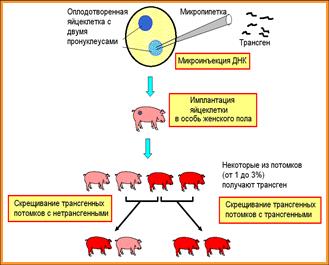
№ 82. Получение трансгенных животных. С помощью микроинъекции ДНК в оплодотворенную одноклеточную яйцеклетку. Рекомбинантную ДНК вводят с помощью микроинъекции в один из пронуклеусов оплодотворенной яйцеклетки. Интеграция трансгена (перенесенного генетического материала) происходит случайно и может привести к нарушению экспрессии генов и быть летальной.Трансген интегрирует только в одну хромосому, поэтому трансгенное животное является гемизиготным. Трансгенные животные как фармацевтические фабрики (биореакторы). Продукция фармацевтически- важного белка (например активатора плазминогена для растворения кровяных тромбов) с молоком трансгенной овцы. Трансгенные быстрорастущие породы лосося были получены введением гена гормона роста под контролем сильного промотора. Все особи одного возраста; вес трансгенных рыб в 11 раз выше веса нетрансгенного контроля.
Дата добавления: 2015-12-16 | Просмотры: 1212 | Нарушение авторских прав |
 79. Понятие о векторах. Требования, предъявляемые к векторам. Векторы клонирования. Вектор (векторная молекула) – молекула ДНК, способная переносить чужеродную ДНК и обеспечивать ее поддержание в реципиентных клетках. Природными векторами являются многие плазмиды и вирусы (фаги). Вектор должен: 1) Автономно реплицироваться в клетках хозяина; 2)иметь селективный маркер (маркеры); 3)иметь уникальный сайт (сайты) клонирования; 4)не утрачивать способности к автономной. репликации в результате инсерции чужеродной ДНК. + доп. Свойства 5) Стабильно поддерживаться в клетках; 6) Быть многокопийным; 7)быть небольшого размера. + Желательно также иметь сайты рестрикции внутри генов устойчивости к антибиотикам (для плазмидных векторов). Векторы классифицируются на две большие группы: по назначению и по происхождению. К первой группе относится векторы общего назначения и специализированные (векторы клонирования, векторы экспрессии, векторы для секвенирования и др.). Ко второй, плазмидые, фаговые (на основе фага λ, на основе однонитевых фагов), + для клеток животных – векторы на основе эукариотических вирусов: ретровирусов, аденовирусов, вируса герпеса.Векторные системы включают в себя: 1)Вектор переноса генов (“челночный вектор”), 2) Вектор амплификации (увеличение числа копий генов)3) Вектор интеграции(включение в хромосому)4) Вектор экспрессии (увеличение активности гена). В технологии рекомбинантных ДНК клонирование – это использование процедур манипулирования ДНК для получения множественных копий гена или фрагмента ДНК. Клонирование достигается с помощью перемещения фрагмента ДНК в векторную молекулу. Поскольку имеет место клонирование в векторе одного фрагмента ДНК, такую технологию называют МОЛЕКУЛЯРНЫМ КЛОНИРОВАНИЕМ.
79. Понятие о векторах. Требования, предъявляемые к векторам. Векторы клонирования. Вектор (векторная молекула) – молекула ДНК, способная переносить чужеродную ДНК и обеспечивать ее поддержание в реципиентных клетках. Природными векторами являются многие плазмиды и вирусы (фаги). Вектор должен: 1) Автономно реплицироваться в клетках хозяина; 2)иметь селективный маркер (маркеры); 3)иметь уникальный сайт (сайты) клонирования; 4)не утрачивать способности к автономной. репликации в результате инсерции чужеродной ДНК. + доп. Свойства 5) Стабильно поддерживаться в клетках; 6) Быть многокопийным; 7)быть небольшого размера. + Желательно также иметь сайты рестрикции внутри генов устойчивости к антибиотикам (для плазмидных векторов). Векторы классифицируются на две большие группы: по назначению и по происхождению. К первой группе относится векторы общего назначения и специализированные (векторы клонирования, векторы экспрессии, векторы для секвенирования и др.). Ко второй, плазмидые, фаговые (на основе фага λ, на основе однонитевых фагов), + для клеток животных – векторы на основе эукариотических вирусов: ретровирусов, аденовирусов, вируса герпеса.Векторные системы включают в себя: 1)Вектор переноса генов (“челночный вектор”), 2) Вектор амплификации (увеличение числа копий генов)3) Вектор интеграции(включение в хромосому)4) Вектор экспрессии (увеличение активности гена). В технологии рекомбинантных ДНК клонирование – это использование процедур манипулирования ДНК для получения множественных копий гена или фрагмента ДНК. Клонирование достигается с помощью перемещения фрагмента ДНК в векторную молекулу. Поскольку имеет место клонирование в векторе одного фрагмента ДНК, такую технологию называют МОЛЕКУЛЯРНЫМ КЛОНИРОВАНИЕМ.