 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
АРОМАТИЧЕСКИЕ).1. Алканам соответствует общая формула: +1. Cn H2n + 2; –2. Cn H2n; –3. Cn H2n - 2; –4. Cn H2n – 6; –5. Cn H2n – 4. Алканам соответствует общая формула гомологического ряда Cn H2n + 2, поскольку такой состав удовлетворяет строению алканов: атомы углерода sp3-гибридные и каждый из них образует четыре простые связи.
2. Для алканов возможна изомерия: –1. таутомерия; +2. энантиомерия; +3. структурная; –4. π– диастереомия; +5. σ-диастереомерия. Молекулы алканов состоят из атомов углерода и водорода, которые связаны только простыми связями. Поэтому возможны изомерия углеродного скелета (как разновидность структурной изомерии); энантио- и σ-диастереомерия (разновидности пространственной изомерии). Например, гептан и 3-метилгексаны являются структурными изомерами. Химическое строение 3-метилгексана имеют два разных вещества, энантиомеры: (S)-3-метилгесан и (R)-3-метилгексан. σ-Диастереоизомерами являются (3S, 4S) – и (3S, 4R)-3,4-диметилгексаны.
3. Для алканов характерны реакции с механизмами: –1. АN–Е; –2. АR; –3. SE; +4. SR; –5. AE. Для алканов характерны реакции, которые протекают по механизму SR, то есть реакции радикального замещения. Например, реакции галогенирования алканов. В этих реакциях происходит последовательное замещение на галоген атомов водорода в молекуле алканов посредством гомолитического расщепления связей С-Н и промежуточным образованием наиболее устойчивых в каждом случае свободных радикалов. Такой механизм обусловлен насыщенностью атомов углерода в молекуле, прочностью и небольшой полярностью связей.
4. 2–метилпропан может участвовать в реакциях: –1. нуклеофильного замещения; +2 радикального замещения; +3. окисления; –4. радикального присоединения; –5. электрофильного замещения. Метилпропан может участвовать в реакциях радикального замещения (SR) и окисления. Тот и другой тип реакций протекает с гомолитическим расщеплением прочных и, практически, неполярных σ-связей. Присутствие в молекуле алкана только простых связей делает невозможными реакции присоединения. Прочность и неполярность (малая полярность) простых связей С-С и С-Н предопределяет гомолитический (радикальный) механизм их расщепления.
5. Механизм реакций радикального замещения состоит из стадий: +1 инициирования; –2. присоединения; –3. отщепления; +4 роста цепи; +5 обрыва цепи. Исследования механизма радикального замещения (SR) у алканов показали, что эти сложные реакции происходят через три главные стадии: инициирование (образование «первого» свободного радикала); роста цепи (образование органических свободных радикалов и молекулярных продуктов, которое сопровождается возобновлением свободных радикалов, продолжающих реакцию); обрыва цепи (рекомбинация свободных радикалов в молекулярные продукты).
6. На стадии инициирования реакции радикального замещения по воздействием облучения образуются: –1. катионы; +2 свободные радикалы; –3. молекулы продукта; –4. анионы; –5. катион-радикалы. На стадии инициирования реакции радикального замещения под воздействием жесткого облучения образуются свободные радикалы в результате гомолитического расщепления связи в молекуле реагента (самая непрочная связь).
7. На стадии роста цепи в реакциях радикального галогенирования алканов образуются: +1. органические радикалы; –2. органические катионы; +3. радикалы галогена; –4. анионы галогена; +5. молекулы продукта. На стадии роста цепи в реакциях радикального галогенирования алканов сначала образуется органический радикал (из молекулы алкана), который атакует молекулу галогена с образованием продукта и нового радикала галогена, который продолжает реакцию.
8. На стадии обрыва цепи в реакциях радикального галогенирования алканов образуются: –1. органические радикалы; –2. радикалы галогена; +3. молекулы; –4. органические анионы; –5. катионы галогена. На стадии обрыва цепи в реакциях радикального галогенирования алканов образуются только молекулы в результате связывания свободных радикалов друг с другом.
9. Максимальную энергию разрыва имеет связь С–Н у атома углерода: +1. первичного; –2. вторичного; –3. третичного; –4. четвертичного; – 5. тип атома углерода не имеет значения. Максимальную энергию разрыва имеет связь С-Н у первичного атома углерода. Например, было установлено, что энергии связи С-Н в ряду соединений распределяются как 410, 397 и 380 кДж/моль. Таким образом связь С-Н у первичного атома углерода является наиболее прочной. 10. Региоселективность реакций радикального замещения у алканов проявляется в том, что, например, при облучении смеси 2– метилпентана с бромом преимущественно образуется: –1. 1– бром– 4– метилпентан; –2. 2– бром– 4– метилпентан; –3. 3– бром– 4– метилпентан; +4. 2– бром– 2– метилпентан; –5. 1– бром– 2– метилпентан. Региоселективность реакций радикального замещения (SR) у алканов проявляется в том, что например, при облучении смеси 2-метилпентана с бромом преимущественно образуется 2-бром-2-метилпентан, то есть третичный бромид, а не вторичный или первичный. Третичному бромиду предшествует образование наиболее устойчивого в этом ряду третичного свободного радикала.
11. Максимальную термодинамическую устойчивость имеют циклоалканы с: –1. малым циклом; +2. обычным (нормальным) циклом; –3. средним циклом; –4. высшим циклом (макроциклом); –5. размер цикла не имеет значения. Максимальную термодинамическую устойчивость имеют циклоалканы с обычным циклом, то есть циклопентан и циклогексан. В молекулах этих циклических соединений отсутствует угловое напряжение, свойственное циклопропану и циклобутану (циклоалканы с малым циклом), и нехарактерны взаимодействия атомов через пространство, которые возникают при определенных конформациях в молекулах с большими циклами.
12. Для циклогексана и циклопентана характерны реакции, протекающие по механизму: –1. АR; –2. АN; –3. SE; –4. SN; +5. SR. Для циклогексана и циклопентана характерны реакции, протекающие по механизму радикального замещения SR, потому что их молекулы состоят из насыщенных атомов углерода связанных между собой и с атомами водорода простыми прочными и неполярными (малополярными) связями.
13. Продуктом взаимодействия циклогексана с бромом является: –1. нет взаимодействия; –2. 1,6– дибромгексан; –3. 1,2– дибромгексан; +4. бромциклогексан; –5. 1–бромгексан. Продуктом монобромирования циклогексана является бромциклогексан, который образуется в результате реакции радикального замещения.
14. Циклогексан вступает в реакцию с галогенами: +1. при нагревании; –2. в присутствии сильных кислот; +3. при облучении; –4. в присутствии FeCl3; –5. в присутствии AlCl3. Для циклогексана характерны реакции радикального замещения SR. Стадия инициирования этих реакций требует создания условий, в которых из молекулы образуются свободные радикалы. Такими условиями часто являются достаточно сильное нагревание и жесткое обучение.
15. Главным по содержанию продуктом взаимодействия метилциклогексана с бромом при облучении или нагревании является: –1. бромциклогексан; +2. 1– бром– 1– метилциклогексан; –3. 1– бром– 2– метилциклогексан; –4. 1– бром– 4– метилциклогексан; –5. нет взаимодействия. Реакция галогенирования метилциклогексана протекает по механизму SR, и является региоселективной (подобно реакциям алканов). Поэтому преобладает тот продукт галогенирования, которому предшествовало образование более устойчивого свободного радикала. 1-Бром-1-метилциклогесану соответствует третичный свободный радикал. 16. Алкенам соответствует общая формула: –1. Сn H2 n + 2; +2. Cn H2n; –3. Cn H2n – 2; –4. Cn H2n – 4; – 5. Cn H2n – 6. В общей формуле алкенов количество атомов водорода в 2 раза больше количества атомов углерода.
17. Мирцен С9Н16 может быть: – 1. алканом; – 2. ареном; – 3. циклоалканом (с одним циклом); – 4. алкеном; +5. алкадиеном. Мирцен подчиняется общей формуле CnH2n-2, которая соответствует алкинам и алкадиенам.
18. Двойная связь в общем случае обуславливает следующие виды изомерии: –1. энантиомерию; +2. структурную; –3. σ–диастереометрию; –4. аномерию; +5. π–диастереометрию. Двойная связь обуславливает изомерию положения кратной связи и является стерическим центром (конфигурационная изомерия).
19. π–диастереомеры возможны для: – 1. 2–метилгексена–2; +2. 3–метилгексена–2; +3. 4–метилгексена–2; +4. 5–метилгексена–2; +5. гептена–2. Стерический центр (=связь) в этих структурах окружен 2-мя разными заместителями у каждог sp2-гибридного атома углерода. Эти молекулы не являются симметричными структурами, для них характерна конфигурационная изомерия, π-диастереомерия.
20.
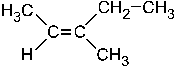
Структурная формула соответствует: + 1. (Z)– 3– метилпентену– 2; –2. транс– пентену– 2; – 3. (Е)– 3– метилпентену– 2; – 4. цис– пентену– 2; – 5. гексену– 2. В этом соединении – 3-метилпентен-2, старшие заместители (CH3 и C2H5 гр.) расположены по одну сторону от двойной связи, т.е. это Z-изомер.
21. Неопентилэтилен назван правильно по заместительной номенклатуре в примере: – 1. 2,2– диметилпентен– 4; –2. 2– метилгексен– 5; –3. 5– метилгексен– 1; – 4. 3,3– диметилпентен– 1; + 5. 4,4– диметилпентен– 1. Самая длинная цепь состоит из 5-ти атомов углерода, двойная связь между 1 и 2 (крайними атомами) и от предпоследнего (4-го) атома отходят две метильные группы. Начало нумерации определяет двойная связь.
22.
Углеводород по заместительной номенклатуре назван правильно в примере: – 1. 3– винилоктен– 7– ин– 4; + 2. 3– этилоктадиен– 1,7– ин– 4; – 3. 6– этилоктадиен– 1,7– ин– 4; – 4. 6– винилоктен– 1– ин– 4; –5. 3– этилоктин– 4– диен– 1,7. Цепь состоит из 8 атомов углерода и нумеруется от того конца, где ближе заместитель. Родоначальная структура содержит все кратные связи.
23. В ряду соединений этан – этилен - ацетилен (слева направо): +1. изменяется тип гибридизации атомов углерода; +2. изменяется электронное строение молекулы; + 3. увеличивается полярность СН– связей; + 4. увеличиваются С–Н– кислотные свойства; – 5. увеличивается молярная масса. Это определяется электронным строением данных соединений.
24. Алкены и диены участвуют в реакциях: +1. присоединения; +2. полимеризации; +3. окисления; –4. отщепления; – 5. солеобразования. Алкены и диены имеют в своем составе двойную связь, по которой протекают реакции присоединения. Характерны также реакции окисления (по двойной связи) и полимеризации (с разрывом π-связи).
25. Алкины участвуют в реакциях: + 1. присоединения; + 2. полимеризации; +3. окисления; – 4. отщепления; +5. солеобразования. Наличие двойной связи благоприпятствует протеканию реакций, присоединения и окисления; наличие С-Н кислотного центра – реакций солеобразования. Также характерны реакции полимеризации (с разрывом π-связи).
26. Главным продуктом реакции 3,3– дихлорбутена–1 с НВr является: – 1. 1,2– дибром –3,3– дихлорбутан; –2. 1,1– дибром –3,3– дихлорбутан; – 3. 2,2– дибром –3,3– дихлорбутан; +4. 2– бром –3,3– дихлорбутан; –5. 1– бром –3,3– дихлорбутан. Электроакцепторное влияние двух атомов хлора на поляризацию π-связи является причиной присоединения бромоводорода против правила Марковникова.
27. Продуктами присоединения 1 моль Br2 к изопрену могут быть: + 1. 1,2– дибром –2– метилбутен –3; +2. 1,2– дибром –3– метилбутен –3; – 3. 2,3– дибром –2– метилбутадиен –3; –4. 2,3– дибром –2– метилбутан; +5. 1,4– дибром –2– метилбутен –2. Возможны 2 варианта присоединения у диенов: А1,2 и А1,4, что определяется наличием мезомерных структур, характерных для σ-комплекса аллильного типа).
28. Конечным продуктом гидратации 3– метилбутина –1 является: – 1. 2– метилбутан; + 2. метилизопропилкетон; – 3. 3– метилбутаналь; – 4. 2– метилпропановая и муравьиная кислоты; – 5. 3– метил –бутен –1– ол –2. Гидратация алкинов (кроме ацетилена) протекает до конечного продукта – кетона.
29. Механизм электрофильного присоединения состоит из стадий: –1. образования свободного радикала; +2. образования π– комплекса; –3. рост цепи; +4. превращение π– комплекса в σ– комплекс; +5. превращение σ– комплекса в конечный продукт реакции. Это установленный факт.
30. Скорость реакции АЕ увеличена, если: + 1. карбкатион устойчив; –2. карбкатион не устойчив; – 3. устойчивость карбкатиона не влияет на скорость реакции; +4. положительный заряд делокализован в σ– комплексе; –5. положительный заряд сконцентрирован на одном атоме σ– комплекса. Лимитирующей стадией механизма АЕ является образование σ-комплекса (карбкатиона). Чем больше стабильность последнего (делокализация положительного заряда), тем быстрее он образуется и скорость реакции в целом возрастает.
31.
В ряду данных карбкатионов максимальная делокализация заряда возможна в структуре:
– 1. –2. + 3. –4. – 5. Делокализация заряда возможна для структур 2 и 3 (2 резонансные структуры для каждого), но структура 3 представляет собой третичный карбкатион, который устойчив за счет 3-х + I-эффектов заместителей.
32. В качестве кислоты с аммиачным раствором оксида серебра могут реагировать: + 1. ацетилен; – 2. пропен; –3. изопрен; –4. 4– метилпентин –2; + 5. пропин. Эти соединения являются алкинами и имеют достаточно активный С-Н кислотный центр.
33. При окислении алкенов в зависимости от природы реагента и условий могут быть получены: – 1. алканы; +2. вицинальные диолы; – 3. одноатомные спирты; +4. альдегиды и кетоны; 5. эпоксиды. При окислении алкена перманганатом калия в нейтральной среде при нормальных условиях образуются вицинальные диолы, при окислении тем же окислителем в кислой среде и при нагревании – альдегиды и кетоны (разрыв π и σ-связей), а при окислении мягкими окислителями (Ag/О2) – эпоксиды (разрыв π-связи).
34. Продуктом реакции гексен –2 + KMnO4, H2SO4 при нагревания является: – 1. циклогексанол; –2. циклогександиол –1,2; –3. гександиовая кислота; +4. уксусная + масляная кислоты; – 5. 1,2– эпоксициклогексан. Происходит разрыв π и δ-связей между 2 и 3-м атомами и образуются кислоты с 2-мя и 4-мя атомами углерода в основной цепи.
35. Качественными реакциями на непредельные углеводороды является их реакции с: –1. Сl2; –2. O3 с последующим восстановительным гидролизом; +3. Br2, H2O; –4. HBr; +5. KMnO4, H2O. Эти реакции сопровождаются качественными признаками (обесцвечивание бромной воды и раствора KMnO4).
36. Качественная реакция непредельных углеводородов с бромной водой сопровождается внешним признаком протекания: –1. обесцвечивание раствора + бурый осадок; – 2. образование ярко-синего раствора; –3. образование светло-желтого осадка; –4. выделение газа; +5. обесцвечивание раствора. В ходе реакции расходуется Br2, окрашенный в бурый цвет.
37. Качественная реакция непредельных углеводородов с водным раствором КМnО4 без нагревания сопровождается внешним признаком протекания: +1. обесцвечивание раствора + бурый осадок; – 2. образование ярко-синего раствора; –3. образование светло-желтого осадка; –4. выделение газа; –5. обесцвечивание раствора. В ходе реакции расходуется KMnO4, раствор которого окрашен в фиолетовый цвет и образуется MnO2, нерастворимый в воде и имеющий бурый цвет.
38. Электронный спектр с наиболее длинноволновой полосой поглощения принадлежит: + 1. гексатриену –1,3,5; – 2. гексадиену –1,3; –3. гексену –2; –4. гексану; – 5. 2– метилпентадиену –1,4. Это соединение имеет наиболее длинную π, π -сопряженную систему по сравнению с другими структурами.
39. Характеристические полосы поглощения 3200 и 2150 см –1 (одновременно) возможны для инфракрасного спектра соединений: –1. 2,3– диметилпентена –2; – 2. пентена –2; – 3. пентина –2; +4. пентина –1; –5. 2,3– пентадиена –1,4. Это валентные колебания характеристических групп (СºС) и (ºС-Н), характерных для алкина с концевой тройной связью.
40. Только две группы сигналов возможны для ПМР – спектра: +1. 2– метилпропена; –2. бутена –1; –3. 2,2– диметилпропана; +. 2,3– диметилбутана; +. цис – бутена –2. Эти структуры являются симметричными и каждая из них имеет по 2 группы магнитно-неэквивалентных протонов.
41. Для непредельных углеводородов характерны реакции, протекающие по ионному механизму потому, что двойные и тройные углерод–углеродные связи: –1. более прочные, чем простые; +2 азованы σ– и π– связями; –3. яются, практически, неполярными; +4 дают увеличенную электронную плотность в реакционном центре молекулы; +5 связи сравнительно легко поляризуются. Определяется строением и основными характеристиками кратных связей. 42. Смесь ацетона и масляного альдегида образуется при озонолизе с последующим восстановительным гидролизом: –1. етилгексена-1; +2 етилгексена-2; –3. етилгексена-3; –4. етилгексена-1; –5. етилгексена-2. Озонолиз алкенов с последующим восстановительным гидролизом используется для установления места расположения кратной связи. Образовались продукты с 3-мя (ацетон) и 4-мя атомами углерода в основной цепи, значит исходной структурой содержит 6 атомов углерода, а двойная связь – между 2 и 3 атомами. Так как масляный альдегид имеет неразветвленную структуру, то заместитель был у 2-го атома углерода и второй продукт должен иметь 3 атома углерода (ацетон).
43. Конечным продуктом реакции 3,3-дихлорбутена-1 с бромной водой является: +1. 1,2-дибром-3,3-дихлорбутан; –2. 1,1-дибром-3,3-дихлорбутан; –3. 2,2-дибром-3,3-дихлорбутан; –4. 2-бром-3,3-дихлорбутан; –5. 1-бром-3,3-диххлорбутан. Присоединение брома протекаети по механизму АЕ с расщеплением π-связи и образованием на ее месте 2-х σ-связей углерода с бромом.
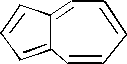
44.
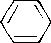
К классу аренов относятся углеводороды, записанные в примерах:
– 1. + 2. + 3. – 4. + 5. Эти соединения отвечают общей формуле CnH2n-6 и критериям ароматичности.
45.
К ароматическим относятся соединения, записанные в примерах:
+ 1. –2. +3. –4. + 5. Эти соединения отвечают всем критериям ароматичности.
46. Аренам гомологического ряда бензола соответствует общая формула: – 1. Cn H2n; –2. Cn H2n – 2; –3. Сn H2 n + 2; +4. Cn H2n – 6; –5. Cn H2n – 4. В общей формуле аренов количество атомов водорода должно быть на 6 меньше удвоенного количества атомов углерода.
47. Ароматическому ядру аренов соответствуют следующие характеристики: +1. циклическое строение углеродного скелета; +2. sр2-гибридизация каждого углеродного атома; +3. плоское строение; + 4. замкнутый тип сопряженной системы; +5. число π-электронов соответствует правилу Хюккеля.. Эти характеристики являются критериями ароматичности.
48. Наиболее характерные для аренов реакции протекают по механизму: – 1. SN; +2. SE; –3. SR; –4. окисление; –5. AE. Протекание реакции замещения предполагает образование термодинамически устойчивого соединения ароматического характера.
49. Механизм электрофильного замещения в ряду аренов состоит из стадий: +1. образования π–комплекса; –2. инициирование свободно-радикального процесса; –3. роста цепи; +4. превращения π–комплекса в σ–комплекс; +5. превращения σ–комплекса в продукт реакции. Это установленный факт.
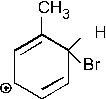
50. Мезомерными структурами карбкатиона
являются:
+1. –2. +3. +4. –5. Эти резонансные структуры показывают распределение электронной плотности в предложенном карбкатионе.
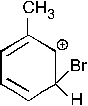
51. Максимальное число мезомерных структур, которыми можно записать
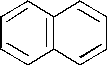
–1. 2; –2. 1; + 3. 3; –4. 5; –5. 4. а именно
52.
Скорость реакций электрофильного замещения у аренов уменьшают заместители:
+ 1. +2. + 3. – 4. –5. Они являются электроноакцепторными заместителями, которые уменьшают электронную плотность в ароматическом ядре, уменьшают реакционную способность арена и скорость реакции SE.
53.
Направляют в орто- и пара-положения реакцию электрофильного замещения у производных бензола заместители: +1. – 2. –3. – 4. – 5. Этот заместитель является электронодонором, увеличивает электронную плотность в о- и n-положениях бензольного кольца.
54.
Ориентирующее влияние заместителей в реакциях электрофильного замещения является согласованным в примерах: –1. + 2. + 3. – 4. –5. В соединении 2 группа СООН ориентирует заместитель в м-положение, а одновременно гр. ОН и NH2 – ориентируют в о- и n-положения, т.е. в положения 3 и 5. В соединении 3 галогены одновременно ориентируют заместитель в о и n-положения, т.е. в положения 2,4 и 6.
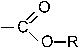
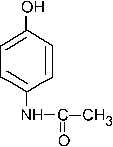
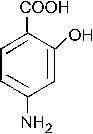
55. Изопропилбензол является продуктом реакции электрофильного замещения бензола с: + 1. изопропилбромидом / AlCl3; +2. пропеном / HCl; –3. ацетилхлоридом / AlCl3; +4. пропанолом –2 / H3PO4; –5. пропаном. Эти соединения образуют электрофильную частицу
56. Главным по содержанию продуктом сульфирования (электрофильное замещение) 1,3– диметилбензола является: +1. 2,4– диметилбензолсульфокислота; – 2. 3,5– диметилбензолсульфокислота; – 3. 2,6– диметилбензолсульфокислота; – 4. м– метилфенилметансульфокислота; –5. 2,6– диметилтиофенол. Группы CH3 являются ЭД, направляют заместитель в о- и n-положения (2,4,6). Так как одно из положений о- является пространственно затрудненным, то -SO3H группа преимущественно вступает в положения 4 или 6. Полученный продукт по заместительной номенклатуре имеет название – 2,4-диметилбензолсульфокислота.
57. Мета–нитротолуол является продуктом реакции: +1. нитробензол + CH3J / AlCl3; –2. n–нитроэтилбензол + KMnO4 / H2SO4; –3. метилбензол + HNO3 конц / H2SO4; –4. нитробензол + CH3COCl /AlCl3; –5. n–нитроэтоксибензол +Cl2 /FeCl3. В м-положение заместитель мог направить ориентант II рода (это группа NO2), поэтому исходным субстратом в реакции SE был нитробензол, а электрофильным реагентом метилиодид.
58.
Продуктами реакции толуола с ацетилхлоридом (электрофильное замещение) являются:
–1. –2. +3. – 4. +5. Толуол содержит в своей структуре группу СН3 (ориентант I рода), направляющую заместитель (СН3-СÅ=О) в положения орто- и пара.
59.
При хлорировании (в присутствии хлорида железа) смеси (1:1) этилбензола и метилфенилкетона образуется в относительно большем количестве: –1. –2. – 3. +4. – 5. Группа C2H5 является ЭД, в то время как группа
60. Окислению в растворе в условиях KMnO4 / H2SO4 при нагревании подвергаются: –1. бензол; + 2. толуол; + 3. стирол (винилбензол); +4. этилбензол; +5. n–метилэтилбензол. В этих условиях окисление происходит по a-положению боковой цепи с образованием из алкильного радикала группы СООН.
61. При монобромировании нафталина (электрофильное замещение) в относительно большем количестве образуется: + 1. 1– бромнафталин; –2. 2– бромнафталин; –3. 1,2– дибромнафталин; – 4. 1,4– дибромнафталин; –5. 1,5– дибромнафталин. Бромирование (галогенирование) нафталина протекает преимущественно в a-положение.
62. При сульфировании нафталина в жестких условиях (150°С) предпочтительно образуется: – 1. нафталинтиол –1; – 2. нафталинсульфоновая –1– кислота; –3. нафталинтиол –2; + 4. нафталинсульфоновая –2– кислота; –5. α,α– динафтилсульфоксид. При сульфировании нафталина в жестких условиях преимущественно образуется β-продукт (продукт термодинамического контроля).
63. Продуктом окисления β–нитронафталина в растворе в условиях K2Cr2O7/H2SO4 может быть:
–1. окисления не происходит; + 2. – 3. –4. – 5. Группа NO2 – ЭА заместитель способствует окислению незамещенного кольца с образованием двух СООН групп.
64. Бензол и его гомологи в отличие от алкенов и других непредельных углеводородов не реагируют с: –1. KMnO4 / H2SO4 при нагревании; +2. Br2 / H2O; –3. O2 при нагревании; +4. KMnO4 / H2O при 25°С; –5. H2 / Ni при нагревании и давлении. Для бензола и его гомологов не характерны реакции, протекающие по механизму AE и приводящие к продуктам неароматического строения.
65. Бензол, его гомологи и алкилпроизводные аренов поглощают в регистрируемой области электронного спектра потому, что для электронного строения их молекул характерны: + 1. π – π* возбуждение электронов; – 2. n – π* возбуждение электронов; –3. σ – σ* возбуждение электронов; +4. π – π сопряжение; –5. р – π сопряжение. Это определяется электронным строением ароматического ядра.
66. Молекулы всех аренов имеют характеристические группы: – 1. С sp3 – H; + 2. C ap – H; +3. C ap = C ap; –4. C sp – H; –5. O – H. Молекулы всех аренов имеют в своей структуре связи Сар-Н и Сар = Сар.
67. Наиболее общими диапазонами (см –1 ) характеристических частот в инфракрасных спектрах аренов являются: + 1. 1600 – 1450; –2. 1720 – 1680; – 3. 2300 – 2100; – 4. 3650 – 3300; +5. 3100 – 3000. Эти значения характерны для валентных колебаний характеристических групп (Сар = Сар) и (Сар – Н).
68. В ПМР–спектрах аренов протоны ароматического ядра имеют химический сдвиг в области (м. д.): –1. 0,8 – 1,8; –2. 2,0 – 4,3; +3. 6,5 – 8,2; –4. 8,5 – 11; –5. 10 – 13. Протоны ароматического ядра сильно деэкранированы и значение их химического сдвига находится в слабом поле; это значение (6,5 – 8,2 м.д.) является «характеристичным» для протонов ароматического ядра.
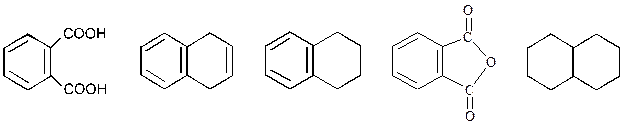
69. При восстановлении нафталина в разных условиях можно получить:
Эти продукты образуются при восстановлении одной (2), 2-х (3) и всех 5-ти двойных связей (5).
70. При алкилировании в условиях электрофильного замещения α–нафтола предпочтительно образуется: –1. 2– алкилнафтол –1; –2. 3– алкилнафтол –1; + 3. 4– алкилнафтол –1; –4. 5– алкилнафтол –1; – 5. 6– алкилнафтол –1. Группа ОН является ориентантом 1 рода, увеличивает электронную плотность преимущественно в замещенном кольце, направляет вступающий алкил в орто- и параположения. Пара-положение (4 по номеру) более предпочтительно, потому что соответствует a-положению в молекуле незамещенного нафталина, где электронная плотность больше. Дата добавления: 2015-11-26 | Просмотры: 3382 | Нарушение авторских прав |
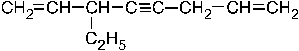




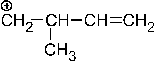



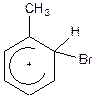



 σ–комплекс равно:
σ–комплекс равно: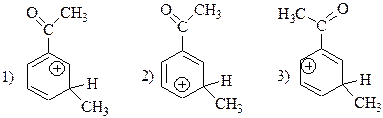

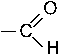
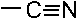

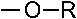




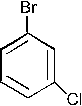
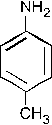
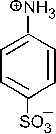
 которая участвует в реакции SE с бензолом с образованием изопропилбензола.
которая участвует в реакции SE с бензолом с образованием изопропилбензола.
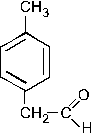
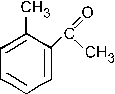

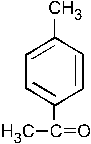
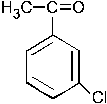
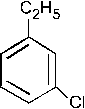
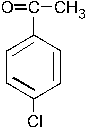


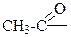 ЭА. ЭД заместители увеличивают электронную плотность в ароматическом кольце, а следовательно, увеличивается реакционная способность арена и скорость протекания реакции SE (выход продукта также увеличивается).
ЭА. ЭД заместители увеличивают электронную плотность в ароматическом кольце, а следовательно, увеличивается реакционная способность арена и скорость протекания реакции SE (выход продукта также увеличивается).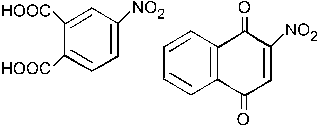
 – 1. +2. + 3. –4. + 5.
– 1. +2. + 3. –4. + 5.