 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ1. Увеличение энергии возбуждения, обычно, соответствует раду электронных переходов: –1. n à π* à n à σ* à π à π* à σ à σ*; +2. n à π* à π à π* à n à σ* à σ à σ*; –3. σ à σ* à π à π* à n à σ* à n à π*; –4. π à π* à n à π* à σ à σ* à n à σ*; –5. n à σ* à n à π* à π à π* à σ à σ*. Увеличение энергии молекулярных орбиталей в общем случае соответствует последовательности: σ < π < n < πx < σx . При возбуждении электрона (в результате поглощения молекулой кванта энергии) происходит его переход на молекулярную орбиталь с более высокой энергией. Поэтому следует выбрать ряд 2.
2. Регистрируемой области электронного спектра, обычно, соответствуют поглощения, вызванные возбуждением электронов: +1. n à π*; –2. n à σ*; –3. π à π* (изолированная кратная связь); +4. π à π* (в сопряженной системе); –5. σ à σ*. Регистрируемой на обычных спектрофотометрах области электронного спектра 200-800 нм соответствуют ближняя ультрафиолетовая и видимая области электромагнитного спектра. Это области сравнительно невысокой энергии. Чтобы возбуждение электронов в молекуле было зарегистрировано, оно должно соответствовать по энергии этой области спектра. В общем случае минимальной энергией возбуждения обладают переходы электронов с несвязывающей молекулярной орбитали на π* разрыхляющую (n→π*) и со связывающей π-молекулярной орбитали на π* разрыхляющую при условии достаточно большого числа молекулярных орбиталей в π-системе (т.е. π→π* в сопряженной системе).
3. Регистрируемая область электронного спектра лежит в диапазоне длин волн: –1. 10 – 200 нм; –2. 800 нм – 300 мм; –3. 4000 – 600 см –1; –4. 300 мм – 200 м; +. 200 – 800 нм. Электронный спектр соединения является следствием поглощения его молекулами энергии в результате возбуждений их электронов. Возбуждение электронов требует достаточно высоких энергий. Минимальным значениям таких энергий (ближняя ультрафиолетовая и видимая области) соответствует диапазон длин волн электромагнитного излучения 200-800 нм.
4. Параметрами полосы поглощения в электронном спектре вещества, обычно, является: +. длина волны в максимуме оптической плотности; –2. резонансная частота; –3. частота в минимуме пропускания; +. коэффициент экстинкции в максимуме поглощения; –5. химический сдвиг в максимуме поглощения. Электронный спектр поглощения вещества принято записывать как график зависимости оптической плотности раствора от длины волны А=f (λ). Поэтому каждая полоса поглощения характеризуется длиной волны в максимуме оптической плотности и интенсивностью поглощения, т.е. этой оптической плотностью. Поскольку оптическая плотность зависит от концентрации раствора и толщины поглощающего слоя, вместо нее интенсивность поглощения характеризуют коэффициентом экстинкции ε=А/с×l, который не зависит от этих условий.
5. При исследовании строения вещества электронный спектр дает информацию: –1.о числе неэквивалентных кислотных центров молекулы; +2. об особенностях электронного строения молекулы; –3. о составе характеристических и функциональных групп молекулы; +4.о наличии в молекуле сопряженной системы; +5. о наличии в молекуле кратных связей и гетероатомов. При исследовании строения вещества его электронный спектр обусловлен поглощением веществом энергии в результате определенных возбуждений электронов. Энергия возбуждения электронов зависит от особенностей электронного строения молекулы, набора ее электронных молекулярных орбиталей. В регистрируемой области электронного спектра, поглощают вещества, строение молекул которых обеспечивает возбуждение электронов π→π* при условии сопряженной системы и n→π*, т.е. молекула должна иметь сопряженную систему π-связей и/или гетероатом с неподеленной парой электронов пиррольного или пиридинового строения.
6. Структурный фрагмент молекулы, который обуславливает ее избирательное поглощение в диапазоне ультрафиолетовой и видимой областей электромагнитного спектра, называется: –1. характеристическая группа; –2. кислотный центр; –3. функциональная группа; +4. хромофор; –5. ауксохром. Избирательное поглощение веществом энергии в ультрафиолетовой и видимой областях электромагнитного спектра обусловлено набором электронных молекулярных орбиталей его молекул. Строение молекулы и ее фрагментов, записанные структурной формулой, позволяет в самых общих чертах прогнозировать тип электронных возбуждений. Принято такие фрагменты строения молекул называть хромофорами.
7. Смещение полосы поглощения в коротковолновом направлении электромагнитного спектра называется: –1. гиперхромный эффект; +2. гипсохромное смещение; –3. гипохромный эффект; –4. батохромное смещение; –5. эффект экранирования. При определенных изменениях условий регистрации электронного спектра или изменениях в строении соединения, которые увеличивают энергию возбуждения электронов молекулы, поглощение веществом энергии происходит при более низких значениях длины волны в максимуме поглощения. Такое изменение (уменьшение) длины волны поглощенного излучения называется гипсохромным смещением полосы поглощения в спектре.
8. Увеличение коэффициента экстинкции полосы поглощения в электронном спектре называется: +1. гиперхромный эффект; –2. гипсохромное смещение; –3. гипохромный эффект; –4. батохромное смещение; –5. эффект экранирования. Гиперхромным эффектом называется увеличение коэффициента экстинкции полосы поглощения в электронном спектре, т.е. увеличение интенсивности поглощения. Гиперхромный эффект свидетельствует об увеличении вероятности электронного возбуждения.
9. Изменение положения полосы поглощения в электронном спектре, которому соответствует увеличение длины волны в максимуме оптической плотности, называется: –1. гиперхромный эффект; –2. гипсохромное смещение; –3. гипохромный эффект; +4. батохромное смещение; –5. эффект экранирования. Батохромным смещением называется увеличение длины волны в максимуме оптической плотности полосы поглощения в электронном спектре. Батохромное смещение полосы поглощения свидетельствует об уменьшении энергии соответствующего возбуждения электронов.
10. Гипохромным эффектом в электронной спектроскопии называется: –1. увеличение длины волны в максимуме поглощения; –2. увеличение коэффициента экстинкции; –3. уменьшение длины волны в максимуме поглощения; +4. уменьшение коэффициента экстинкции; +5. уменьшение интенсивности поглощения. Гипохромным эффектом называется уменьшение интенсивности полосы поглощения в электронном спектре, которое выражается уменьшением соответствующего коэффициента экстинкции (ε=А/c×l).
11. Электронное строение молекулы бензола обеспечивает такие типы электронных возбуждений, как: +1. σ à σ* +2. π à π*; – – – σ à σ* и π à π* возбуждения электронов возможны для молекулы бензола, поскольку ее электронное строение представлено только σ и π связывающими и σ* и π* разрыхляющими молекулярными орбиталями, другими словами – в молекуле бензола присутствуют только σ- и π- связи.
12. В электронном спектре бутадиена – 1,3 есть поглощение в области больше 200 нм потому, что: –1. в его молекуле есть σ – связи; –2. это непредельное соединение; +3. это непредельное соединение с сопряженной системой; +4. его электронное строение делает возможным π à π* возбуждение электронов; –5. в его молекуле возможны и σàσ* электронные переходы. Бутадиен-1,3 это непредельный углеводород с сопряженной системой π-связей. Его электронное строение делает возможными σ→σ* и π→π* возбуждения электронов. Но в области 200-800 нм регистрируются поглощения, обусловленные только π-π* возбуждением. Энергия возбуждения σ→σ* перехода значительно больше, и соответствующая им длина волны меньше 200 нм.
13. Электронное строение молекулы ацетона обеспечивает такие типы электронных возбуждений, как: +1. σ à σ* +2. π à π*;
– σ à σ*, π à π*,
14. В электронном спектре ацетона поглощение в регистрируемой области обусловлено возбуждением электронов: –1. σ à σ* –2. π à π*; –
– Среди возможных электронных возбуждений молекулы ацетона переход
15. В электронном спектре ацетальдегида поглощение в регистрируемой области имеет очень низкий коэффициент экстинкции потому, что это поглощение обусловлено переходом электронов: –1. π à π*; +2. между молекулярными орбиталями разной симметрии; –
+5. который является маловероятным (запрещенным) и поэтому редким. Для электронного строения молекулы ацетальдегида характерны σ-связи, одна (изолированная) π-связь и гетероатом (кислород) с пиридиновым строением. Поэтому в регистрируемой области выше 200 нм в электронном спектре ацетальдегида наблюдается поглощение обусловленное только низкоэнергетическим возбуждением
16. В регистрируемой области электронного спектра имеют поглощение: +1. этилацетат; –2. циклогексан; +3. фенол; +4. пиридин; +5. циклогексадиен – 1,3. В регистрируемой области (выше 200 нм) электронного спектра имеют, обычно, поглощения соединения, строение которых делает возможными π→π* (в сопряженной системе) и n→π* электронные возбуждения. Этим электронным переходам соответствуют наиболее низкие значения энергии возбуждения. Такие возбуждения возможны для молекул с сопряженной системой π-связей и/или гетероатомом пиррольного или пиридинового строения. Поэтому следует выбрать этилацетат, фенол, пиридин (азин) и циклогексадиен-1,3.
17. В наиболее длинноволновой области электронного спектра поглощает: –1. циклогексадиен – 1,3; –2. циклогексадиен – 1,4; +3. циклогексадиен – 2,5 – он – 1; –4. циклогексен – 2 – он – 1; –5. циклогексен. В наиблее длинноволновой области электронного спектра из ряда предложенных соединений поглощает циклогексадиен-2,5-он, потому что его молекула имеет наиболее протяженную систему сопряженных π-связей и пиридиновый гетероатом. Эти особенности строения обеспечивают молекуле возбуждения электронов π→π* (шесть центров в сопряженной системе) и
18. В качестве растворителей в электронной спектроскопии можно использовать: +1. гексан; –2. гексадиен – 1,3; +3. этанол; –4. ацетон; –5. бензол. В качестве растворителей для электронной спектроскопии из ряда предложенных соединений следует выбрать гексан и этанол, потому что электронное строение этих молекул (отсутствие сопряженных π-связей, пиррольных и пиридиновых гетероатомов) делает невозможным для этих веществ поглощение энергии с длиной волны, соответствующей регистрируемой области (200-800 нм) электронного спектра.
19. Ядерным магнитным резонансом называется возбуждение на более высокий энергетический уровень: –1. деформационных колебаний атомов; –2. n – электронов; +3. ядер атомов; –4. π – электронов; –5. валентных колебаний атомов. Атомное ядро с нечетным числом нуклонов, помещенное в сильное магнитное поле, имеет разную энергию в зависимости от ориентации спина ядра относительно внешнего поля. При взаимодействии такого ядра с радиочастотным электромагнитным излучением возможно поглощение ядром энергии с изменением ориентации спина. Другими словами происходит возбуждение ядра на более высокий энергетический уровень. Такое явление называется ядерным магнитным резонансом.
20. Эффект экранирования протона в молекуле увеличивается при: –1. действии электроноакцептора; +2. действии электронодонора; –3. уменьшении электронной плотности у протона; +4. увеличении электронной плотности у протона; –5. увеличении полярности связи водорода с другим атомом. Эффект экранирования протона в молекуле обусловлен магнитным полем электронов. Поэтому эффект экранирования протона возрастает при увеличении электронной плотности у данного ядра. Электронодонорные заместители увеличивают электронную плотность.
21. Главными характеристиками резонансного сигнала в ПМР спектре являются: +1. химический сдвиг; +2. интенсивность; –3. длина волны в максимуме оптической плотности; +4. мультиплетность; +5. константа спин-спинового взаимодействия. ПМР спектр является источником большого объема информации о строении молекулы соединения. Химические сдвиги протонов отражают распределение в молекуле электронной плотности. Интенсивности сигналов соответствуют числу протонов в каждой группе (протоны с одинаковым химическим сдвигом). Мультиплетность (форма) сигнала дает информацию о числе протонов у соседних атомов. Констатнта спин-спинового взаимодействия позволяет делать выводы, например, об особенностях пространственного строения молекулы.
22. Химический сдвиг протонов увеличивается (слева направо) в следующем ряду: –1. С–Н О–Н N–Н; –2. О–Н С–Н N–Н; –3. N–Н С–Н О–Н; +4. С–Н N–Н О–Н; –5. О–Н N–Н С–Н. Химический сдвиг протонов увеличивается (слева направо) в ряду С-Н N-H O-H, поскольку в этом направлении уменьшается эффект экранирования протонов. Уменьшение эффекта обусловлено возрастанием электроотрицательности атома, который связан с протоном.
23. Химический сдвиг протона (подчеркнут) увеличивается в следующем ряду (слева направо): –1. С Н 3 R R O Н R2 N Н; +2 С Н 3 R R2 N Н R O Н; –3. R O Н С Н 3 R R2 N Н; –4. R2 N Н С Н 3 R R O Н; –5. R O Н R2 N Н С Н 3 R. Химический сдвиг протона увеличивается в ряду 2 слева направо, поскольку в этом направлении уменьшается эффект экранирования протона. См. предыдущий тест.
24. Химический сдвиг протона (подчеркнут) увеличивается в следующем ряду (слева направо): –1. R–N H 2 R–СON Н 2 Ar–N Н 2; –2. Ar–N Н 2 R–N H 2 R–СON Н 2; –3. R–СON Н 2 R–N H 2 Ar–N Н 2; –4. Ar–N Н 2 R–СON Н 2 R–N H 2; +5 R–N H 2 Ar–N Н 2 R–СON Н 2. Химический сдвиг протона, который подчеркнут, увеличивается слева направо в ряду 5, поскольку в этом направлении уменьшается эффект экранирования протона. Уменьшение эффекта экранирования в данном ряду обусловлено изменением влияния заместителя на группу NH2: Электронодонорное у алкиламинов, электроноакцепторное у ариламинов, электроноакцепторное более сильное в функциональной группе амидов.
25. Химический сдвиг протона (подчеркнут) увеличивается в следующем ряду (слева направо): –1. R–О H R – СOО Н Ar–О Н; –2. R – СOО Н R–О H Ar–О Н; +3 R–О H Ar–О Н R – СOО Н; –4. Ar–О Н R–О H R – СOО Н; –5. R – СOО Н Ar–О Н R–О H. Химический сдвиг протона, который подчеркнут, увеличивается слева направо в ряду 3, поскольку в этом направлении уменьшается эффект экранирования протона. Уменьшение эффекта экранирования в данном ряду обусловлено изменением влияния заместители на группу ОН: электронодонорное у спиртов, электроноакцепторное у фенолов, электроноакцепторное более сильное в карбоксильной группе.
26. Эффект экранирования протона (подчеркнут) увеличивается (слева направо) в следующих рядах: +1 R–COO Н Ar O Н R– O H; –2. R– N Н 2 R–СON Н 2 Ar–N Н 2; –3. R2 N Н С Н 3 R R– O H; –4. Ar N H 2 R–СON Н 2 R– N Н 2; +5 R – С Н =O R2С = C Н R С Н 3 R. Эффект экранирования протона, который подчеркнут, увеличивается слева направо в рядах 1 и 5. В этом направлении электронное влияние заместителя у группы ОН изменяется: сильное электроноакцепторное в карбоксильной группе, электроноакцепторное у фенолов, электронодонорное у спиртов. В этом же направении уменьшается и полярность связи СН.
27. Мультиплетность сигнала протонов (подчеркнуты) в ПМР– спектре пировиноградной кислоты равна: – +2. 1; –3. 2; –4. 5; –5. 4. Мультиплетность сигнала протонов, которые подчеркнуты, равна 1. То есть сигнал является синглетным, поскольку у соседнего к метильной группе атома молекулы отсутствуют протоны (n+1 = 0+1 =>1).
28. Число групп сигналов в ПМР– спектре пировиноградной кислоты равно: –1. 3; –2. 1; +3. 2; –4. 5; –5. 4. Число групп сигналов в ПМР-спектре пировиноградной кислоты равно двум, поскольку две группы протонов в этой молекулы различаются по эффекту их экранирования.
29. Мультиплетность сигнала протонов (подчеркнуты) в ПМР– спектре изомасляной кислоты равна: – +2. 2; –3. 3; –4. 5; –5. 7. Мультиплетность сигнала протонов, которые подчеркнуты, в ПМР-спектре изомасляной кислоты равна 2 (то есть сигнал имеет форму дублета), потому что у соседнего к метильным группам атома углерода в молекуле есть только один протон (n+1 = 1+1 => 2).
30. Мультиплетность сигнала протонов (подчеркнуты) в ПМР– спектре изомасляной кислоты равна: – –2. 2; –3. 3; –4. 5; +5. мультиплет. Мультиплетность сигнала протона, который подчеркнут, в ПМР-спектре изомасляной кислоты соответствует гептету, то есть мультиплету. Большая мультиплетность сигнала обусловлена влиянием поля шести протонов у соседних к группе >СН – атомов (n+1 = 6+1 => 7).
31. Число групп сигналов в ПМР– спектре изомасляной кислоты равно: –1. 1; –2. 2; +3. 3; –4. 5; –5. 7. Число групп сигналов в ПМР-спектре изомасляной кислоты равно трем, потому что три группы протонов этой молекулы (2СН3-, >CH- и O-H) различаются по эффекту их экранирования.
32. Число групп сигналов в ПМР– спектре трет.– бутилового спирта равно: +1. 2; –2. 4; –3. 1; –4. 5; –5. 3. Число групп сигналов в ПМР-спектре трет.-бутилового спирта (2-метилпропанол-2) равно двум, потому что в молекуле есть только две группы протонов (3СН3-, О-Н), которые различаются эффектом их экранирования.
33. Отношение интенсивностей сигналов в ПМР– спектре трет.– бутилового спирта соответствует записи: – +2. 9: 1; –3. 3: 6: 1; –4. 3: 1; –5. 1: 1: 1. Отношение интенсивностей сигналов в ПМР-спектре трет.-бутилового спирта (2-метил-пропанол-2) соответствует 9:1, поскольку интенсивность каждого сигнала в спектре пропорциональна числу протонов в группе ядер с одинаковым химическим сдвигом. См. также предыдущий тест.
34. Практическая инфракрасная спектроскопия использует, обычно, диапазон электромагнитного спектра: –1. 200 нм – 800 нм; –2. 300 мм – 200 м; –3. 10–3 нм – 10 нм; +4. 4000 см –1 – 600 см –1; –5. 400 нм – 800 нм. Инфракрасная спектроскопия изучает поглощение веществом энергии в инфракрасной и микроволновой областях электромагнитного спектра, которым соответствует интервал длины волны от 800 нм до 300 мм. Но практическая инфракрасная спектроскопия работает на гораздо более узком участке спектра, который в волновых числах (1/λ) может быть представлен как 4000-600 (см-1).
35. Валентные колебания атомов в молекуле изменяют: –1. валентные углы; –2. энергию валентных электронов; –3. магнитное состояние ядер атомов; +4. энергию всей молекулы; +5. длину химических связей. Валентными называют колебания атомов в молекуле, которые изменяют длину химической связи, расстояния между ядрами химически связанных атомов. При этом изменяется энергия этих атомов (характеристической группы) и энергия всей молекулы.
36. Деформационные колебания атомов в молекуле изменяют: +1. валентные углы; –2. энергию валентных электронов; –3. магнитное состояние ядер атомов; +4. энергию всей молекулы; –5. длину химических связей. Деформационными называют колебания атомов в молекуле, которые изменяют валентные углы, т.е. углы между химическими связями. При этом применяется энергия характеристической группы атомов и энергия всей молекулы.
37. Возможны следующие типы колебаний атомов в молекуле: –1. маятниковые; +2. валентные симметричные; +3. деформационные асимметричные; +4. валентные асимметричные; +5. деформационные симметричные. Колебания атомов в составе молекулы принято классифицировать на валентные (деформирующие химическую связь), деформационные (изменяющие углы между связями), симметричные и асимметричные (в зависимости от сохранения или изменения симметрии молекулы в результате валентных и деформационных колебаний).
38. Пара связанных атомов, колебания которых мало зависят от состава и строения остальной части молекулы, называется: –1. ауксохром; –2. кислотный центр; –3. хромофор; –4. функциональная группа; +5. характеристическая группа. Пару связанных атомов, энергия колебаний которых мало зависит от химического окружения, принято называть в инфракрасной спектроскопии характеристической группой. Функциональная группа в общем случае более сложная структурная часть молекулы, чем характеристическая группа (например, альдегидная группа
39. Функциональная группа карбоновых кислот имеет характеристические группы: +1. О – Н; –2. О – N; –3. C – C; +4. C = O; +5. C – O. Большинство характеристических групп состоят из двух химически связанных атомов. Поэтому функциональная группа карбоновых кислот «составлена» из трех характеристических групп
40. Функциональная группа сложных эфиров состоит из характеристических групп: –1. О – Н; +2. С – О; –3. С – С; +4. С = О; –5. С = С. Характеристическая группа состоит, обычно, из двух атомов, поэтому в функциональной группе сложных эфиров присутствуют две характеристические группы:
41. Функциональная группа амидов в общем случае состоит из характеристических групп: +1. N – Н; –2. О – Н; +3. С – N; +4. С = О; –5. С = С. Функциональная группа амидов:
42. Все первичные амины имеют характеристические группы: –1. О – Н; +2. N – H; –3. N – O; –4. N = O; +5 N – C.
43. Все вторичные амины имеют характеристические группы: –1. О – Н; +2 N – H; –3. N – O; –4. N = O; +5. N – C.
44. Все третичные амины имеют характеристические группы: –1. О – Н; –2. N – H; –3. N – O; –4. N = O; +5. N – C.
45. Характеристические частоты валентных колебаний С – Н алканов имеют диапазон (см –1): –1. 3600 – 3200; –2. 3300 – 3250; +3. 3000 – 2800; –4. 3100 – 3000; –5. 1680 – 1450. Большинство характеристических частот валентных колебаний имеют значения от 4000 до 1000 см-1 и распределяются в порядке, обусловленном уменьшением прочности связи и увеличением приведенной массы характеристической группы. Максимальные частоты имеют двухатомные характеристические группы с атомом водорода в своем составе. Уменьшение характеристических частот остальных групп соответствует, главным образом, уменьшению прочности связи в ряду от характеристических групп с тройной связью до групп с простой (одинарной) связью. Изменение характеристических частот в ряду групп
46. Характеристические частоты валентных колебаний Сsp2 – Н алкенов имеют диапазон (см –1): –1. 3600 – 3200; –2. 3300 – 3250; –3. 3000 – 2800; +4. 3100 – 3000; –5. 1680 – 1450. Длина и прочность связи в характеристической группе Сsp2 – Н имеют промежуточные значения в ряду групп
47. Характеристические частоты валентных колебаний Сsp – Н алкинов имеют диапазон (см –1): –1. 3600 – 3200; +2. 3300 – 3250; –3. 3000 – 2800; –4. 3100 – 3000; –5. 1680 – 1450. Характеристическая группа º С – Н в ряду
48. Характеристические частоты валентных колебаний Сsp2 – Н аренов имеют диапазон (см –1): –1. 3600 – 3200; –2. 3300 – 3250; –3. 3000 – 2800; +4. 3100 – 3000; –5. 1680 – 1450. Характеристические частоты валентных колебаний группы Сsp2 – Н аренов имеют, практически, тот же диапазон, что и частоты колебаний группы С – Н алкенов, то есть 3100-3000. См. предыдущие тесты.
49. Характеристические частоты валентных колебаний С = С алкенов имеют диапазон (см –1): –1. 3100 – 3000; –2. 2300 – 2100; –3. 1800 – 1680; +4. 1680 – 1600; –5. 1600 – 1450 (несколько полос). В ряду характеристических частот валентных колебаний групп с кратными (тройной, двойной) и простой связями частоты колебаний группы С = С алкенов занимают промежуточный диапазон 1680-1600 см-1, что соответствует промежуточным в данном ряду значениям длины и прочности двойной связи.
50. Характеристические частоты валентных колебаний С ≡ С алкинов имеют диапазон (см –1): –1. 3100 – 3000; +2. 2300 – 2100; –3. 1800 – 1680; –4. 1680 – 1600; –5. 1600 – 1450 (несколько полос). В ряду характеристических частот валентных колебаний групп с кратными (тройной, двойной) и простой связями частоты колебаний группы С º С алкинов имеют максимальные значения 2300-2100 см-1, поскольку в данном ряду тройная связь является наиболее короткой и поэтому наиболее прочной.
51. Характеристические частоты валентных колебаний С = С аренов имеют диапазон (см –1): –1. 3100 – 3000; –2. 2300 – 2100; –3. 1800 – 1680; –4. 1680 – 1600; +5. 1600 – 1450 (несколько полос). Характеристические частоты валентных колебаний группы С = С аренов имеют значения 1600-1450 см-1, несколько более низкие, чем в случае алкенов вследствие делокализации π-электронной плотности в молекулах аренов и некоторого уменьшения таким образом прочности связей.
52. Характеристические частоты валентных колебаний О – Н спиртов и фенолов имеют диапазон (см –1): +1. 3600 – 3200; –2. 3100 – 3000; –3. 3000 – 2800; –4. 2700 – 2500; –5. 2300 – 2100. Характеристические частоты валентных колебаний группы О – Н спиртов и фенолов имеют значения 3600-3200 см-1, максимальные для групп Х – Н. Это соответствует максимальной прочности связи О – Н относительно связей водорода с азотом (N-H), углеродом (С-Н) и некоторых других.
53. Характеристические частоты валентных колебаний О – Н карбоновых кислот имеют диапазон (см –1): –1. 3600 – 3200; –2. 3100 – 3000; –3. 3000 – 2800; +4. 3000 – 2500; –5. 2300 – 2100. Характеристические частоты валентных колебаний группы О – Н в составе карбоксильной функциональной группы карбоновых кислот имеют значения 3000-2500 см-1, заметно более низкие, чем частоты колебаний такой же характеристической группы спиртов и фенолов. В составе карбоксильной группы, из-за особенностей электронного строения этой функциональной группы, значительно увеличена способность к гетеролитическому расщеплению связи О – Н и подвижность ее протона.
54. Характеристические частоты валентных колебаний S – Н тиолов и тиофенолов имеют диапазон (см –1): –1. 3500 – 3300; –2. 3100 – 3000; –3. 3000 – 2800; +4. 2600 – 2550; –5. 2300 – 2100. Характеристические частоты валентных колебаний группы S – H тиолов и тиофенолов имеют значения 2600-2550 см-1, наиболее низкие в ряду частот колебаний групп О – Н, N – H, C – H, S – H. Связь S – H имеет в этом ряду максимальную длину и минимальную энергию.
55. Характеристические частоты валентных колебаний N – Н первичных и вторичных аминов имеют диапазон (см –1): +1. 3500 – 3300; –2. 3100 – 3000; –3. 3000 – 2800; –4. 2600 – 2550; –5. 2300 – 2100. Характеристические частоты валентных колебаний группы N – H аминов имеют значения 3500-3300 см-1, несколько меньшие, чем у группы О – Н. Такое различие характеристических частот согласуется с уменьшением энергии связи N-Н относительно О-Н.
56. Характеристические частоты валентных колебаний С ≡ N нитрилов имеют диапазон (см –1): –1. 3600 – 3200; –2. 3000 – 2800; +3. 2300 – 2200; –4. 1740 – 1680; –5. 1680 – 1600. Характеристические частоты валентных колебаний группы C º N нитрилов имеют значения 2300-2200 см-1, несколько более высокие, чем у группы С º С алкинов, такое различие согласуется с тем, что связь С º N более короткая и прочная (больше энергия связи).
57. Характеристические частоты валентных колебаний С = О альдегидов и кетонов имеют диапазон (см –1): –1. 3600 – 3200; –2. 3000 – 2800; 3. 2300 – 2200; +4. 1740 – 1680; –5. 1680 – 1600. Характеристические частоты валентных колебаний группы С = О, альдегидов и кетонов имеют значения 1740-1680 см-1, несколько более высокие, чем у группы С = С алкенов. Такое различие частот колебаний согласуется с тем, что связь С = О более короткая и прочная.
58. Характеристические частоты валентных колебаний С = О карбоновых кислот лежат внутри диапазона (см –1): –1. 3600 – 3200; –2. 3000 – 2800; –3. 2300 – 2200; +4. 1740 – 1680; –5. 1680 – 1600. Характеристические частоты валентных колебаний группы С = О в составе функциональной группы карбоновых кислот имеют значения 1740-1680 см-1 и, практически, не отличаются от частот колебаний этой группы у альдегидов и кетонов.
59. Характеристическая полоса 2110 см–1 может соответствовать инфракрасному спектру: +1. циклогексина; +2. n – нитрофенилдиазоний хлорида; –3. 4 – нитро – 4′ - сульфоазобензола; –4. бензилового спирта; +5. гексина – 1. Характеристическая частота 2110 см-1 соответствует валентным колебаниям группы атомов с тройной связью. Такую характеристическую группу среди предложенных соединений имеют циклогексин (С º С), n-нитрофенил диазоний хлорид (NÅ º N) и гексин-1 (С º С).
60. Характеристическая полоса 1715 см–1 может соответствовать инфракрасному спектру: +1. циклогексанона; –2. стирола (винилбензол); –3. ментола (2 – изопропил – 5 – метил – циклогексанол); +4. глутаровой кислоты; +5. бензальдегида. Характеристическая полоса 1715 см-1 соответствует характеристической группе атомов С=О. Такую характеристическую группу среди предложенных соединений имеют циклогексанон (>С=О), глутаровая кислота (>С=О в составе карбоксильной функциональной группы), бензальдегид (>С=О в составе альдегидной функциональной группы).
61. Характеристическая полоса в диапазоне 1740 – 1680 см–1 может соответствовать инфракрасному спектру: –1. арена; –2. алкена; +3. альдегида; +4. кетона; – 5. азосоединения. Характеристическая полоса в диапазоне 1740-1680 см-1 инфракрасного спектра может соответствовать характеристической группе С=О. Поэтому следует выбрать альдегид и кетон.
62. Инфракрасный спектр с набором нескольких полос поглощения в диапазоне 1600 – 1450 см–1, может соответствовать: –1. ацетальдегиду; +2. фенолу; –3. циклогексену; +4. метилфенилкетону; –5. циклогексанолу. Несколько полос поглощения в диапазоне 1600-1450 см-1 инфракрасного спектра характерны для группы С=С ароматического ядра. Такую характеристическую группу имеют среди предложенных молекулы фенола и метилфенилкетона.
Дата добавления: 2015-11-26 | Просмотры: 1776 | Нарушение авторских прав |
 3. n à σ*;
3. n à σ*; 4. n à π*;
4. n à π*; 5. n à π*.
5. n à π*.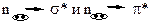 электронные возбуждения обеспечивает строение молекулы ацетона (диметилкетона), потому что в этой молекуле присутствуют σ- и π- ковалентные связи, а также есть гетероатом с пиридиновым строением.
электронные возбуждения обеспечивает строение молекулы ацетона (диметилкетона), потому что в этой молекуле присутствуют σ- и π- ковалентные связи, а также есть гетероатом с пиридиновым строением.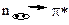 является наиболее длинноволновым, то есть имеет достаточно небольшую энергию возбуждения. Поэтому соответствующее этому возбуждению поглощение энергии регистрируется в области выше 200 нм.
является наиболее длинноволновым, то есть имеет достаточно небольшую энергию возбуждения. Поэтому соответствующее этому возбуждению поглощение энергии регистрируется в области выше 200 нм.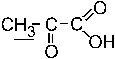 1. 3;
1. 3;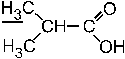 1. 1;
1. 1;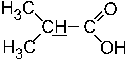 1. 1;
1. 1;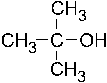 1. 3: 3: 3: 1;
1. 3: 3: 3: 1;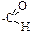 состоит из двух характеристических групп: С=О и С-Н).
состоит из двух характеристических групп: С=О и С-Н).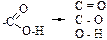 .
. .
.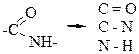 характеристические группы.
характеристические группы.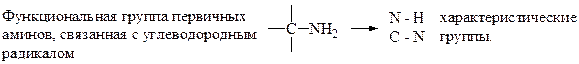
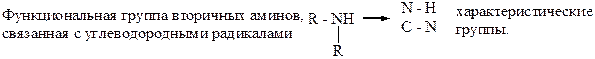
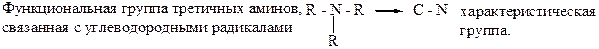
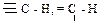 и
и 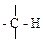 , также соответствует некоторому увеличению длины и уменьшению прочности связи С – Н. Поэтому характеристические частоты валентных колебаний С – Н алканов имеют диапазон 3000-2800 см-1, т.е. наиболее низкие значения для данного ряда групп.
, также соответствует некоторому увеличению длины и уменьшению прочности связи С – Н. Поэтому характеристические частоты валентных колебаний С – Н алканов имеют диапазон 3000-2800 см-1, т.е. наиболее низкие значения для данного ряда групп.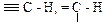 и
и 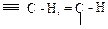 и
и