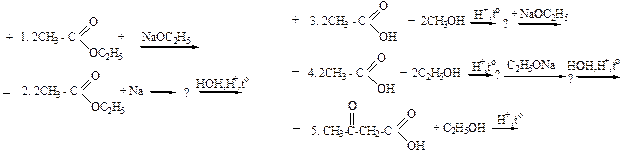|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ПЕПТИДЫ И БЕЛКИ.1. Строение (2 S)-2-амино-3-метилбутановой кислоты имеет природная a-аминокислота: – 1. лейцин; – 2. изолейцин; +3. валин; – 4. тирозин; – 5. лизин. Строение (2 S)-2-амино-3-метилбутановой кислоты имеет природная a-аминокислота валин, которая является производной от бутановой кислоты с заместителями – у С2 – аминогруппа, у С3 – метильный радикал. Конфигурация хирального центра при С2 в R,S – системе S. Эта конфигурация характерна для природных a-аминокислот в составе белковых молекул (кроме цистеина).
2. Строение (2 S)-2-амино-3-гидроксибутановой кислоты имеет природная a-аминокислота: +1. треонин; – 2. валин; – 3. фенилаланин; – 4. триптофан; – 5. серин. Строение (2 S)-2-амино-3-гидроксибутановой кислоты имеет природная a-аминокислота треонин, которая является производной бутановой кислоты с заместителями у С2 – аминогруппа, у С3 – гидроксигруппа. Конфигурация хирального центра при С2 в R,S – системе S. Эта конфигурация характерна для природных a-аминокислот в составе белковых молекул (кроме цистеина).
3. Строение (2 S)-2,6-диаминогексановой кислоты имеет природная a-аминокислота: – 1. глицин; – 2. аспагин; – 3. аргинин; – 4. глутаминовая кислота; +5. лизин. Строение (2 S)-2,6-диаминогексановой кислоты имеет природная a-аминокислота лизин, которая является производной от гексановой кислоты с заместителями у С2 и С6 аминогруппа. Конфигурация хирального центра при С2 в R,S – системе S. Эта конфигурация характерна для природных a-аминокислот в составе белковых молекул (кроме цистеина).
4. Строение (2 S)-2-амино-4-метилпентановой кислоты имеет природная a-аминокислота: – 1. изолейцин; – 2. глутамин; – 3. цистеин; +4. лейцин; – 5. метионин. Строение (2 S)-2-амино-4-метилпентановой кислоты имеет природная a-аминокислота лейцин, которая является производной от пентановой кислоты с заместителями у С2 – аминогруппа, у С4 – метильный радикал. Конфигурация хирального центра при С2 в R,S – системе S. Эта конфигурация характерна для природных a-аминокислот в составе белковых молекул (кроме цистеина).
5. Строение (2 S)-2-амино-3-(1Н-индолил-3) пропановой кислоты имеет природная a-аминокислота: – 1. гистидин; – 2. пролин; +3. триптофан; – 4. аспарагиновая кислота; – 5. фенилаланин. Строение (2 S)-2-амино-3-(1Н-индолил-3) пропановой кислоты имеет природная a-аминокислота триптофан, которая является производной от пропановой кислоты с заместителями у С2 – аминогруппа, у С3 – индол. Конфигурация хирального центра при С2 в R,S – системе S. Эта конфигурация характерна для природных a-аминокислот в составе белковых молекул (кроме цистеина).
6. К числу незаменимых природных a-аминокислот относятся: – 1. асн (Asn); +2. мет (Met); +3. фен (Phe); +4. лиз (Lys); – 5. ала (Ala). Природные a-аминокислоты метионин (Met), фенилаланин (Phe), лизин (Lys) относят к незаменимым потому, что они не синтезируются в организме человека, а поступают с пищей. Их недостаток в организме приводит к различным патологиям.
7. К числу незаменимых природных a-аминокислот относятся: +1. вал (Val); +2. три (Try); – 3. гли (Gly); – 4. цис (Cys); +5. тре (Thr). Природные a-аминокислоты валин (Val), триптофан (Try), треонин (Thr) относят к незаменимым потому, что они не синтезируются в организме человека, а поступают с пищей. Их недостаток в организме приводит к различным патологиям.
8. К числу незаменимых природных a-аминокислот относятся: – 1. сер (Ser); – 2. асп (Asp); +3. лей (Leu); – 4. про (Pro); +5. иле (Ile). Природные a-аминокислоты лейцин (Leu), изолейцин (Ile) относят к незаменимым потому, что они не синтезируются в организме человека, а поступают с пищей. Их недостаток в организме приводит к различным патологиям.
9. Практически, все природные a-аминокислоты; +1. имеют хиральные молекулы; +2. являются L-стереоизомерами; – 3. являются незаменимыми; +4. имеют S-конфигурацию второго атома углерода; – 5. являются ароматическими карбоновыми кислотами. Анализ структуры природных a-аминокислот показывает, что практически они все, кроме глицина, имеют хиральные молекулы, так как при С2 у них четыре разных соседа и атом асимметричен. Природные a-аминокислоты являются L-стереоизомерами по хиральному атому С2, а в системе R,S по этому атому имеют конфигурацию S (кроме цистеина).
10. Природный лейцин по конфигурации заместителей у второго атома углерода: – 1. относится к D-стереохимическому ряду; +2. относится к L-стереохимическому ряду; – 3. является R-стереоизомером; – 4. не может быть охарактеризован, т.к. ахирален; +5. является структурным изомером изолейцина. Природная a-аминокислота лейцин у второго атома углерода, который хирален, имеет конфигурацию заместителей в D L системе L, поэтому её относят к L-стереохимическому ряду. Эта конфигурация характерна для природных a-аминокислот в составе белковых молекул (кроме цистеина). Лейцин (2S)-2-амино-4-метилпентановая кислота и изолейцин (2S)-2-амино-3-метилпентановая кислота являются структурными изомерами.
11. Не имеет стереоизомеров (молекулы ахиральны) природная a-аминокислота: – 1. глутамин; – 2. изолейцин; – 3. пролин; +4. глицин; – 5. аргинин. Анализ структуры природных a-аминокислот показывает, что практически все они имеют хиральные молекулы, так как при С2 имеется четыре разных соседа и их молекулы асимметричны, только у глицина молекула ахиральна, поэтому у него нет конфигурационных стереоизомеров.
12. Нейтральными a-аминокислотами являются: +1. вал (Val); +2. гли (Gly); – 3. арг (Arg); +4. сер (Ser); – 5. асп (Asp). Природные a-аминокислоты валин (Val), глицин (Gly), серин (Ser) относят к нейтральным так как в растворе они образуют внутренние соли, а их боковые радикалы не содержат функциональных групп, способных к самостоятельной ионизации. Поэтому их водные растворы имеют среду близкую к нейтральной. Выделение группы нейтральных a-аминокислот – это один из способов их классификации по признаку, в основу которого положено, поведение аминокислоты в растворе.
13. Основными a-аминокислотами являются: – 1. ала (Ala); – 2. иле (Ile); – 3. сер (Ser); +4. лиз (Lys); +5. арг (Arg). Природные a-аминокислоты лизин (Lys) и аргинин (Arg) – это основные аминокислоты. Выделение группы основных a-аминокислот – это один из способов их классификации, в основу которой положено поведение аминокислоты в водном растворе. Присутствие в структурах лизина и аргинина нескольких аммониевых основных центров, часть из которых находятся в боковом радикале и ионизируются в растворе, объясняет выраженные основные свойства данных a-аминокислот, рН их водных растворов больше 7.
14. Кислыми a-аминокислота: – 1. тре (Thr); +2. асп (Asp); – 3. глн (Gln); – 4. цис (Cys); +5. глу (Glu). Природные a-аминокислоты аспарагиновая кислота (Asp) и глутаминовая кислота (Glu) – это двухосновные моноаминокислоты их относят к кислым a-аминокислотам. Выделение группы кислых a-аминокислот – это один из способов их классификации, в основу которого положено, поведение аминокислоты в водном растворе. Присутствие в структуре аспарагиновой и глутаминовой кислот двух карбоксильных групп одна из которых находится в боковом радикале и ионизируется при растворении аминокислот в воде, объясняет кислую реакцию среды их водных растворов.
15. Гидрофобными являются природные a-аминокислоты: – 1. гли (Gly); – 2. лей (Leu); +3. фен (Phe); – 4. тир (Tyr); +5. мет (Met). Природные a-аминокислоты лейцин (Leu) и метионин (Met) имеют в своей структуре неполярные гидрофобные радикалы, поэтому их относят к гидрофобным a-аминокислотам.
16. Гидрофобными являются природные a-аминокислоты: +1. ала (Ala); +2. вал (Val); – 3. сер (Ser); – 4. асн (Asn); – 5. глу (Glu). Природные a-аминокислоты аланин (Ala) и валин (Val) имеют в своей структуре неполярные гидрофобные радикалы, поэтому их относят к гидрофобным a-аминокислотам. Выделение группы гидрофобных a-аминокислот – это один из способов их классификации.
17. Гидрофильными неионогенными являются природные a-аминокислоты: – 1. ала (Ala); – 2. вал (Val); +3. сер (Ser); +4. асн (Asn); – 5. глу (Glu). Природные a-аминокислоты серин (Ser) и аспарагин (Asn) имеют в своей структуре гидрофильные неионогенные функциональные группы в боковом радикале, поэтому их относят к гидрофильным неионогенным a-аминокислотам. Выделение группы гидрофильных a-аминокислот – это один из способов их классификации.
18. Гидрофильными ионогенными являются природные a-аминокислоты: +1. лиз (Lys); – 2. тре (Thr); +3. тир (Tyr); – 4. про (Pro); +5. глу (Glu). Природные a-аминокислоты лизин (Lys), тирозин (Tyr) и глутаминовая кислота (Glu) имеют в своей структуре (в боковом радикале) гидрофильные, способные к самостоятельной ионизации в водном растворе функциональные группы, поэтому их относят к гидрофильным ионогенным a-аминокислотам. Выделение группы гидрофильных a-аминокислот – это один из способов их классификации.
19. Глицин (2-аминоэтановая кислота) образует соли в реакциях с: +1. Н2SO4; – 2. CH3CH2OH; – 3. CH3-I; +4. NaOH;
Природная a-аминокислота глицин (Glu) имеет в своей структуре амино- группу и карбоксильную группу и как гетерофункциональное соединение способна образовывать соли с кислотами по аминогруппе, как первичный амин, например с Н2SO4, а как карбоновая кислота, соли с основаниями, например, с гидроксидом натрия.
20. Фенилаланин ((2S)-2-амино-3-фенилпропановая кислота) образует сложный эфир в реакции с: –1. H2SO4; +2. CH3CH2OH (H2SO4); –3. NaOH –4. формальдегид; –5. CH3CH2Cl. Природная a-аминокислота фенилаланин (Phe) имеет в своей структуре карбоксильную группу, поэтому может вступать в реакцию этерификации, выступая как субстрат в SN реакции со спиртами в кислой среде. При этом образуются сложные эфиры, это характерная реакция карбоновых кислот.
21. Лейцин ((2 S)-2-амино-4-метилпентановая кислота) в реакции с метилиодидом: –1. образует метиловый эфир карбоновой кислоты; –2. не образует никаких продуктов; –3. расщепляет свой углеродный скелет; –4. декарбоксилируется; +5. метилируется по аминогруппе. Природная a-аминокислота лейцин (Leu) имеет в своей структуре аминогруппу, поэтому она способна вступать в реакцию с галогеналканами и выступает при этом как нуклеофильный реагент, т.е. метилируется метилиодидом по аминогруппе. Эта реакция характерна для аминов.
22. a-Аминокислоты в реакциях с альдегидами образуют: +1. замещенные имины (продукты реакции по аминогруппе); –2. сложные эфиры (продукты реакции по карбоксильной группе); –3. соли карбоновой кислоты; –4. соли аминов; –5. продукты декарбоксилирование. Природные a-аминокислоты имеют в своей структуре аминогруппу и могут вступать в реакцию с альдегидами как нуклеофильные реагенты с образованием иминов (реакции AN-E). Эта реакция характерна для аминов.
23. В результате реакции a-аминокислот с азотистой кислотой (NaNO2+HCl изб.), обычно: –1. образуется соль амина; –2. образуется соль диазония; +3. выделяется азот и образуется спирт; –4. образуется N-нитрозопроизводное; –5. эта реакция невозможно. Природные a-аминокислоты имеют в своей структуре первичную аминогруппу (кроме Рro), поэтому для них как первичных алифатических аминов характерна реакция с азотистой кислотой, продуктами которой являются азот и спирт.
24. Для определения a-аминокислот используют их общие качественные реакции с: –1. CH3CH2OH (H2SO4): +2. Нингидрином; +3. CuCO3 или CuO; +4. HNO2 (NaNO2+CH3COOH); –5. CH3I. Для определения a-аминокислот используются общие качественные реакции, которыми являются реакции: с нингидрином (с образованием фиолетового растворимого соединения), с CuCO3 или CuO (с образованием комплекса раствор синего цвета) и дезаминирование с HNO2(NaNO2 + CH3COOH) с выделением азота.
25. Ксантопротеиновую реакцию (реакция с HNO3 конц.) дают a-аминокислоты; +1. ароматические; –2. алифатические; +3. фенилаланин; +4. тирозин; –5. валин. a-Аминокислоты, которые имеют в своей структуре ароматические циклы дают ксантопротеиновую реакцию. К таким a-аминокислотам из перечисленных в задании относятся фенилаланин и тирозин.
26. Качественную реакцию с раствором ацетата свинца (II) дает: –1. серин; +2. цистеин; –3. тирозин; –4. пролин; –5. аспарагин. a-Аминокислоты, которые имеют в своей структуре функциональную группу тиолов дают качественную реакцию с ацетатом свинца. Из перечисленных в задании – это цистеин.
27. Специфическими реакциями a-аминокислот при нагревании являются: +1. декарбоксилирование; –2. образование лактидов; –3. образование лактонов; +4. образование дикетопиперазинов; –5. образование лактамов. Природные a-аминокислоты относятся к гетерофункциональным соединениям, у которых функциональные группы амино- и карбоксильная, расположены по отношению друг к другу в a-положении. Для таких соединений при нагревании характерны межмолекулярные реакции нуклеофильного замещения с образованием дикетопиперазинов – циклических шестичленных амидов с двумя амидными функциональными группами. a-Аминокислоты при нагревании способны декарбоксилироваться, т.к. аминогруппа оказывает электроноакцепторное влияние на карбоксильную, что способствует выделению СО2.
28. Декарбоксилируются при нагревании легче других: +1. a-аминокислоты; –2. b-аминокислоты; –3. g-аминокислоты; –4. d-аминокислоты; –5. e-аминокислоты. a-Аминокислоты декарбоксилируются при нагревании, т.к. имеют в своей структуре функциональные группы амино- и карбоксильную, расположенные в a-положении по отношению к друг к другу. При этом аминогруппа оказывает электроноакцепторное влияние и способствует декарбоксилированию при нагревании. Изменение положения аминогруппы по цепи атомов углерода с ее удалением от карбоксильной группы уменьшает действие индуктивного эффекта аминогруппы и ее электроноакцепторное влияние, поэтому декарбоксилирование не характерно для β-, γ-, σ- и ε-аминокислот.
29. Дикетопиперазины образуют при нагревании: –1. 2-аминопропановая кислота; +2. b-аланин; +3. a-аланин; –4. 4-аминобутановая кислота; –5. 3-аминопентановая кислота. Аминокарбоновые кислоты у которых вторая функциональная группа по отношению к первой (карбоксильной) группе находится в a-положении при нагревании способны образовывать дикетопиперазины. Это специфическая реакция a-аминокарбоновых кислот (2-аминокарбоновых кислот). Для таких соединений при нагревании характерны межмолекулярные реакции нуклеофильного замещения с образованием дикетопиперазинов – циклических шестичленных амидов с двумя амидными функциональными группами. a-Аминокислоты при нагревании способны декарбоксилироваться, т.к. аминогруппа оказывает электроноакцепторное влияние на карбоксильную, что способствует выделению СО2.
30. При нагревании b-аминокислот, обычно, происходит: –1. декарбоксилирование; –2. образование лактонов; +3. образование сопряженной непредельной кислоты; –4. образование дикетопиперазина; –5. образование лактама. У аминокарбоновых кислот при положении аминогруппы у С3 по цепи атомов углерода (β-положение) при нагревании протекает специфическая реакция элиминированиия молекулы аммиака с образованием сопряженной непредельной кислоты. Это связано с тем, что электроноакцепторное влияние обеих функциональных групп обеспечивает подвижность протона в a-положении и способствует его отщеплению у a-СН-кислотного центра. Одновременно происходит расщепление связи углерод-азот аминогруппы, что приводит к выделению аммиака.
31. Образует лактам при нагревании: –1. 2-аминобутановая кислота; –2. 3-аминобутановая кислота; +3. 4-аминобутановая кислота; –4. 2-гидроксибутановая кислота; –5. 3-гидроксибутановая кислота. Для γ-аминокарбоновых кислот (положение аминогруппы у С4) при нагревании характерно образование лактамов. Это специфическая реакция γ-аминокислот, она связана со способностью цепи алкана к клешневидной конформации, при этом происходит сближение в пространстве амино- и карбоксильной групп и их взаимодействие. Внутримолекулярная реакция SN, сопровождается образованием циклического амида. Это соединение имеет одну амидную функциональную группу.
32. При нагревании в определенных условиях валина образуется: –1. 3-метилбутен-2-овая кислота; –2. лактам; –3. лактон; –4. лактид; +5. дикетопиперазин. При нагревании в определенных условиях a-аминокислота валин (Val) образует дикетопиперазин. Это специфическая реакция для a-аминокислот, так как электроноакцепторное влияние аминогруппы в a-положении способствует активизации электрофильного центра карбоксильной группы. При этом из двух молекул a-аминокислоты образуется циклическое соединение дикетопиперазин (шестичленный циклический амид с двумя амидными функциональными группами).
33. При нагревании в определенных условиях 3-аминопропановой кислоты образуется: +1. пропеновая кислота; –2. лактам; –3. лактон; –4. лактид; –5. дикетопиперазин. Специфической реакцией при нагревании β-аминокарбоновых кислот (3-аминокарбоновых кислот) является реакция элиминирования молекулы аммиака с образованием С2=С3 двойной связи. В a-положении увеличивается подвижность протона из-за электроноакцепторного влияния амино- и карбоксильной групп, что способствует выделению аммиака. Для 3-аминопропановой кислоты эта реакция приводит к образованию пропеновой кислоты.
34. При нагревании в определенных условиях 5-амино-2-метилпентановой кислоты образуется: –1. 2-метилпентен-2-овая кислота; +2. лактам; –3. лактон; –4. лактид; –5. дикетопиперазин. Специфической реакцией γ- и d-аминокарбоновых кислот при нагревании является образование циклических амидов - лактамов. Это связано со способностью цепи алкана к клешневидной конформации, сближению в пространстве амино- и карбоксильной групп, что приводит к внутримолекулярной реакции нуклеофильного замещения с образованием циклического амида. В нашем примере 5-амино-2-метилпентановая кислота (d-аминокислота) при нагревании переходит в лактам с шестичленным циклом.
35. В растворе a-аминокислоты лизин (изоэлектрическая точка (9.8) при рН 7 увеличено содержание формы: –1. аниона; +2. катиона; –3. диполярного иона; –4. неионизированной молекулы; –5. утверждение некорректно. a-Аминокислота лизин в изоэлектрической точке (рI 9,8) находится в основном в виде биполярного иона, который при смещении рН раствора в более кислую область относильно рН 9,8, присоединяет протон в основный центр и аминокислота переходит в катионную форму. Поэтому содержание катионной формы лизина при рН < рI 9.8 увеличено.
36. a-Аминокислота аспарагин (изоэлектрическая точка 5.41) в растворе с рН 5.41 имеет преимущественно форму: –1. аниона; –2. катиона; +3. диполярного иона; –4. неионизированной молекулы; –5. утверждение некорректно. В растворе с рН 5,41 a-аминокислота аспарагин находится в основном в виде биполярного иона. Для аспарагина рН 5.41 является изоэлектрической точкой (pI), т.е. это та величина рН раствора, при которой данная a-аминокислота имеет максимальное содержание биполярного иона (изоэлектрического состояния ионизированной частицы).
37. a-Аминокислота треонин (изоэлектрическая точка 5.6) в растворе с рН 12 имеет преимущественно форму: +1. аниона; –2. катиона; –3. биполярного иона; –4. неионизированной молекулы; –5. утверждение некорректно. a-Аминокислота треонин в изоэлектрической точке (рI 5,6) находится в основном в виде биполярного иона. Этот ион при смещении рН в более щелочную область (рН 12) переходит в анион, так как от четвертичного аммониевого катиона протон уйдет в щелочную среду и в растворе с рН 12 > рI 5,6 треонин присутствует в виде аниона.
38. По химической природе пептиды и белки являются: –1. полиэфирами; +2. полиамидами; –3. полигликозидами; –4. полинуклеотидами; –5. политерпенами. Пептиды и белки – это полимеры, мономерами которых являются a-аминокислоты, связанные друг с другом пептидной связью. По химической природе пептидная связь – это амид, поэтому пептиды и белки можно отнести к полиамидам.
39. Белки отличаются от пептидов: –1. химической природой макромолекул; +2. большей массой макромолекулы; +3. числом аминокислотных остатков в макромолекуле ñ 100; –4. числом аминокислотных остатков á 100; –5. природой пептидной связи. Белки относятся к полимерам, у которых число структурных звеньев (остатков a-аминокислот) более 100. Такой полимер имеет большую молекулярную массу. Поэтому белки отличаются от пептидов большей молекулярной массой, а также число a-аминокислотных остатков, которых должно быть более 100.
40. Первичная структура пептидов и белков: 1–. показывает пространственное строение макромолекулы; +2. показывает аминокислотную последовательность в структуре макромолекулы; +3. разрушается в результате кислого или щелочного гидролиза; –4. подвергается разрушению при денатурации белков; –5. данное понятие не имеет смысла. Первичная структура пептидов и белков отражает химическое строение макромолекулы. Она представляет собой цепь остатков мономеров (a-аминокислот), связанных между собой пептидной связью. По химической природе эта связь является амидной и способна гидролизоваться как в кислой, так и в щелочной среде при нагревании. Поэтому первичная структура пептидов и белков показывает аминокислотную последовательность в структуре макромолекулы и разрушается в результате кислотного или щелочного гидролиза.
41. К гидроксикарбоновым кислотам относят: +1. молочную кислоту; +2. яблочную кислоту; –3. глиоксиловую кислоту; –4. уксусную кислоту; +5. лимонную кислоту. Гидроксикарбоновыми кислотами называют гетерофункиональные органические соединения, которые содержат в своей структуре карбоксильную группу и спиртовый гидроксил. Из выше перечисленных соединений к ним относятся: молочная – 2-гидроксипропановая кислота, яблочная – 2-гидроксибутандиовая кислота и лимонная – 3-гидрокси-3-карбоксипентандиовая кислота.
42. Гидроксикарбоновым кислотам соответствует следующая информация: +1. являются гетерофункциональными соединениями; +2. многие являются хиральными и оптически активными соединениями; +3. содержат в молекуле карбоксильную группу и спиртовый гидроксил; +4. проявляют специфические свойства, которые зависят от взаимного расположения функциональных групп; +5. в молекуле может быть несколько функциональных групп одного класса; Гидроксикарбоновые кислоты – это гетерофункциональные соединения, содержащие карбоксильную группу и спиртовый гидроксил или несколько функциональных групп этих классов. Принадлежность соединений одновременно к карбоновым кислотам и спиртам приводит к появлению специфических свойств (специфические реакции при нагревании в определённых условиях), которые зависят от взаимного расположения функциональных групп. В молекулах многих гидроксикарбоновых кислот есть асимметрический атом углерода, поэтому они хиральны и оптически активны.
43. Наиболее сильные кислотные свойства проявляют гидроксикарбоновые кислоты: +1. 2-гидроксипропановая кислота; –2. 3-гидрокси-2-метилпропановая кислота; +3. 2-гидроксибутановая кислота; –4. 3-гидрокси-2-изопропилбутановая кислота; –5. 4-гидрокси-2-метилбутановая кислота. Гидроксикарбоновые кислоты имеют в своей структуре карбоксильную группу и проявляют достаточно сильные кислотные свойства. Эти свойства увеличиваются из-за электроноакцепторного влияния гидроксильной группы и тем сильнее, чем она ближе к карбоксильной группе. Поэтому наиболее сильные кислоты это 2-гидроксикарбоновые кислоты.
44. В результате реакции 2-гидроксибутановой кислоты с избытком этилового спирта в кислой среде при нагревании образуются: – 1. этил-2-гидроксибутаноат и одна молекула воды; – 2. этилбутаноат и две молекулы воды; +3. этил-2-этоксибутаноат и две молекулы воды; – 4. этоксипрпан, одна молекула воды и одна молекула CO2; – 5.2-этоксибутановая кислота и одна молекула воды. 2-Гидроксибутановая кислота это гетерофункциональное соединение, в котором содержатся карбоксильная и гидроксильная (спиртовая) группы, поэтому для неё характерны реакции обоих классов органических соединений. В присутствии этилового спирта в кислой среде протекает SN реакция этерификации с образованием сложного эфира по карбоксильной группе. При избытке спирта и нагревании происходит SN реакция с образованием простого эфира по спиртовой группе. Побочный продукт в обоих случаях – это вода. Таким образом, с избытком этилового спирта в кислой среде при нагревании образуется этил-2-этоксибутаноат и 2 молекулы Н2О.
45. Практически все гидроксикарбоновые кислоты имеют: +1. разные по силе ОН-кислотные центры; +2. разные по силе электрофильные центры; – 3. π, π-сопряженную систему; +4. р-π-сопряженную систему; – 5. несколько спиртовых гидроксильных групп; Особенностями структуры гидроксикарбоновых кислот является то, что они имеют карбоксильную и гидроксильную (спиртовую) функциональные группы, поэтому у них есть одноименные реакционные центры – это ОН-кислотные (их два) и электрофильные (их также два). Сильный ОН-кислотный центр в карбоксильной группе (sp2- гибридные атомы С и O образуют трехцентровую р-π-сопряженную систему, что способствует формированию сильного кислотного центра), и слабый ОН-кислотный центр в спиртовой. Гидроксикарбоновые кислоты также как карбоновые кислоты и спирты, вступают в реакции SN в качестве субстратов. При этом сила электрофильных центров разная и она определяется особенностями структуры карбоксильной и спиртовой гидроксильной функциональных групп.
46. Характерными для насыщенных гидроксикарбоновых кислот являются реакции: +1. реакция окисления; +2. реакция этерификации; – 3. реакция полимеризации; +4. реакция дегидратации; +5. реакция замещения у тетрагонального атома углерода; Гидроксикарбоновые кислоты как гетерофункциональные соединения вступают в реакции, характерные, как для карбоновых кислот, так и для спиртов. По карбоксильной группе идёт реакция этерификации со спиртами в кислой среде (SN реакция). По спиртовой группе идут реакции как у одноатомного спирта – окисление, дегидратация (при t> 140oС и H2SO4 конц.), замещение у тетрагонального атома углерода (реакции SN по электрофильному центру на Сsp3гибридном).
47. При нагревании a-гидроксикарбоновых кислот в присутствии серной кислоты происходит: – 1. образование лактама; – 2. дегидратация с образованием непредельной карбоновой кислоты; – 3. декарбоксилирование с образованием спирта; +4. расщепление с образованием альдегида и метановой кислоты; – 5. полимеризация с удлинением цепи атомов углерода. Принадлежность гидроксикарбоновых кислот одновременно к карбоновым кислотам и спиртам приводит к появлению специфических свойств (специфические реакции при нагревании в определённых условиях). Специфической реакцией для a-гидроксикарбоновых кислот при нагревании в присутствии серной кислоты является реакция расщепления С1-С2-σ-связи с образованием альдегида и метановой кислоты. Гидроксильная группа своим электроноакцепторным влиянием способствует этому процессу.
48. Образуются лактоны при нагревании: – 1. a-гидроксикарбоновых кислот; +. γ-гидроксикарбоновых кислот; – 3. β-гидроксикарбоновых кислот; + δ-гидроксикарбоновых кислот; – 5. γ-оксокарбоновых кислот. Для гидроксикарбоновых кислот характерны специфические свойства (специфические реакции при нагревании в определённых условиях). Так для γ- и δ-гидроксикарбоновых кислот специфической реакцией при нагревании является образование лактона – циклического сложного эфира, содержащего одну сложноэфирную группу. Это связано со способностью цепи алкана к клешневидной конформации, сближению в пространстве гидроксильной и карбоксильной функциональных групп и их взаимодействию в реакции внутримолекулярной этерификации (SN реакции).
49. Специфической реакцией при нагревании a-гидроксикарбоновых кислот является: – 1. образование лактама; – 2. образование лактона; +3 образование лактида; – 4. образование дикетопиперазина; – 5. образование сложного эфира. a-Гидроксикарбоновые кислоты при нагревании в определённых условиях образуют лактиды (шестичленный циклический диэфир, он содержит две сложноэфирные группы). Это специфическая реакция для α- гидроксикарбоновых кислот, так как α-положение гидроксильной группы в способствует протеканию реакции межмолекулярной этерификации (SN реакции).
50. При нагревании β-гидроксикарбоновых кислот, обычно, происходит: – 1. расщепление с образованием альдегида и муравьиной кислоты; +2. дегидратация с образованием непредельных карбоновых кислот; – 3. образование циклического сложного эфира лактида; – 4. образование циклического сложного эфира лактона; – 5. декарбоксилирование. Специфической реакцией при нагревании β-гидроксикарбоновых кислот, является дегидратация с образованием непредельной карбоновой кислоты (реакция элиминирования Е). Это связано с тем, что электроноакцепторное влияние гидроксильной и карбоксильной функциональных групп увеличивает подвижность протона у атома углерода в a-положении (возникает a-СН-кислотный центр). Поэтому при нагревании происходит расщепление связей С2-Н и С3-ОН с выделением воды и образованием двойной связи по С2-С3 положению.
51. При нагревании молочной кислоты (2-гидроксипропановой) образуются: – 1. ангидрид и Н2О; +2. лактид и Н2О; – 3. лактам и Н2О; – 4. дикетопиперазин и Н2О; – 5. ненасыщенная карбоновая кислота и Н2О. Молочная кислота (2-гидроксипропановая) – это гетерофункциональное соединение, содержащее карбоксильную группу и спиртовый гидроксил в a-положении, поэтому она относится к a-гидроксикарбоновым кислотам. Специфической реакцией для a-гидроксикарбоновых кислот при нагревании в определённых условиях является реакция межмолекулярной этерификации (реакция SN) с образованием – лактида (шестичленного цикла с двумя сложноэфирными группам).
52. Образование простого эфира гидроксикарбоновой кислоты возможно в условиях: – 1. избыток спирта в щелочной среде при 20°С; – 2. спирт в кислой среде при 0°С; – 3. избыток спирта в кислой среде при 20°С; – 4. спирт в щелочной среде при нагревании; +5. избыток спирта при нагревании в кислой среде. Для гидроксикарбоновых кислот как гетерофункциональных соединений характерны реакции карбоновых кислот и спиртов. Как карбоновые кислоты они взаимодействуют со спиртом в кислой среде (реакция SN) с образованием сложного эфира – реакция этерификации. В условиях, когда берётся избыток спирта, в присутствии кислоты и при нагревании идет характерная для спиртов реакция SN по электрофильному центру на sp3-гибридном атоме С (у тетрагонального атома углерода) с образованием простого эфира.
53. γ-Лактамы могут быть получены: – 1. гидролизом в кислой среде γ-лактона; +2. при нагревании с аммиаком γ-лактона; – 3. реакцией с аммиаком γ-гидроксикарбоновой кислоты; – 4. при нагревании γ-гидроксикарбоновой кислоты; – 5. гидролизом в щелочной среде γ-лактона. Специфической реакцией при нагревании для γ-гидроксикарбоновых кислот является их превращение в циклические сложные эфиры – γ-лактоны (пятичленные циклические сложные эфиры с одной сложноэфирной группой), которые способны взаимодействовать с аммиаком при высокой температуре (250оС) с образованием γ-лактамов (пятичленный цикл с амидной группой). При данных условиях нагревания с аммиаком происходит замещение атома кислорода в цикле лактона на атом азот.
54. В молекулах гидроксикарбоновых кислот электроноакцепторным влиянием гидроксильной группы в a-положении на карбоксильную обусловлено усиление реакционных центров: – 1. всех; +2. электрофильного; – 3. нуклеофильного; +4. ОН-кислотного; – 5. основного. Гидроксикарбоновые кислоты - это гетерофункциональные соединения, содержащие карбоксильную и гидроксильную (спиртовый гидроксил) функциональные группы. Эти функциональные группы оказывают взаимное электроноакцепторное влияние, что приводит к изменению активности реакционных центров в каждой из этих групп. Электроноакцепторное действие гидроксильной группы на карбоксильную увеличивает активность её ОН-кислотного и электрофильного центров, что приводит к усилению кислотных свойств этой группы и её способности к SN реакциям.
55. К оксокарбоновым кислотам относят: – 1. винную кислоту; +2. пировиноградную кислоту; – 3. щавелевая кислота; +4. ацетоуксусную кислоту; +5. щавелевоуксусную кислоту. Оксокарбоновыми кислотами называются гетерофункциональные органические соединения, которые содержат в своей структуре карбоксильную и альдегидную или кетонную группы. Из перечисленных соединений к этой группе относятся: 2-оксопропановая кислота (пировиноградная), 3-оксобутановая кислота (ацетоуксусная) и 2-оксобутандиовая кислота (щавелевоуксусная).
56. Оксокарбоновым кислотам соответствует следующая информация: – 1. содержат гидроксильную (спиртовый гидроксил) и карбоксильную функциональные группы; +2. способны образовывать ацетали (кетали); +3. содержат карбонильную (альдегидную или кетонную) и карбоксильную функциональные группы; +4. являются гетерофункциональными соединениями; +5. кислотные свойства зависят от положения функциональных групп относительно друг друга. Оксокарбоновые кислоты – это гетерофункциональные соединения, содержащие в своей структуре карбоксильную и карбонильную (альдегидную или кетонную) функциональные группы, поэтому они вступают в реакции, характерные для классов веществ с этими группами. Так по карбонильной группе идет реакция AN в сухом HCl со спиртами с образованием полуацеталей и SN ацеталей. Обе функциональные группы в структуре оксокарбоновых кислот являются электроноакцепторами. Электроноакцепторное влияние карбонильной группы усиливает кислотные свойства карбоксильной группы. Это влияние тем сильнее, чем ближе функциональные группы расположены в структуре молекулы.
57. Оксокислоты с наиболее сильным a-СН-кислотным центром это: – 1. 2-оксопропановая кислота; – 2. 2-оксопентановая кислота; +3. 3-оксобутановая кислота; – 4. 4-оксобутановая кислота; +5. 2-оксобутандиовая кислота. Оксокарбоновые кислоты – это такие гетерофункциональные соединения, которые имеют в своем составе электроноакцепторные карбонильную и карбоксильную функциональные группы. В молекулах β-оксокарбоновых кислот у углерода в a-положении значительно возрастает подвижность протона и формируется активный a-СН-кислотный центр, поэтому наиболее сильный a-СН-кислотный центр имеют 3-оксобутановая и 2-оксобутандиовая кислоты.
58. Влияние оксо- группы в молекуле a-оксокарбоновой кислоты усиливает активность реакционных центров карбоксильной группы: – 1. СН-кислотного; +2. ОН-кислотного; +3. электрофильного; – 4. нуклеофильного; – 5. основного. Для оксокарбоновых кислот, как гетерофункциональных соединений, характерны реакции по каждой функциональной группе. При этом взаимное положение функциональных групп в структуре молекулы влияет на их реакционную способность, свойственную каждому классу соединений. Электроноакцепторное влияние оксогруппы в a-положении усиливает активность ОН-кислотного и электрофильного центров в карбоксильной группе.
59. Сложный эфир образуется в определенных условиях в результате реакции оксокарбоновых кислот с: – 1. СН3NH2 при нагревании; +2. С2Н5-ОН в кислой среде при нагревании; – 3. С2Н5-ОН в щелочной среде; – 4. С2Н5I в кислой среде; – 5. С6Н5-ОН в кислой среде. Для оксокарбоновых кислот как гетерофункциональных соединений характерны реакции по каждой функциональной группе. Как карбоновые кислоты они вступают в реакцию этерификации со спиртами в кислой среде при нагревании (SN реакция по электрофильному центру карбоксильной группы) с образованием сложного эфира.
60. Полуацетали и ацетали могут быть получены в реакциях оксокарбоновых кислот с: – 1. СН3I, в нейтральной среде; – 2. СН3ОН, в щелочной среде; – 3. LiH, в абсолютном эфире; +4. СН3ОН, в присутствии сухого HCl; – 5. раствором NaOH. Оксокарбоновые кислоты как гетерофункциональные соединения могут проявлять свойства характерные как для карбоновых кислот, так и для оксосоединений. Как оксосоединения в присутствии сухого HCl они способны образовывать со спиртом полуацетали и ацетали (AN, SN реакции).
61. Ацетоуксусный эфир можно синтезировать с помощью реакций по схеме:
Ацетоуксусный эфир можно синтезировать сложноэфирной конденсацией этилацетата в присутствии безводного этилата натрия, или металлического натрия по схемам 1 и 3, используя на стадии конденсации в качестве субстрата и реагента этиловый эфир уксусной кислоты, так как в его структуре присутствуют активные a-СН-кислотный и электрофильный центры. Под действием натрия или этилата натрия из молекул этилового эфира (при участии a-СН-кислотного центра) образуется карбанион, который способен, как нуклеофил атаковать электрофильный центр сложноэфирной группы (реакция SN).Прямой синтез ацетоуксусного эфира реакцией ацетоуксусной кислоты со спиртом непригоден из-за термической неустойчивости исходной кислоты (специфическое свойство β-оксокарбоновых кислот).
62. Реакция нуклеофильного замещения (SN) в молекуле оксопропановой кислоты происходит в результате атаки в соответствующий реакционный центр молекулы субстрата: +1. SOCl2; –2. NH2OH; +3. C2H5OH, (H+); –4.(CH3)2SO4; –5. C2H5Br. Для оксокарбоновых кислот как гетерофункциональных соединений характерны реакции по каждой функциональной группе. 2-Оксопропановая кислота имеет электрофильный центр на атоме углерода, карбоксильной группы, который можут атаковать нуклеофильные реагенты SOCl2 и C2H5OH в кислой среде при этом идут реакции нуклеофильного замещения (SN), характерные для карбоновых кислот. Гидроксиламин (NH2OH) как основание образует с карбоновыми кислотами соль.
63. Легко декарбоксилируются при нагревании в растворе Н2SO4: +1. 2-оксопропановая кислота; +2. 3-оксобутановая кислота; –3. 2-гидроксипропановая кислота; –4. 3-гидроксипентановая кислота; +5. 2-оксобутандиовая кислота. Оксокарбоновые кислоты – это гетерофункциональные соединения и для них характерны реакции как по карбоксильной группе, так и по оксогруппе. Вторая функциональная группа (оксогруппа) по своему влиянию является сильным электроноакцептором, поэтому она способствует протеканию при нагревании характерной для α- и β- оксокарбоновых кислот реакции декарбоксилирования. α- и β-Гидроксикарбоновые кислоты в данных условиях претерпевают другие превращения.
64. Кето-енольная таутомерия характерна для: –1. a-гидроксикарбоновых кислот; –2. β-оксокарбоновых кислот; +3. сложных эфиров β-оксокарбоновых кислот; –4. сложных эфиров γ-оксокарбоновых кислот; –5. сложных эфиров γ-гидроксикарбоновых кислот. Для сложных эфиров β-оксокарбоновых кислот характерно явление кето-енольной таутомерии. Это связано с тем, что в молекуле располагаются рядом основный (на атоме кислорода оксогруппы) и сильный кислотный (a-СН-кислотный) центры. При этом переход протона от СН-кислотного центра на основный приводит к образованию енольной группы (гидроксильной группы рядом с двойной связью). Такое явление обратимой изомеризации кетона в енол с установлением химического равновесия этих таутомеров называется кето-енольной таутомерией.
65. Сложноэфирная конденсация с образованием ацетоуксусного эфира протекает в условиях: –1. нагревания с H2SO4 сложного эфира этановой кислоты; +2. превращений сложного эфира этановой кислоты в присутствии этилата натрия; –3. превращений сложного эфира этановой кислоты в присутствии соли гидроксиламина и щелочи; –4. превращений сложного эфира пропановой кислоты в присутствии натрия металлического; –5. взаимодействия сложного эфира метановой кислоты и ацетона с этилатом натрия. Для получения сложных эфиров β-оксокислот в качестве основного способа синтеза используются сложноэфирная конденсация. Электроноакцепторное влияние сложноэфирной группы увеличивает подвижность протона в a-положении. После отщепления протона формируется карбанион, который реагирует с другой молекулой сложного эфира по её электрофильному центру (SN реакция), с образованием продукта конденсации.
66. Продуктами кетонного расщепления одной молекулы ацетоуксусного эфира являются: –1. этанол и две молекулы ацетата натрия; +2. этанол, СО2 и ацетон; –3. две молекулы этановой кислоты; –4. СО2, пропан и этанол; –5. две молеулы этановой кислоты, этанол. Этил-3-оксобутаноат, называемый обычно ацетоуксусным эфиром, широко применяется в органическом синтезе. На основе оцетоуксусного эфира получают метилкетоны (кетонное расщепление) и карбоновые кислоты (кислотное расщепление). Кетонное расщепление на завершающем этапе синтеза осуществляется гидролизом алкилацетоуксусного эфира действием разбавленных водных растворов кислот и щелочей с последующим декарбоксилированием полученной алкилацетоуксусной кислоты. Незамещенной ацетоуксусный эфир в этих условиях образует в качестве конечных продуктов этанол, СО2, ацетон. При действии разбавленных растворов щелочей или кислот ацетоуксусный эфир гидролизуется с последующим декарбоксилированием ацетоуксусной кислоты. Этот вид расщепления называется кетонным расщеплением с образованием СО2, этилового спирта и кетона-ацетона (ответ 2).
67. Какие из приведенных реакций характеризуют кислотные свойства ацетоуксусного эфира в енольной форме: –1. с бромной водой; +2. с раствором NaOH; +3. с раствором FeCl3; –4. с раствором HCl; –5. с этиловым спиртом. Структурные особенности ацетоуксусного эфира определяют две изомерные формы его существования – это кетонную и енольную, которые находятся в равновесии друг с другом. Кислотные свойства кетонной формы определяются наличием a-СН-кислотного центра, а енольной наличием ОН-кислотного центра. Ацетоуксусный эфир как ОН-кислота в енольной форме взаимодействует с растворами щелочей и образует комплекс с FeCl3.
68. Какой фрагмент молекулы ацетоуксусного эфира в оксо- или енольной форме обуславливает фиолетово-красное окрашивание в реакции с хлоридом железа (III): –1. сложноэфирная группа; –2. оксогруппа; +3. енольный гидроксил; –4. двойная углерод-углеродная связь; –5. все варианты ответа неверные. Ацетоуксусный эфир существует в двух изомерных формах, обратимо переходящих друг в друга – кетонной и енольной. Поэтому для ацетоуксусного эфира характерны реакции кетона, сложного эфира, енольного гидроксила и двойной связи. Реакция с хлоридом железа (III) является качественной на енольный гидроксил. 69. Реакции ацетоуксусного эфира с бромной водой и хлоридом железа (III) позволяют доказать: –1. р-π-сопряжение; +2. кето-енольную таутомерию ацетоуксусного эфира; –3. π-π-сопряжение в молекуле; –4. сложно-эфирную группу; –5. лактим-лактамную таутомерию соединения. Особенностью ацетоуксусного эфира является то, что он представляет собой смесь двух изомеров: кетонной (92,5%) и енольной (7,5%) форм, которые находятся в равновесии друг с другом. При добавлении к ацетоуксусному эфиру раствора FeCl3 можно наблюдать появление фиолетового окрашивания, что свидетельствует о взаимодействии его енольного гидроксила с этим соединением. Прибавляя затем по каплям бромную воду, енольную форму (реакцией двойной связи енола с бромом) переводят в бромпроизводное, о чем свидетельствует исчезновение фиолетового окрашивания.
70. Реакцию с образованием 2,4-динитрофенилгидразона дают: –1. гидроксикарбоновые кислоты; +2. оксокарбоновые кислоты; –3. аминокарбоновые кислоты; –4. дикарбоновые кислоты; –5. дигидроксикарбоновые кислоты. Оксокарбоновые кислоты имеют в своей структуре функциональную группу кетонов, поэтому они взаимодействуют с 2,4-динитрофенилгидразином с образованием 2,4-динитрфенилгидразона (реакция AN-E). Это характерная реакция оксосоединений, содержащих альдегидную или кетонную функциональную группу.
УГЛЕВОДЫ. 1. Углеводы классифицируют на: –1. нуклеотиды; +2. моносахариды; +3. олигосахариды (ди-, три- и т.д.); – 4. полинуклеотиды; +5. полисахариды. Углеводы иначе называют «сахариды», «сахара». По сложности строения их молекул и отношению к гидролизу различают моносахариды, олигосахариды (ди-, три- и т.д.) и полисахариды. Нуклеотиды включают в состав остаток молекулы моносахарида, но имеют более сложное строение и поэтому к классу углеводов не относятся.
2. D-глюкоза может быть классифицирована как: +1. моносахарид; –2. полисахарид; –3. альдопентоза; – 4. кетогексоза; +5. альдогексоза. D-глюкоза относится к классу моносахаридов, потому что имеет простейшее строение и не подвергается гидролизу с образованием более простых углеводов. D-глюкоза является «альдогексозой», поскольку «оксогруппа» в составе ее открытой формы относится к классу альдегидов, а общее количество атомов углерода в углеродной цепи – шесть.
3. D-фруктоза может быть классифицирована как: –1. дисахарид; +2. кетогексоза; –3. альдогексоза; –4. кетопентоза; +5. моносахарид. D-фруктоза относится к классу моносахаридов, потому что имеет простейшее строение и не подвергается гидролизу с образованием более простых углеводов. D-фруктоза является кетогексозой, так как «оксо»-группа в составе ее открытой формы относится к классу «кетонов», а общее количество атомов углерода в углеродной цепи – шесть.
4. Мальтоза может быть классифицирована как: –1. моносахарид; – 2. невосстанавливающий дисахарид; +3. олигосахарид; +4. восстанавливающий дисахарид; –5. полисахарид. Мальтоза относится к классу олигосахаридов, а также дисахаридов, так как ее молекула построена из остатков 2-х молекул моносахаридов. Мальтоза является восстанавливающим дисахаридом, так как 2 остатка D-глюкопиранозы в ее составе связаны между собой a(1→4) гликозидной связью. При этом остается свободным полуацетальный гидроксил во 2-м остатке моносахарида, который способен к образованию открытой формы с альдегидной группой, обладающей восстанавливающими свойствами.
5. Сахароза может быть классифицирована как: –1. моносахарид; +2. олигосахарид; –3. восстанавливающий дисахарид; +4. невосстанавливающий дисахарид; –5. полисахарид. Сахароза относится к классу олигосахаридов (дисахаридов), так как в составе ее молекулы находятся остатки 2-х моносахаридов и она подвергается гидролизу с образованием 2-х молекул моносахаридов. Сахароза является невосстанавливающим дисахаридом, так как остатки a-D-глюкопиранозы и b-D-фруктофуранозы в ее составе связаны между собой (1→2)-гликозидной связью. При этом не остается свободным полуацетальный гидроксил; не образуется открытая форма. Циклическая форма, в которой существует сахароза, не обладает восстанавливающими свойствами.
6. Целлюлоза может быть классифицирована как: –1. моносахарид; –2. олигосахарид; +3. гомополисахарид; –4. гетерополисахарид; –5. восстанавливающий дисахарид. Молекула целлюлозы построена из большого количества (2500=12000) остатков одного моносахарида – D-глюкопиранозы.
7. Моносахаридами являются: – 1. лактоза; +2. D-манноза; +3. D-рибоза; +4. D-фруктоза; –5. инулин. Молекулы D-маннозы, D-рибозы, D-фруктозы имеют простейшее строение и не подвергаются гидролитическому расщеплению с образованием более простых углеводов.
8. Дисахаридами являются: +1. сахароза; –2. D-фруктоза; –3. D-глюкоза; +4. целлобиоза; – 5. целлюлоза. Молекулы сахарозы и целлобиозы построены из 2-х остатков моносахаридов, подвергаются гидролизу и в результате гидролитического расщепления образуют 2 молекулы моносахаридов.
9. Гомополисахаридами являются: +1. крахмал; +2. гликоген; –3. лактоза; –4. мальтоза; +5. целлюлоза. Молекулы крахмала, гликогена, целлюлозы построены из большого (200-12000) количества остатков молекул одного моносахарида – D-глюкопиранозы.
10. Восстанавливающими дисахаридами являются: – 1. D-глюкоза; +2. лактоза; –3. сахароза; –4. гликоген; +5. мальтоза. Лактоза, мальтоза являются дисахаридами, так как их молекулы построены из 2-х остатков молекул моносахаридов, гидролизуются с образованием 2-х молекул моносахаридов. Данные дисахариды являются восстанавливающими, так как 2 остатка моносахаридов в их составе связаны между собой (1→4)-гликозидной связью. При этом остается свободным полуацетальный гидроксил, который обуславливает образование открытой формы с альдегидной группой, проявляющей восстанавливающие свойства.
11. К невосстанавливающим дисахаридам следует отнести: –1. целлюлоза; –2. целлобиоза; – 3. мальтоза; – 4. лактоза; +5. сахароза. Сахароза является дисахаридом, так как ее молекула построена из 2-х остатков молекул моносахаридов, гидролизуется с образованием 2-х молекул моносахаридов. Данный дисахарид является невосстанавливающим, так как остатки a-D-глюкопиранозы и β-D-фруктофуранозы в его молекуле связаны между собой (1→2)-гликозидной связью между аномерными атомами углерода. При этом не остается свободного полуацетального гидроксила. Поэтому сахароза не способна к образованию открытой формы, обладающей восстанавливающими свойствами.
12. D-глюкоза имеет D-конфигурацию заместителей у атомов углерода с порядковым номером в составе молекулы: – 1. первый; +2. второй; –3. третий; +4. четвертый; +5. пятый. У D-глюкозы в стандартной проекционной формуле Фишера гидроксигруппы расположены справа у 2,4,5 атомов углерода. Такое расположение функциональных групп соответствует D-конфигурации данных хиральных центров.
13. D-галактоза имеет D-конфигурацию заместителей у атомов углерода с порядковым номером в составе молекулы: + 1. второй; –2. третий; –3. четвертый; + 4. пятый; –5. шестой. У D-галактозы в стандартной проекционной формуле Фишера гидроксильные группы расположены справа у второго и пятого атомов углерода. Такое расположение функциональных групп соответствует D-конфигурации данных хиральных центров.
14. Принадлежность моносахарида к D-или L-стереохимическому ряду определяется конфигурацией заместителей у атома углерода в составе молекулы: –1. первый; –2. второй; + 3. асимметрический атом углерода с максимальным порядковым номером; –4. последний атом углерода; –5. асимметрический атом углерода с минимальным порядковым номером. Принадлежность моносахарида к D- или L-стереохимическому ряду согласно принятым правилам определяется конфигурацией асимметрического атома углерода с максимальным порядковым номером.
15. Молекулы D-глюкозы и L-глюкозы являются: +1. энантиомерами; –2. диастереомерами; –3. аномерами; –4. эпимерами; –5. структурными изомерами. Молекулы D-глюкозы и L-глюкозы являются энантиомерами, так как имеют одинаковое структурное строение, но противоположную конфигурацию всех асимметрических атомов углерода, то есть относятся друг от друга как предмет и несовместимое с ним зеркальное отражение.
16. Молекулы D-глюкозы и D-галактозы являются: –1. энантиомерами; +2. диастереомерами; –3. аномерами; +4. эпимерами; –5. структурными изомерами. Молекулы D-глюкозы и D-галактозы – диастереомеры, так как различаются только пространственным строением, но не являются энантиомерами, то есть не отражают зеркально конфигурацию друг друга. Данные молекулы являются эпимерами, так как различаются конфигурацией только одного (4-го) атома углерода.
17. Молекулы D-глюкозы и D-фруктозы являются: –1. энантиомерами; –2. диастереомерами; – 3. аномерами; – 4. эпимерами; +5. структурными изомерами. Молекулы D-глюкозы и D-фруктозы являются структурными изомерами, так как имеют разное структурное строение: D-глюкоза – альдогексоза, а D-фруктоза - кетогексоза.
18. Число таутомерных форм, которые возможны для D-рибозы: – 1. две; – 2. три; – 3. четыре; +4. пять; –5. возможна только открытая форма молекулы. Установлено, что любой из моносахаридов классов пентоз и гексоз образует в растворе 2 фуранозные, 2 пиранозные (циклические) формы, которые обратимо взаимопревращаются друг в друга через открытую (оксо-) форму в процессе цикло-оксотаутомерии – всего 5 таутомерных форм.
19. Таутомерное равновесие в растворе D-глюкозы образуют ее таутомерные формы: – 1. одна открытая и две пиранозные; – 2. одна открытая и две фуранозные; – 3. две пиранозные и две фуранозные; + 4. одна открытая, две пиранозные и две фуранозные; – 5. одна открытая, одна пиранозная и одна фуранозная. Открытая форма D-глюкозы относится к классам альдегидов и спиртов. Поэтому она способна к обратимой внутримолекулярной реакции нуклеофильного присоединения (AN). В результате реакции образуются устойчивые пяти- и шестичленные циклические полуацетали: соответственно фуранозная и пиранозная таутомерные формы. Электрофильный реакционный центр в альдегидной группе имеет плоское строение и одинаково доступен для атаки нуклеофильным реагентом (-ОН) с обоих сторон плоскости. Поэтому образуется по 2 аномера каждой из циклических форм.
20. Открытая форма D-глюкозы по химической природе является: –1. кетоном и многоатомным спиртом; – 2. полуацеталем и многоатомным спиртом; +3. многоатомным спиртом и альдегидом; –4. ацеталем и многоатомным спиртом; –5. карбоновой кислотой и спиртом. По химической природе функциональные группы в составе открытой формы D-глюкозы относятся к классам: оксо-группа – альдегид; гидроксильные группы – многоатомный спирт.
21. Открытая форма D-фруктозы по химической природе является: + 1. кетоном и многоатомным спиртом; –2. альдегидом; – 3. полуацеталем; – 4. ацеталем; –5. альдегидом и многоатомным спиртом. По химической природе функциональные группы в составе открытой формы D-фруктозы относят к классам: оксо-группа – кетон; гидроксильные группы – многоатомный спирт.
22. Циклические формы D-галактозы имеют химическую природу: – 1. альдегида и многоатомного спирта; – 2. кетона и многоатомного спирта; –3. ацеталя и многоатомного спирта; +4. полуацеталя и многоатомного спирта; –5. карбоновой кислоты. Функциональные группы в составе циклических форм D-галактозы по химической природе относят к следующим классам: гидроксильные – многоатомный спирт; полуацетальная (гидроксильная группа и группа простого эфира, связанные с одним атомом углерода) – полуацеталь.
23. Аномерами среди перечисленных циклических форм D-маннозы и D-фруктозы являются: – 1. a-D-маннопираноза; +2. a-D-маннофураноза; + 3. b-D-маннофураноза; – 4. b-D-фруктофураноза; – 5. a-D-фруктопираноза. Следует выбрать a-D-маннофуранозу (2) и β-D-маннофуранозу (3), поскольку аномерами называют диастереомеры, которые различаются конфигурацией только аномерного атома углерода. Конфигурации других асимметрических атомов углерода одинаковы.
24. Конфигурация аномерного атома в молекуле a-аномера одинакова с конфигурацией: –1. аномерного атома в молекуле b-аномера; –2. любого хирального центра в молекуле моносахарида; +3. «концевого» хирального центра, который определяет принадлежность моносахарида к D- или L-стереохимическому ряду; –4. второго атома углерода в молекуле моносахарида; –5. среди перечисленных вариантов нет подходящего. Согласно принятым правилам, конфигурация аномерного центра у a-аномера одинакова с конфигурацией «стереохимического ключа» – «концевого» хирального центра (асимметрического атома углерода), определяющего принадлежность к D- или L- стереохимическому ряду. Конфигурация аномерного центра у β-аномера противоположна.
25. Явлением мутаротации называют: –1. существование моносахаридов в виде равновесной смеси таутомеров; – 2. обратимые взаимные превращения открытой и циклических форм моносахаридов; 3. обратимое превращение a-аномера в b-аномера через открытую форму молекулы; +4. изменение во времени угла вращения плоскости поляризации света, то есть оптической активности, раствора углевода; – 5. обратимые превращения пиранозных форм в фуранозные через открытую форму молекулы моносахарида. Согласно определению мутаротация – это изменение во времени угла вращения плоскости поляризации света свежеприготовленного раствора углевода. Причиной мутаротации является существование в растворе моносахарида в равновесной смеси его таутомеров: a- и β- аномеров циклических (пиранозных и фуранозных) форм и открытой формы.
26. К дезоксисахарам следует отнести: – 1. D-рибоза; –2. D-глюкозамин; –3. D-сорбит; +4. 2-дезокси-D-рибоза; –5. D-галактуроновая кислота. В названии 2-дезокси-D-рибозы, в отличие от других моносахаридов, имеется приставка «дезокси»-, которая означает отсутствие атома кислорода. Поэтому в молекуле 2-дезокси-D-рибозы гидроксильная группа у С2 заменена на атом водорода.
27. К аминосахарам следует отнести: – 1. D-рибоза; + 2. D-глюкозамин; – 3. D-сорбит; – 4. 2-дезокси-D-рибоза; – 5. D-галактуроновая кислота. В названии D-глюкозамина, в отличие от других моносахаридов, присутствует название класса – амин, а в молекуле одна из гидроксильная группа у С2 заменена на аминогруппу с сохранением конфигурации хирального центра.
28. Только гликозид образуется в результате реакции моносахарида с: –1. CH3CH2I (NaOH); + 2. CH3CH2OH (HCl); 3. CH3COCl; –4. Ag (NH3)2OH при нагревании; –5. Cu (OH)2 (NaOH) без нагревания. Дата добавления: 2015-11-26 | Просмотры: 2257 | Нарушение авторских прав |