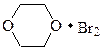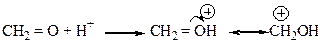|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
СПИРТЫ, ФЕНОЛЫ, ПРОСТЫЕ ЭФИРЫ, ИХ ТИОАНАЛОГИ.
1. Этиловый спирт (этанол) является: –1. вторичным; +2. одноатомным; –3. многоатомным; +4. предельным; –5. непредельным. Систематическое название (этанол) указывает, что этиловый спирт относится к предельным одноатомным спиртам, поскольку содержит насыщенный углеводородный радикал и одну гидроксильную группу.
2. Трет.-бутиловый спирт (2-метилпропанол-2) является: +1. одноатомным; –2. многоатомным; –3. первичным; +4. третичным; +5. насыщенным. Систематическое название (2-метил-пропанол-2) указывает на то, что трет.-бутиловый спирт является насыщенным спиртом, одноатомным по количеству гидроксильных групп. Поскольку гидроксильная группа связана с третичным атомом углерода, трет.-бутиловый спирт относится к третичным спиртам.
3. Аллиловый спирт (пропен-2-ол-1) является: +1. первичным; –2. вторичным; +3. одноатомным; –4. многоатомным; +5. ненасыщенным. Систематическое название аллилового спирта (пропен-2-ол-1) отражает ненасыщенность аллилового спирта (суффикс –ен-), одноатомность (отсутствие множительных приставок во втором суффиксе). Аллиловый спирт является первичным, так как гидроксильная группа связана с первичным атомом углерода.
4. Пропаргиловому спирту соответствует систематическое название: –1. пентанол-2; –2. 2-метилпропанол-1; –3. пропантриол-1,2,3; +4. пропин-2-ол-1; –5. циклогексанол. Пропаргиловый спирт относится к одноатомным непредельным спиртам, что отражает его систематическое название:
5. Глицерин является: – 1. одноатомным спиртом; – 2. двухатомным фенолом; +3. многоатомным спиртом; +4. вицинальным спиртом; – 5. геминальным спиртом. Глицерин (пропантриол-1,2,3) относится к многоатомным спиртам, содержит 3 гидроксильные группы, в положениях 1,2 и 3 углеродной цепи, т.е. гидроксильные группы связаны с соседними атомами углерода. В связи с этим глицерин является вицинальным спиртом.
6. Гидрохинону соответствует систематическое название: – 1. фенилметанол; – 2. циклогексанол; – 3. 2-изопропил-5-метилциклогексанол-1; – 4. 1,2-дигидроксибензол; +5. 1,4-дигидроксибензол. Гидрохинон относится к двухатомным фенолам, содержит гидроксильные группы в пара-положении друг к другу, ему соответствует систематическое название 1,4-дигидроксибензол.
7. Диоксану-1,4 соответствует информация: – 1. является дисульфидом; +2. является простым эфиром; +3. широко используется как растворитель; +4. расщепляется концентрированной HI при нагревании; – 5. гидролизуется в водной кислой среде. Диоксан-1,4 является циклическим простым эфиром. По химическим свойствам, как простой эфир, не подвергается гидролизу в кислой водной среде, однако, расщепляется концентрированными растворами HI, HBr либо конц. H2SO4. Он гигроскопичен, смешивается с водой и большинством органических растворителей, сам широко используется как растворитель.
8. Диэтиловому эфиру соответствует систематическое название: – 1. этантиол; – 2. 2,3-димеркаптопропанол-1; +3. этоксиэтан; – 4. 1,2,3-тригидроксибензол; – 5. этоксибензол. Простые эфиры по систематической номенклатуре называются как алкокси-, циклоалкокси-, арилокси- и т.д. производные углеводородов. Для диэтилового эфира характерно систематическое название:
9. Метилтиоэтану соответствует информация: +1. является функциональным производным тиолов; +2. относится к сульфидам; – 3. легко растворим в воде; +4. легко окисляется по гетероатому; – 5. проявляет кислотные свойства. Метилтиоэтан относится к сульфидам (R-S-R), которые можно рассматривать в качестве функциональных производных тиолов (R-SH). Сульфиды являются сернистыми аналогами простых эфиров, подобно им проявляют слабые основные свойства и плохо растворимы в воде. Сульфиды, как и тиолы, достаточно легко окисляются, превращаясь в сульфоксиды и сульфоны.
10. Вторичными спиртами являются: +1. пентанол-3; +2. изопропиловый спирт; – 3. 2-метилбутанол-2; – 4. бензиловый спирт; +5. циклогексанол. По природе атомов углерода, с которыми связана гидроксильная группа, спирты классифицируют на первичные, вторичные, третичные. У вторичных спиртов гидроксильная группа связана со вторичным атомом углерода. Такое условие соблюдается у пентанола-3, изопропилового спирта (пропанола-2) и циклогексанола.
11. Третичными спиртами являются: – 1. 1,2,3-тригидроксибензол; +2. 3-метилпентанол-3; +3. 2-метилпропанол-2; – 4. неогексиловый спирт; – 5. бензиловый спирт. Третичными являются спирты, у которых гидроксильная группа связана с третичным атомом углерода. Такое условие соблюдается у 3-метил-пентанола-3 и 2-метилпропанола-2.
12. Первичными спиртами являются: – 1. метиловый спирт; +2. бензиловый спирт; +3. изобутиловый спирт; – 4. изопропиловый спирт; – 5. циклогексиловый спирт. К первичным относятся спирты, у которых гидроксильная группа связана с первичным атомом углерода. Такое условие соблюдается у бензилового спирта (фенилметанола) и изобутилового спирта (2-метилпропанола-1).
13. Атомы кислорода являются sp3-гибридными в составе: – 1. резорцина; +2. 2,3-димеркаптопропанола-1; +3. пропен-2-ола-1; – 4. винилового спирта; +5. этиленгликоля. Тип гибридизации гетероатома совпадает с типом гибридизации связанного с ним атома углерода. В составе 2,3-димеркаптопропанола-1, пропен-2-ола-1 и этиленгликоля (этандиола-1,2) атомы кислорода гидроксильных групп связаны с sp3-гибридными атомами углерода и являются sp3-гибридными.
14. Атом кислорода является sp2-гибридными в составе: +1. β-нафтола; +2. тимола; +3. анизола; – 4. пропаргилового спирта; – 5. диэтилового эфира. Гетероатомы кислорода является sp2-гибридным в составе β-нафтола (2-гидроксинафталина), тимола (2-изопропил-5-метилфенола), и анизола (метоксибензола), т.к. гетероатомы связаны с sp2-гибридными атомами углерода.
15. Только пиррольные атомы кислорода входят в состав: +1. орто-крезола; – 2. пикриновой кислоты; – 3. ментала; 4. этоксиэтана; +5. фенетола. Для пиррольного состояния гетероатома характерно: 1) sp2-гибридизация; 2) наличие только простых связей; 3) наличие на рzAO одной из неподеленных электронных пар. Внешним признаком пиррольного строения является наличие sp2-гибридного атома углерода рядом с гетероатомом, у которого нет кратных связей. Перечисленным условиям отвечают гетероатомы в составе орто-крезола (2-метилфенола), и фенетола (этоксибензола). В составе пикриновой кислоты (2,4,6-тринитрофенола), кроме пиррольных атомов кислорода присутствуют пиридиновые гетероатомы кислорода в составе нитрогрупп.
16. В составе салицилового спирта (2-гидроксиметилфенол) атомы кислорода находятся в состоянии гибридизации: – 1. оба атома кислорода sp3-гибридны; – 2. оба атома кислорода sp2-гибридны; +3. один атом кислорода sp2-пиррольный, другой sp3-гибриден; – 4. оба атома кислорода sp2-пиридиновые; – 5. один атом кислорода sp2-пиридиновый, другой sp3-гибриден. В систематическом названии салицилового спирта (2-гидроксиметилфенол) - префикс отражает наличие гидроксильной спиртовой группы, в составе которой атом кислорода sp3-гибриден. Родоначальное название «фенол» предполагает присутствие фенольного гидроксила в составе которого присутствует sp2-пиррольный атом кислорода, на рzAO его находится неподеленная пара электронов, вступающая в р,π-сопряжение с бензольным кольцом.
17. В молекуле пропанола-1 присутствуют реакционные центры: +1. ОН-кислотный; +2. основный; +3. СН-кислотный; +4. электрофильный; +5. нуклеофильный. Реакционные центры в молекуле пропанола-1
18. В молекуле β-нафтола присутствуют реакционные центры: +1. ОН-кислотный; – 2. SH-кислотный; – 3. электрофильный; +4. нуклеофильный; – 5. СН-кислотный. β-Нафтол (2-гидроксинафталин) содержит фенольный гидроксил, в составе которого sp2-гибридный пиррольный гетероатом кислорода сопряжен с ароматическим ядром. В результате сопряжения электронная плотность неподеленной пары электронов делокализована по ароматическому кольцу, прочность связи С-О увеличена, полярность связи -ОНd+ также увеличена. Такое взаимное влияние атомов обеспечивает присутствие ОН-кислотного центра (более сильного, чем у спиртов) и слабого нуклеофильного центра на sp2-гибридном пиррольном атоме кислорода. Кроме того, фенольный гидроксил, проявляя +М > -I эффект является электронодонором, ориентантом 1 рода, что служит причиной увеличения электронной плотности в ароматическом ядре, по которому протекают реакции SE.
19. В молекуле этантиола присутствуют реакционные центры: – 1. ОН-кислотный; +2. SH-кислотный; – 3. электрофильный; +4. нуклеофильный; – 5. СН-кислотный. Тиолы содержат главным образом, SH-кислотный и нуклеофильный реакционные центры. Тиолы проявляют SH-кислотные свойства, более значительные, чем соответствующие ОН-кислоты, несмотря на то, что SH-связь является менее полярной (электроотрицательность атома серы ниже, чем атома кислорода). Повышенная кислотность SH-кислот объясняется особенностями электронной структуры атома серы, его большим атомным радиусом и поляризуемостью. Нуклеофильные свойства связаны с наличием двух пар электронов на валентном уровне атома серы и проявляются более сильно, чем соответствующие свойства у спиртов.
20. По нуклеофильному центру этилтиоэтана идут реакции: – 1. с кислотами; – 2. с основаниями; +3. с электрофильными субстратами; +4. комплексообразования с катионами тяжелых металлов; – 5. окисления. По нуклеофильному центру сульфидов протекают реакции алкилирования (SN) с образованием солей сульфония. В этих реакциях сульфиды выступают в качестве нуклеофильных реагентов, алкилгалогениды являются электрофильными субстратами. За счет большой подвижности электронных пар атома серы сульфиды легко образуют донорно-акцепторные комплексы с различными ионами металлов и другими кислотами Льюиса.
21. Нуклеофильные свойства гетероатомов возрастают в ряду соединений: +1. 2-метилфенол → 2-метилпропанол-1 → метилтиометан; – 2. этоксипропан → 2-изопропил-5-метилфенол → тиофенол; – 3. метилтиобензол → метилэтилсульфид → 1,4-дигидроксибензол; – 4. диоксан-1,4 → циклогексанол → этоксибензол; +5. пропанол-2 → пропантиол-1 → этилтиоэтан. Нуклеофильные свойства связаны с наличием неподеленных пар электронов на валентном уровне гетероатомов и увеличиваются в ряду 2-метилфенол → 2-метилпропанол-1 → метилтиометан. Нуклеофильные свойства слабее выражены у фенола (2-метилфенол), т.к. он содержит sp2-пиррольный гетероатом кислорода, пара электронов которого сопряжена и делокализована по бензольному кольцу. Несколько более сильно нуклеофильные свойства проявляются у спиртов (2-метилпропанол-1), в составе которых sp3-гибридный атом кислорода, менее электроотрицательный, чем sp2-гибридный. Наиболее сильные нуклеофильные свойства в этом ряду соединений проявляет sp3-гибридный атом серы в составе метилтиометана, имеющий высокую поляризуемость (мягкое основание по теории ЖМКО). В то же время сульфиды являются очень слабыми основаниями Бренстеда, их основность на два порядка меньше, чем у соответствующих эфиров (рКВН+(С2Н5-О-С2Н5) ≈ -3,6; рКВН+(СН3-S-СН5) ≈ -5,25). В этом проявляется несоответствие между основностью и нуклеофильностью атома серы в сульфидах. Он и обладает малым сродством к протону (жесткой кислоте Льюиса), но большим сродством к атомам, имеющим высокую поляризуемость (мягким кислотам). По этой же причине в ряду пропанол-2→пропантиол-1→этилтиоэтан – нуклеофильные свойства возрастают. У этилтиоэтана нуклеофильность несколько повышена по сравнению с тиолами за счет наличия при реакционном центре (атоме серы) двух электронодонорных радикалов (-С2Н5).
22. По нуклеофильному центру спиртов протекают реакции: – 1. с галогеноводородами; – 2. с основаниями; +3. с функциональными производными карбоновых кислот; +4. алкилирования в присутствии концентрированной H2SO4, to ~ 140оС; +5. ацетализации в присутствии каталитических количеств кислоты. Спирты в качестве нуклеофильных реагентов вступают в реакции с электрофильными субстратами: функциональными производными карбоновых кислот, алкилирующими агентами, а также с альдегидами и кетонами (реакции ацетализации в присутствии кислотного катализатора).
23. Основные свойства наиболее сильно выражены у следующего из перечисленных соединений: – 1. ментол (2-изопропил-5-метилциклогесанол); – 2. тимол (2-изопропил-5-метилфенол); +3. этилпропиловый эфир (этоксипропан); – 4. метилизобутилсульфид (1-метилтио-2-метилпропан); – 5. 2-метил-пентанол-2. Основные свойства проявляются в способности присоединять протон (по Бренстеду-Лоури). Гетероатом кислорода в составе фенолов (тимола) находится в sp2-гибридном пиррольном состоянии, пара его сопряжена, делокализована по кольцу, основность снижена. Спирты (ментол и 2-метилпентанол-2) и простой эфир (этилпропиловый эфир) содержат sp3-гибридный атом кислорода, причем у этилпропилового эфира его основные свойства увеличены за счет присутствия двух электронодонорных алкилов. Вследствие этого этилпропиловый эфир является самым сильным основанием.
24. ОН-кислотные свойства возрастают слева направо в ряду: – 1. фенол → бензиловый спирт → этанол; – 2. глицерин → изопропиловый спирт → резорцин; – 3. пирогаллол → этиленгликоль → трет.-бутиловый спирт; +4. метанол → глицерин → гидрохинон; – 5. этантиол → пропанол → резорцин. ОН-кислотные свойства спиртов (Ка = 10-16 – 10-18) слабее ОН-кислотных свойств фенолов (Ка = 10-10 – 10-11), что связано с электроноакцепторным влиянием бензольного кольца у фенолов и образованием более стабильного фенолят-аниона. Кислотность многоатомных спиртов выше, чем у одноатомных в связи с тем, что гидроксильные группы оказывают электроноакцепторное взаимное влияние. В связи с этим метанол проявляет самые слабые кислотные свойства по сравнению с глицерином и гидрохиноном.
25. По основному центру диэтилового эфира идут реакции: +1. с кислотами; – 2. с основаниями; – 3. с электрофильными субстратами; – 4. восстановления; – 5. окисления. По основному центру диэтилового эфира протекают реакции солеобразования с сильными концентрированными кислотами.
26. Растворяют гидроксид меди (II) с образованием комплекса синего цвета спирты: – 1. этанол; – 2. бензиловый спирт; +3. этиленгликоль; +4. пропантриол-1,2,3; +5. пропандиол-1,2. В щелочном водном растворе Cu(OH)2 вицинальные диолы образуют соединения, в которых ион металла связан в виде внутреннего комплекса, окрашенного в синий цвет.
27. Растворение осадка гидроксида меди (II) с образованием синего раствора комплексной соли является качественной реакцией на: – 1. непредельные углеводороды; – 2. галогенопроизводные углеводородов; – 3. одноатомные спирты; +4. многоатомные вицинальные спирты; 5. фенолы. Многоатомные вицинальные спирты с гидроксидами тяжелых металлов в щелочной среде образуют внутрикомплексные (хелатные) соединения, имеющие характерные окрашивания. В частности, при взаимодействии с гидроксидом меди (II) возникает интенсивное синее окрашивание.
28. Фенолы растворяются в: – 1. воде; – 2. насыщенном растворе NaCl; – 3. кислотах; – 4. насыщенном растворе NaHCO3; +5 щелочах. Фенолы являются слабыми кислотами (рКа ≈ 10), но значительно более сильными по сравнению со спиртами (рКа ≈ 16-18). Это определяется двумя факторами: большей полярностью ОНd+ связи и образованием стабильного фенолят-аниона, в котором отрицательный заряд значительно делокализован по кольцу. В связи с этим в водных растворах щелочей фенолы вступают в реакцию солеобразования и образуют феноляты, хорошо растворимые в воде.
29. По электрофильному центру спиртов протекают реакции: – 1. AN; +2. SN1; – 3. AN-E; +4. SN2; – 5. AE. По электрофильному центру спирты выступают в качестве субстратов и вступают в реакции нуклеофильного замещения мономолекулярного или бимолекулярного (SN1 или SN2).
30. В реакциях нуклеофильного замещения (SN) молекула спирта может выступать в качестве: +1. нуклеофильного реагента; – 2. электрофильного реагента; – 3. радикального реагента; +4. субстрата с электрофильным центром; – 5. субстрата с нуклеофильным центром. Атом кислорода в ОН-группе спиртов (R-ОН) содержит на валентном уровне две пары электронов и является нуклеофильным реагентом в реакциях алкилирования, ацилирования, ацетализации. За счет отрицательного индуктивного эффекта гидроксильной группы, связанный с ней атом углерода приобретает эффективный положительный заряд и спирт выступает в качестве электрофильного субстрата в реакциях с HCl, PCl5, PCl3, SOCl2 и ROH/H+, например.
31. Для увеличения нуклеофильных свойств спиртов используют: – 1. разбавление большим количеством воды; +2. реакцию с Na металлическим в отсутствие воды; – 3. реакцию с Na-металлическим в водной среде; – 4. кислую водную среду; – 5. нейтральную водную среду. Нуклеофильные свойства спиртов (ROH) как нуклеофильных реагентов возрастают при использовании их ионных форм – алкилоксидов RO-. Поскольку в водных растворах алкилоксиды получить не удается из-за высокой степени гидролиза продукта реакции, то получают алкилоксиды в присутствии активного металла (Na) с безводным этанолом т.е. в отсутствие воды.
32. Реакция замещения бимолекулярного (SN2) наиболее характерна для спирта: – 1. гексанола-3; – 2. 2-метилциклогексанола-1; +3. метанола; – 4. 2-метилпропанола-2; – 5. бензилового спирта. Реакция SN2 протекает через образование переходного активированного состояния и характерна для спиртов, которые не образуют устойчивого карбокатиона (первичные, кроме аллилового и бензилового, которые образуют устойчивый сопряженный карбокатион). Метанол не образует стабильного карбокатиона, для него характерен SN2 механизм.
33. Реакция замещения мономолекулярного (SN1) протекает с максимальной скоростью у спиртов: – 1. неогексилового; – 2. пропилового; – 3. трет.-бутилового; +4. бензилового; – 5. изопропилового. Реакция SN1 протекает через образование карбокатиона и характерна для спиртов, которые образуют устойчивый карбокатион, третичный либо сопряженный. Особенно высокая стабильность карбокатионов бензильного типа связана с участием соседней π-системы в делокализации положительного заряда карбоатиона. У бензильного карбокатиона в делокализации положительного заряда участвует π-система бензольного кольца, поэтому он стабильнее всех, и реакции SN1 с большей скоростью протекают у бензилового спирта.
34. Стереоспецифичными являются реакции, протекающие при хиральных электрофильных центрах спиртов-субстратов по механизму: – 1. SN1; +2. SN2; – 3. AN; – 4. AN-E; – 5. AE. Реакции SN2 протекают через образование переходного активированного состояния, в котором полуразрушена старая связь с уходящей группой и полуобразованна новая связь с атакующим нуклеофилом. Нуклеофильная атака осуществляется с тыла. Если реакционным центром в субстрате является асимметрический атом углерода, то образуется продукт с противоположной субстрату конфигурацией асимметрического атома в электрофильном центре, то есть имеет место обращение конфигурации хирального электрофильного центра. Это указывает на стереоспецифичность реакции, т.е. образование только одного из возможных стереоизомеров.
35. Протеканию реакций по механизму SN1 способствуют: +1. пространственные затруднения при электрофильном центре; – 2. образование неустойчивого карбокатиона; +3. образование стабильного карбокатиона; +4. высокая ионизирующая способность растворителя; – 5. низкая ионизирующая способность растворителя. Пространственные затруднения при электрофильном центре препятствуют подходу нуклеофила с противоположной стороны (как в SN2 процессе) и способствуют протеканию SN1-реакций. Образованию карбокатиона (через который протекают реакции SN1) помогает высокая ионизирующая способность растворителя и стабилизация карбокатиона за счет электронных факторов. Кроме того растворитель, обладающий хорошей сольватирующей способностью, например, вода или водная муравьиная кислота, стабилизирует карбокатион за счет сольватации.
36. Кислотный катализ в реакциях SN, протекающих по электрофильному центру спиртов, приводит к: – 1. увеличению растворимости спиртов; +2. образованию катионов алкилоксония; +3. стабилизации нуклеофуга (уходящей группы); +4. увеличению силы электрофильного центра; – 5. образованию карбоаниона. Кислотный катализ в реакциях SN необходим для стабилизации уходящей группы –ОН («плохой» уходящей группы). Добавление кислоты приводит к образованию катиона алкилоксония
37. Реакции элиминирования протекают с максимальной скоростью среди перечисленных у: – 1. неоамилового спирта; – 2. бутанола-1; – 3. бутанола-2; +4. трет.-бутилового спирта; – 5. изопропилового спирта. Реакции элиминирования (Е) (внутримолекулярной дегидратации) конкурируют с реакциями нуклеофильного замещения. Элиминирование у спиртов протекает как Е1, ему способствует увеличение концентрации кислоты (катализатор) и температуры. Вероятность реакций элиминирования возрастает в ряду первичные < вторичные < третичные спирты. Поэтому трет.-бутанол будет более реакционноспособен.
38. По правилу Зайцева протекает элиминирование (Е) у спиртов: – 1. пропанола-2; – 2. 2-метилпропанола-2; – 3. бутанола-1; +4. бутанола-2; +5. 2-метилбутанола-2. Правило Зайцева гласит, что если в реакции элиминирования могут образоваться несколько изомерных алкенов, то преимущественно получаются те изомеры, которые содержат наибольшее число заместителей у двойной связи. Несколько изомерных алкенов может образоваться в реакции элиминирования бутанола-2 и 2-метилбутанола-2, поэтому у них элиминирование протекает по правилу Зайцева.
39. К окислению в условиях Cr2O72-/H+, to способны: – 1. третичные спирты; +2. вторичные спирты; +3. первичные спирты; – 4. простые эфиры; – 5. сложные эфиры. Различными неорганическими окислителями (KMnO4/H2SO4, Na2Cr2O7/H2SO4, CrO3 и др.) окисляются первичные и вторичные спирты. Первичные спирты в этих условиях окисляются до альдегидов, вторичные – до кетонов. Третичные спирты устойчивы к окислению в данных условиях, для их окисления требуются более жесткие условия.
40. Изменяется окраска на розовую с фуксинсернистой кислотой после нагревания с K2Cr2O7/H2SO4 спиртов: – 1. изопропиловый спирт; +. изобутиловый спирт; +. неогексиловый спирт; – 4. втор.-бутиловый спирт; – 5. 3-метилпентанол-3. Присоединение фуксиносернистой кислоты к альдегидам лежит в основе характерной реакции окрашивания, которой часто пользуются для качественного открытия альдегидов. Если в реакции окисления спиртов K2Cr2O7/H2SO4 (to) образуются альдегиды, то окраска добавленной в реакционную смесь фуксиносернистой кислоты изменяется на розовую. Альдегиды в данном задании могут образоваться только при окислении первичных спиртов – изобутилового и неогексилового.
41. Не изменяется на розовую окраска с фуксиносернистой кислотой после нагревания с K2Cr2O7/H2SO4 спиртов: – 1. этанол; – 2. бутанол-1; +3 бутанол-2; +4 гексанол-3; +5 2-метилциклогексанол-1. Фуксиносернистая кислота является характерным реагентом на альдегиды, но не на кетоны. Если продуктом окисления спиртов являются кетоны, то окраска фуксиносернистой кислоты не изменяется до розовой. Кетоны образуются в процессе окисления вторичных спиртов: бутанола-2, гексаола-3 и 2-метилциклогексанола-1.
42. Окрашенные комплексы с FeCl3 образуют: +1 гидрохинон; – 2. 2-метилциклогексанол; +3 м-гидроксибензойная кислота; +4 фенол; – 5. бензиловый спирт. Образование окрашенных комплексных соединений и ионом Fe3+ является качественной реакцией на фенольный и енольный гидроксилы. Одноатомные фенолы дают комплексы окрашенные в сине-фиолетовый цвет, двух- и трехатомные фенолы также образуют комплексы, окрашенные в различные цвета. Гидрохинон, м-гидроксибензойная кислота и фенол содержат фенольные гидроксилы и образуют окрашенные комплексы с FeCl3.
43. Цветной реакцией с образованием индофенола можно определить: – 1. вицинальные многоатомные спирты; +2. пара-незамещенные фенолы; – 3. двухатомные спирты с любым положением функиональных групп; – 4. пара-замещенные фенолы; – 5. тиолы. Образование индофенола (реакция Либермана) протекает в водном растворе нитрита натрия в присутствии концентрированной серной кислоты с образованием n-нитрозофенола, который изомеризуется в этих условиях в n-бензохинонмонооксим. Последний конденсируется с избытком фенола в присутствии конц. H2SO4 с образованием индофенола из группы хинониминовых красителей, окрашенных в синий цвет. Поскольку нитрозирование идет преимущественно по пара-положению, в реакцию образования индофенола вступают пара-незамещенные фенолы.
44. Для идентификации простых эфиров могут быть использованы: – 1. щелочной гидролиз; +2. взаимодействие с HI (конц.); – 3. гидроксамовая проба; – 4. индофеноловая реакция; – 5. иодоформная проба. Для идентификации простых эфиров используется реакция нуклеофильного расщепления эфира концентрированной HI (или H2SO4) с последующей идентификацией продуктов реакции (галогенопроизводного, фенола, спирта).
45. Нагревание с концентрированной йодоводородной кислотой может быть использовано для определения: – 1. этиленгликоля; +2. 1,2-диметоксибензола; – 3. n-метиланилина; – 4. этилацетата; +5. фенетола. Реация взаимодействия с HI (конц.) при нагревании используется для идентификации простых эфиров, каковыми являются 1,2-диметоксибензол и фенетол (этоксибензол).
46. Проба Лукаса используется для идентификации: – 1. простых эфиров; – 2. сульфидов; +3. спиртов; – 4. фенолов; – 5. аминов. Проба Лукаса используется для идентификации первичных, вторичных и третичных алифатических спиртов с числом атомов углерода меньше 6. При взаимодействии данных спиртов, с концентрированной хлороводородной кислотой в присутствии хлорида цинка (реактива Лукаса) образуются соответствующие галогеноалканы, но с различными скоростями. Третичные спирты реагируют очень быстро с выделением несмешивающегося с водой слоя хлороалкана, вторичные – медленнее с помутнением раствора и выделением капель хлороалкана. Растворы первичных спиртов в реактиве Лукаса остаются прозрачными. Высокая реакционная способность третичных спиртов обусловлена относительно высокой стабильностью промежуточной частицы – карбокатиона.
47. Очень быстро образуется слой хлороалкана (эмульсия) при добавлении HCl конц./ZnCl2 к спиртам: +1. 2-метилбутанол-2; – 2. неогексиловый спирт; – 3. 2,2-диметилбутанол-1; +4. трет.-пентиловый спирт; – 5. изобутиловый спирт. Взаимодействие третичных спиртов с реактивом Лукаса (HCl конц./ZnCl2) представляет собой реакцию замещения (SN) и протекает с максимальной скоростью т.к. третичные спирты образуют стабильную промежуточную частицу – карбокатион. В связи с этим слой хлороалкана, несмешивающийся с водой, образуется практически мгновенно в реакции третичных спиртов (2-метилбутанола-2 и трет.-пентилового спирта) с реактивом Лукаса.
48. Только через некоторое время образуется эмульсия при добавлении HCl конц./ZnCl2 к спиртам: – 1. 3-этилгексанол-1; – 2. трет.-бутиловый спирт; – 3. неопектиловый спирт; – 4. 2,2-диметилпропанол-1; +5. изопропиловый спирт. Взаимодействие вторичных спиртов с реактивом Лукаса (HCl конц./ZuCl2) протекает с меньшей скоростью, чем у третичных, т.к. вторичные спирты образуют менее устойчивый карбокатион. В связи с этим эмульсия с выделением капель хлороалкана образуется только через 5-10 минут в реакции вторичного спирта (изопропилового) с реактивом Лукаса.
49. Остаются прозрачными в реактиве Лукаса (HCl конц./ZnCl2) спирты: – 1. 2-метилпропанол-2; – 2. бутанол-2; +3. неопентиловый спирт; – 4. бензиловый спирт; – 5. циклогексанол. Первичные спирты (неопентиловый спирт) не реагируют в заметной степени с HCl при обычной температуре даже в присутствии хлорида цинка, их растворы прозрачные. Это связано, с одной стороны, с тем, что хлорид-ион – слишком плохой нуклеофильный агент для того, чтобы эффективно участвовать в реакции замещения. С другой стороны это связано с низкой стабильностью первичного карбокатиона – промежуточной частицы при замещении по SN1 механизму. Бензиловый спирт, хотя и является первичным спиртом, также дает карбокатион, заряд которого делокализован за счет сопряжения с бензольным кольцом. Бензиловый спирт (как и аллиловый спирт) с реактивом Лукаса быстро.
50. С помощью йодоформной пробы можно идентифицировать спирты: +1. изопропиловый спирт; – 2. изобутиловый спирт; +3. втор.-бутиловый спирт; – 4. пентанол-3; +5. этанол. Йодоформная проба может быть использована для идентификации спиртов, в молекуле которых присутствует фрагмент:
При окислении данного фрагмента в условиях йодоформной пробы (I2, NaOH) образуется метилоксо-фрагмент:
51. Продуктом окисления фенола в щелочном растворе является: – 1. о-бензохинон; +2. гидрохинон; – 3. бензол; – 4. нафталин; – 5. нафтахинон-1,4. Фенолы имеют повышенную электронную плотность в бензольном кольце по сравнению с аренами, поэтому окисляются довольно легко. При окислении в щелочном растворе пероксидисульфатом из одноатомных фенолов могут быть получены двухатомные фенолы (реакция Эльбса, 1890). Обычно при этом окисляется пара-положение с образованием 1,4-дигидроксипроизводных (гидрохинон).
52. Продуктом окисления a-нафтола сильными окислителями является: – 1. о-бензохинон; – 2. n-бензохинон; +3. нафтахинон-1,4; – 4. β-нафтол; – 5. нафталин. Нафтолы окисляются легче фенолов. a-Нафтол при действии триоксида хрома превращается в 1,4-нафтахинон.
53. Продуктом окисления фенола сильными окислителями является: – 1. о-бензохинон; +2. n-бензохинон; – 3. нафталин; – 4. нафтахинон-1,4; – 5. гидрохинон. Окисление фенола сильными окислителями (триоксидом хрома, хромовой смесью и др.) приводит к образованию, наряду с другими продуктами, n-бензохинона.
54. Легче всех окисляется среди перечисленных ниже: – 1. фенол; – 2. гидрохинон; – 3. пирокатехин; – 4. резорцин; +5. пирогаллол. Мноатомные фенолы окисляются легче одноатомных, т.е. они являются более сильными восстановителями, чем одноатомные фенолы. Наиболее сильными восстанавливающими свойствами обладают трехатомные фенолы, (пирогаллол) легко окисляющиеся кислородом воздуха, особенно в щелочной среде. Так щелочной раствор пирогаллола применяют в газовом анализе для поглощения кислорода. Пирогаллол при этом окисляется с разрушением ароматического кольца.
55. Тиолы окисляются до дисульфидов под действием окислителей: +1. О2 воздуха; – 2. HNO3; +3. H2O2; – 4. KMnO4; +5. I2. Тиолы склонны к реакциям окисления протекающим по атому серы. В результате действия относительно мягких окислителей (кислород воздуха, пероксид водорода, иод, бром и др.) тиолы превращаются в дисульфиды.
56. Конечным продуктом окисления тиолов азотной кислотой является: – 1. R – S – S – R; +2. R – SO3H; – 3. R – SO2H; – 4. R – S – R; – 5. R – S(O) – R. Окисление тиолов сильными окислителями (азотной кислотой, перманганатом калия, пероксикислотами) приводит к сульфоновым кислотам (R – SO3H); промежуточным, но не конечным продуктом окисления являются малоустойчивые сульфиновые кислоты (R – SO2H).
57. Конечными продуктами окисления сульфидов сильными окислителями являются: – 1. дисульфиды; – 2. сульфоксиды; – 3. сульфоновые кислоты; – 4. сульфиновые кислоты; +5. сульфоны. При окислении сульфидов 30 % пероксидом водорода в уксусной кислоте или ацетоне, а также органическими пероксикислотами или оксидами азота образуются сульфоксиды, которые превращаются в сульфоны – конечные продукты окисления сульфидов.
58. С наиболее высокой скоростью протекает реакция SE в соединении: – 1. бензол; – 2. нафталин; +3. фенол; – 4. хлорбензол; – 5. толуол. Фенольная гидроксильная группа является электронодонором и одним из сильнейших ориентантов I рода (орто- и пара- ориентант). Она не только значительно облегчает протекание типичных реакций электрофильного замещения по сравнению с бензолом и др., но и позволяет проводить специфические для фенолов реакции со слабыми, электрофильными реагентами (альдегидами и кетонами), не имеющие аналогов в ряду аренов.
59. С наиболее высокой скоростью протекает реакция SE у фенолов: – 1. пирокатехин; +. резорцин; – 3. гидрохинон; – 4. пирогаллол; +. флороглюцин. Многоатомные фенолы достаточно активны в реакциях SE, т.к. фенольные гидроксильные группы являются электронодонорами и ориентантами I рода (орто-, пара- ориентантами). Особенно повышена склонность к реакциям SE у резорцина и флороглюцина, у которых наблюдается согласованная ориентация в бензольное кольцо.
60. Конечным продуктом бромирования фенола (SE) при комнатной температуре, без катализатора при избытке бромной воды является: – 1. орто-бромфенол; – 2. пара-бромфенол; – 3. 2,4,6-трибромофенол; +4 2,4,4,6-тетрабромоциклогексадиен-2,5-он; – 5. 2,4-дибромофенол. Бромирование фенола протекает исключительно легко при комнатной температуре без катализатора при действии бромной воды. Следствием этого является легкое, даже трудно контролируемое замещение атомов водорода сразу в трех положениях с образованием 2,4,6-трибромофенола. При избытке бромной воды реакция протекает дальше с образованием так называемого «тетрабромофенола» (2,4,4,6-тетрабромоциклогесадиен-2,5-он), который образует осадок желтого цвета. Данная реакция используется для качественного и количественного определения фенола.
61. n-Бромофенол можно получить в реакциях SE: – 1. с Br2/H2O, to комн.; – 2. с Br2/H2O, 0oC; +3. c Br2/CCl4, 0oC; +4. c Br2/CS2, 0oC; +5. с диоксандибромидом, to комн. Монобромпроизводные в реакциях SE можно получить применяя малополярные растворители и варьируя количество галогена, вводимого в реакцию с фенолом. Избирательности замещения можно достичь при получении монобромпроизводных только при тщательно подобранных условиях реакции. Так, 85%-88% выход n-бромофенола можно получить при действии брома в среде тетрахлорметана или сероуглерода при 0-5оС и при использовании комплексного соединения брома – диоксандибромида. Последний электрофильный реагент имеет большой объем и атака ортоположения фенола делается маловероятной.
диоксандибромид
62. Реакция О-ацетилирования фенола приводит к образованию: – 1. 2`-гидрксиацетофенона; – 2. 4`-гидроксиацетофенона; +3. фенилацетата; – 4. 2`, 4`-дигидроксиацетофенона; – 5. пара-толилацетата. Наличие нуклеофильного реакционного центра на атоме кислорода фенольной гидроксильной группы определяет возможность реакции с электрофилами не только по ароматическому кольцу (С-ацилирование), но и по атому кислорода (О-ацилирование). Продуктом О-ацетилирования является сложный эфир фенола и уксусной кислоты - фенилацетат (фенилэтаноат). Реакция о-ацетилирования протекает по механизму SN.
63. Реакция С-ацетилирования фенола приводит к образованию: +1. 2`-гидроксиацетофенона; +2. 4`-гидроксиацетофенона; – 3. фенилэтаноата; – 4. 2`, 4`-дигидроксиацетофенона; – 5. пара-толилацетата. Реакция С-ацетилирования протекает по механизму SE. В ней участвуют нуклеофильные центры, в орто- и пара-положениях, возникающие в ароматическом ядре фенола под влиянием электронодонорного фенольного гидроксила. С-ацетилирование фенолов по Фриделю-Крафтсу хлорангидридами или ангидридами карбоновых кислот протекает в присутствии катализатора (AlCl3) и приводит к образованию смеси продуктов 2`-гидроксиацетофенона и 4`-гидроксиацетофенона.
64. В качестве электрофильного реагента в реакции карбоксилирования фенола (реакции Кольбе-Шмитта) используется: – 1. Н2С = О; – 2. СО; +3. СО2; – 4. (СН3СО)2О; – 5. С6Н5СОСl. Реакция Кольбе-Шмитта является основным способом получения салициловой (2-гидроксибензойной) кислоты. реакция протекает по механизму SE при действии диоксида углерода (СО2) на твердые феноксиды щелочных металлов (при 125оС, давлении 5 атм.). Согласно принципу ЖМКО, слабый электрофил – диоксид углерода, являющийся мягкой кислотой Льюиса, взаимодействует с мягким основным центром феноксид-аниона, находящимся в орто-положении. В результате образуется σ-комплекс, который стабилизируется выбросом протона и превращается в салицилат-ион.
65. В качестве электрофильного реагента в реакции гидроксиметилирования используется: +1. Н2С = О; – 2. СО; – 3. СО2; – 4. (СН3СО)2О; – 5. С6Н5СОСl. Реакция гидроксиметилирования протекает по механизму SE, является, по сути, С-алкилированием, в результате которого в бензольное кольцо вводится гидроксиметильная группа – СН2ОН. В качестве электрофильного реагента в этой реакции выступает формальдегид в кислой или щелочной среде. При щелочном катализе превращение фенола в феноксид – анион повышает нуклеофильность субстрата. Кислотный катализ активирует реагент, превращая его в более активный электрофил:
66. В реакциях азосочетания фенолы являются: – 1. диазокомпонентой; +2. азокомпонентой; – 3. электрофильным реагентом; +4. нуклеофильным субстратом; – 5. кислотой. Реакция азосочетания протекает по механизму SE. В качестве субстрата необходимы соединения, содержащие активированное ароматическое кольцо (фенолы, амины). Фенолы содержат электронодонорный фенольный гидроксил и выступают в качестве нуклеофильных субстратов (азокомпонента). В качестве электрофильного реагента используется диазокатион. Соль диазония в этой реакции называется диазокомпонентой. В результате реакции азосочетания образуются азосоединения, окрашенные вещества, многие из которых используются в качестве красителей и кислотно-основных индикаторов.
67. Реакции сульфирования фенола по механизму SE соответствует информация: +1. при комнатной температуре сульфирование фенола приводит к преисущественному образованию орто-изомера; +2. при нагревании сульфирование фенола приводит к преимущественному образованию пара-изомера; +3. реакция сульфирования обратима; – 4. реакция сульфирования необратима; =5. обратимость реакции сульфирования позволяет путем нагревания получить пара-изомер. Строение и выход продуктов сульфирования зависят от температуры реакционной смеси, концентрации сульфирующего агента и продолжительности процесса. Сульфирование фенола при комнатной температуре контролируется кинетическим фактором и приводит к преимущественному образованию орто-изомера. При нагревании реакция идет под контролем термодинамического фактора и приводит к преимущественному образованию пара-изомера. Реакция сульфирования обратима, поэтому путем нагревания можно превратить орто-изомер в более устойчивый пара-изомер.
Дата добавления: 2015-11-26 | Просмотры: 2670 | Нарушение авторских прав |
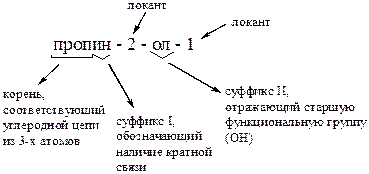
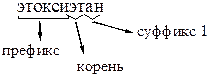
 образованы взаимным влиянием атома кислорода и связанных с ним углеводородного радикала (пропила) и атома водорода. За счет высокой электроотрицательности атома кислорода ковалентная связь
образованы взаимным влиянием атома кислорода и связанных с ним углеводородного радикала (пропила) и атома водорода. За счет высокой электроотрицательности атома кислорода ковалентная связь  является полярной, электронная плотность смещена к атому кислорода, что обеспечивает наличие ОН-кислотного реакционного центра. Атом кислорода в ОН-группе содержит на валентном уровне две пары электронов, является основным реакционным центром (местом присоединения протона водорода) и нуклеофильным центром. Связь
является полярной, электронная плотность смещена к атому кислорода, что обеспечивает наличие ОН-кислотного реакционного центра. Атом кислорода в ОН-группе содержит на валентном уровне две пары электронов, является основным реакционным центром (местом присоединения протона водорода) и нуклеофильным центром. Связь  является ковалентной полярной, гидроксильная группа проявляет отрицательный индуктивный эффект (-I(-ОН), за счет чего атом С1 приобретает эффективный положительный заряд и выступает в качестве электрофильного центра. Появление эффективного положительного заряда на атоме углерода С1 вызывает поляризацию соседней С2-С1 связи, что, в свою очередь, способствует частичному протонированию атома водорода при С2 и возникновению СН-кислотного центра при нем:
является ковалентной полярной, гидроксильная группа проявляет отрицательный индуктивный эффект (-I(-ОН), за счет чего атом С1 приобретает эффективный положительный заряд и выступает в качестве электрофильного центра. Появление эффективного положительного заряда на атоме углерода С1 вызывает поляризацию соседней С2-С1 связи, что, в свою очередь, способствует частичному протонированию атома водорода при С2 и возникновению СН-кислотного центра при нем: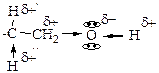
 и увеличению силы электрофильного центра за счет электроноакцепторного действия иона оксония
и увеличению силы электрофильного центра за счет электроноакцепторного действия иона оксония  -I/ЭА.
-I/ЭА.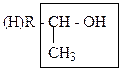
 , который содержит в a-СН-кислотном центре оксосоединения 3 атома водорода. Наличие такого фрагмента является условием протекания йодоформной пробы. Конечным продуктом реакции является йодоформ, который образуется при расщеплении молекулы трийодоксосоединения под действием щелочи. Йодоформ представляет собой желтоватый осадок со специфическим резким запахом.
, который содержит в a-СН-кислотном центре оксосоединения 3 атома водорода. Наличие такого фрагмента является условием протекания йодоформной пробы. Конечным продуктом реакции является йодоформ, который образуется при расщеплении молекулы трийодоксосоединения под действием щелочи. Йодоформ представляет собой желтоватый осадок со специфическим резким запахом.