 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
АМИНЫ. АЗО- И ДИАЗОСОЕДИНЕНИЯ.1. Первичными алифатическими аминами из предложенных ниже являются: – 1. анилин; +2. втор.-бутиламин; +3. этиламин; – 4. метиламмония хлорид; +5. неопентиламин. Эти соединения имеют первичную (-NH2) аминогруппу и один связанный с ней алифатический углеводородный радикал.
2. Первичными ароматическими аминами из предложенных ниже являются: – 1. метилфениламин; – 2. фенилдиазония хлорид; +3. фениламин; – 4. азобензол; +5. 4-нитроанилин. Эти соединения имеют первичную (-NH2) аминогруппу и один связанный с ней ароматический радикал.
3. Вторичными алифатическими аминами из предложенных ниже являются: +1. метилэтиламин; – 2. метилтриэтиламмония хлорид; – 3. дифениламин; – 4. бензолдиазогидроксид; – 5. фенилазобензол. Это соединение имеет вторичную (-NH-) аминогруппу и два связанные с ней алифатических углеводородных радикала.
4. Вторичными ароматическими аминами из предложенных ниже являются: +1. дифениламин; – 2. трет.-бутиламин; – 3. н.-пропил-изогексиламин; – 4. диметилбензиламин; – 5. аллилфениламин. Это соединение имеет вторичную (-NH-) аминогруппу и два связанные с ней ароматических радикала.
5. Третичными алифатическими аминами из предложенных ниже являются: +1. этилдиизобутиламин; – 2. 3-метиланилин; – 3. изопентил втор.-пентиламин; – 4. третпентиламин; – 5. фениламмония хлорид. Это соединение имеет третичную (
6. Смешанными аминами из предложенных ниже являются: +1. фенилэтиламин; – 2. этиламин; – 3. втор.-бутиламин; – 4. дибензиламин; +5. фенилбензилэтиламин. Эти соединения имеют два и три соответственно разные углеводородные радикалы (ароматического и алифатического строения), связанные с аминогруппой.
7. Диазосоединениями из предложенных ниже являются: +1. n-толилдиазония хлорид; – 2. азобензол; – 3. фениламин; +4. бензолдиазоний хлорид; – 5. бензиламин. Эти соединения имеют диазогруппу (-NźN), связанную с одним углеводородным радикалом.
8. Азосоединениями из предложенных ниже являются: +1. 2-[4`-метоксифенилазо] нафталин; – 2. м-этилдиазония бромид; – 3. анилин; 4. м-толилдиазотат натрия; +5. 4-[4`-диметиламинофенилазо] бензолсульфоновая кислота. Эти соединения имеют азогруппу (-N=N-), связанную с двумя углеводородными радикалами.
9. Главными реакционными центрами аминов являются: – 1. NH-кислотный; +. основный аммониевый; – 3. β-СН-кислотный; +4 нуклеофильный; – 5. основный оксониевый. Наличие этих центров обусловлено электронным строением аминогруппы. Главные химические свойства аминов - основные и нуклеофильные.
10. Алифатические амины в качестве оснований взаимодействуют с: +1 HCl; +2 H2O; – 3. KOH; – 4. метилиодид; – 5. ацетилхлорид. Эти соединения выступают в качестве кислот (доноры протона).
11. Амины в качестве нуклеофильных реагентов вступают во взаимодействие с: +1. изопропилхлоридом; – 2. Н2О; – 3. HCl; +4. уксусным ангидридом; – 5. КОН. Эти соединения предоставляют электрофильный центр, являются субстратами в реакциях нуклеофильного замещения.
12. В реакции ацилирования могут вступать следующие амины: +1. первичные алифатические; +2. первичные ароматические; +3. вторичные алифатические; – 4. третичные алифатические; +5. смешанные вторичные. Строение этих соединений обеспечивает стабилизацию промежуточной образующейся частицы.
13. При взаимодействии с азотистой кислотой образуют неустойчивые в условиях опыта соли диазония и поэтому дают продукты их дальнейших превращений: +1. метиламин; – 2. изопропил-этиламин; – 3. анилин; – 4. N,N-диметиланилин; +5. неогексиламин. Эти соединения являются первичными алифатическими аминами. При их диазотировании выделяется азот и образуется спирт.
14. При взаимодействии с азотистой кислотой дают устойчивые в условиях опыта соли диазония следующие амины: – 1. втор.-бутиламин; – 2. бензиламин; +. фениламин; + n-формиланилин; – 5. трет.-бутилфениламин. Эти соединения являются первичными ароматическими аминами, при диазотировании которых образуются соли диазония, стабилизированные влиянием ароматического радикала. 15. При взаимодействии с азотистой кислотой дают N-нитрозоамины следующие соединения: – 1. n-толуидин (n-метиланилин); +2. N-метил-4-нитроанилин; +3. этилнеогексиламин; – 4. трипропиламин; – 5. азобензол. Эти соединения являются вторичными аминами, при диазотировании которых образуются N-нитрозоамины.
16. При взаимодействии с азотистой кислотой дают С-нитрозоамины следующие соединения: – 1. 3-этиланилин; – 2. метилнеопентиламин; +3. диизобутилфениламин; – 4. три(н-гексил)амин; – 5. бензиламин. Это соединение является третичным смешанным амином, при диазотировании которого образуется С-нитрозоамин (реакция протекает по ароматическому ядру, поскольку реакционный центр на атоме азота пространственно затруднен).
17. В качестве агентов для защиты аминогруппы применяют: – 1. этилбромид; +2. пропионовый ангидрид; +3. ацетилхлорид; – 4. HCl; – 5. КОН. Эти соединения являются ацилирующими агентами, применяемыми для защиты аминогруппы. Ангидриды карбоновых кислот и ацилгалогениды имеют активный электрофильный центр и являются субстратами в реакциях нуклеофильного замещения с аминами (нуклеофильные реагенты).
18. Две полосы поглощения в области 3500-3300 см-1 характерны для спектров следующих соединений: – 1. втор.бутилизопентиламин; +2. фениламин; +3. метиламин; – 4. изопропилфениламин; – 5. триметиламин. Эти соединения являются первичными аминами (имеют первичную аминогруппу (
19. Положительную изонитрильную пробу дают следующие вещества: – 1. фенол; +2. изобутиламин; +3. анилин; – 4. втор.-пентилэтиламин; – 5. N,N-диметилфениламин. Эти соединения являются первичными аминами, для идентификации которых применяется изонитрильная проба.
20. рН > 7 имеет водный раствор следующих соединений: – 1. 2-броманилин; +2. н-бутиламин; +3. этилметиламин; – 4. дифениламин; – 5. N,N-диэтиланилин. Эти алифатические амины растворимы в воде и имеют достаточно сильные основные свойства, поэтому они способны к ионизации в растворе.
21. Выберите правильную последовательность проведения качественной реакции на первичные ароматические амины: – 1. охлаждение + NaNO2 (кр.) + исследуемое вещество + изб. HCl (конц.) + соль фенола; +2. исследуемое вещество + изб. HCl (конц.) + охлаждение + NaNO2 (кр.) + соль фенола; – 3. исследуемое вещество + изб. HCl(конц.) + NaNO2 (кр.) + нагревание + соль фенола; – 4. соль фенола + изб. HCl (конц.) + исследуемое вещество + NaNO2 (кр.) + охлаждение; – 5. исследуемое вещество + соль фенола + изб. HCl (конц.) + охлаждение + NaNO2 (кр.). Реакцию диазотирования проводят в кислой среде при 0оС, а получившееся диазосоединение вводят в реакцию азосочетания с солями фенолов или аминами. Образуется ярко окрашенное азосоединение – внешний признак реакции.
22. Наибольшими основными свойствами в водном растворе (полярный растворитель) обладает: – 1. аллиламин; – 2. этилфениламин; – 3. диметилэтиламин; +. метилэтиламин; – 5. метиламин. Метилэтиламин - это вторичный алифатический амин. Наличие двух необъемных углеводородных радикалов электродонорного характера обуславливает увеличение концентрации электронной плотности на атоме азота, и поэтому увеличение основных свойств.
23. Выделите главные реакционные центры этилфениламина: +1 ароматическое ядро; +2 основный аммониевый; – 3. NH-кислотный; +4. нуклеофильный; – 5. электрофильный. Наличие этих центров обусловлено электронным строением аминогруппы и является причиной главных свойств аминов: амины – основания и нуклеофилы. Ароматическое ядро элетронодонорным влиянием аминогруппы активировано в реакциях электрофильного замещения (SE).
24. Одна полоса поглощения в области 3500-3300 см-1 есть в спектре: – 1. первичных алифатических; +2 вторичных ароматические амины; – 3. третичных смешанные амины; – 4. первичных ароматические амины; +5 вторичных алифатические амины. Эти соединения имеют вторичную аминогруппу а
25. Выберите амины, вступающие во взаимодействие с пропаноилхлоридом: +1. неопентиламин; +2. фениламин; +3. изопропилэтиламин; – 4. изобутилметилэтиламин. – 5. дибензилфениламин. Строение первичных и вторичных аминов не создает препятствий для стабилизации промежуточной частицы в реакциях нуклеофильного замещения, в которых амины выступают нуклеофильными реагентами.
26. С какими из перечисленных ниже веществ вступает во взаимодействие анилин: – 1. NH3; +2. этилхлорид; +3. ацетилбромид; +4. HCl; – 5. NaOH. В реакциях с этилхлоридом и ацетилбромидом (имеют активный электрофильный центр) проявляются нуклеофильные свойства анилина, а с соляной кислотой - основные.
27. С какими из перечисленных ниже веществ вступает во взаимодействие трет.-бутиламин: +1. H2O; +2. H2SO4; +3. уксусный ангидрид; +4. (СН3)2SO4; – 5. КОН. С водой и серной кислотой (протолитические кислоты) проявляются основные свойства трет.-бутиламина, а с уксусным ангидридом и диметилсульфатом (электрофильные субстраты) – нуклеофильные свойства амина.
28. Соли диазония вступают в реакции, протекающие по механизмам: – 1. AN; – 2. AE; +3. SN; +4. SR; +5. SE. Реакции солей диазония с выделением азота протекают по механизму SN и SR (катион диазония – субстрат), а реакция азосочетания (пример реакции без выделения азота) – по механизму SE.
29. Реакции солей диазония с выделением N2 протекают по механизмам: – 1. SE; – 2. окисление; – 3. AN; +4. SR; +5. SN. В зависимости от природы реагента и условий реакции возможна реализация двух механизмов замещения -NźN группы: SN и SR.
30. n-Сульфобензолдиазония хлорид в качестве субстрата взаимодействует со следующими реагентами: +1. KI; +2. H2O; – 3. этилиодид; – 4. ацетилхлорид; +5. KCN. n-Сульфобензолдиазония хлорид предоставляет электрофильный центр, а KI, H2O и KCN являются нуклеофильными реагентами в реакциях нуклеофильного замещения диазогруппы.
31. В качестве восстановителей ароматических солей диазония (реакция с выделением N2) применяют: +1. фосфорноватистую кислоту; – 2. Н2О; +3. этанол; – 4. простые эфиры; – 5. сложные эфиры. Эти соединения восстанавливают соли диазония до ароматических углеводородов.
32. Реакция азосочетания протекает по механизму: – 1. AN; – 2. SN; – 3. AE; +4. SE; – 5. SR. Реакция азосочетания протекает между солью диазония (электрофильный реагент) и активированным ароматичным соединением, обычно, фенолом, амином (субстрат). В ароматическом ядре субстрата осуществляется электрофильное замещение атома водорода.
33. В качестве азокомпоненты в реакции азосочетания может выступать: +1. о-метилфенол; +2. м-метоксианилин; – 3. бензолсульфокислота; – 4. ацетофенон (метилфенилкетон); +5. анизол (метилфениловый эфир). Эти соединения выступают в качестве субстратов в реакции азосочетания (имеют активированное ароматическое ядро в результате присутствия ЭД заместителя в ядре).
34. В качестве диазокомпоненты в реакции азосочетания может выступать: – 1. азобензол; +2. фенилдиазония хлорид; +3. n-сульфофенилдиазония хлорид; – 4. анилин; – 5. м-этилфенол. Эти соединения выступают в качестве электрофильного реагента, группа (-NźN несет положительный заряд).
35. Выберите из перечисленных ниже формы диазосоединений: +1 соли диазония; +2 ковалентные диазопроизводные; – 3. азосоединения; +4 диазотаты; – 5. соли аммония. Эти формы диазосоединений существуют при разных значениях рН среды.
36. Устойчивость солей диазония увеличивается: – 1. при увеличении температуры; +2. при уменьшении рН среды; – 3. при наличии электроноакцепторного заместителя в ароматическом кольце; +4. при уменьшении температуры; +5. при наличии электронодонорного заместителя в ароматическом кольце. Соли диазония устойчивы при низких температура (0оС) в кислой среде; при делокализации положительного заряда (наличии электронодонорного заместителя) увеличивается устойчивость катиона диазония.
37. При увеличении рН раствора соль диазония претерпевает превращение в: – 1. азосоединение; +2. диазогидроксид; – 3. диазокомпоненту; +4. диазотат; – 5. соль аммония. При увеличении рН соль диазония превращается в диазогидроксид, который при дальнейшем увеличении рН переходит в диазотат.
Дата добавления: 2015-11-26 | Просмотры: 3854 | Нарушение авторских прав |
 ) аминогруппу и три связанные с ней алифатических углеводородных радикала.
) аминогруппу и три связанные с ней алифатических углеводородных радикала.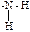 ). В области 3500-3300 см-1 для них характерны две полосы валентных колебаний (симметричные и асимметричные колебания характеристической группы).
). В области 3500-3300 см-1 для них характерны две полосы валентных колебаний (симметричные и асимметричные колебания характеристической группы).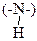 , валентным колебаниям которой соответствует одна полоса поглощения в области 3500-3300 см-1.
, валентным колебаниям которой соответствует одна полоса поглощения в области 3500-3300 см-1.