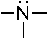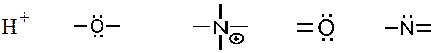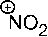|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
КИСЛОТНО-ОСНОВНЫЕ свойства органических соединений.
1. Кислотными реакционными центрами являются: –1. +2. +3. –4. +5. Кислотный реакционный центр образуют атом водорода и связанный с ним атом другого элемента.
2. Кислотными реакционными центрами являются:
1+. –2. –3. –4. +5. Кислота отдает протон, поэтому в кислотном центре всегда присутствует атом водорода, связанный с атомом, практически, любого другого элемента.
3. Кислотный реакционный центр имеют функциональные группы: + 1. – 2. –3. + 4. +5. Кислотный реакционный центр присутствует в тех функциональных группах, где есть атом водорода, связанный с атомом другого элемента.
4. Кислотный реакционный центр имеют функциональные группы: –1. сложных эфиров; –2. кетонов; +3. сульфоновых кислот; +4. аминов; –5. простых эфиров. Функциональные группы указанных классов соединений включают атомы водорода, соединенные с другими атомами, т.е. в их составе есть кислотные реакционные центры.
5. Основание это любая частица, способная быть: +1. донором электронной пары; +2. акцептором протона; –3. акцептором электронной пары; –4. донором протона; –5. акцептором энергии. Основание – любая частица, которая имеет свободную пару электронов и может предоставить ее для присоединения протона. 6. Основными реакционными центрами являются:
– 1. +2. –3. +4. +5. Так как основание – донор пары электронов, то в основном центре обязательно должна содержаться неподеленная пара электронов, доступная для реакции.
7. Основный реакционный центр имеют функциональные группы: +1. +2. +3. +4. +5. Данные функциональные группы включают атомы, которые имеют свободные пары электронов и способны принимать протон (атомы кислорода, азота).
8. Основный реакционный центр на атоме кислорода имеют функциональные группы: +1. фенолов; +2. амидов; –3. нитрилов; –4. галогенопроизводных углеводородов; +5. ангидридов. В состав функциональных групп указанных классов входит атом кислорода, на котором сконцентрирована электронная плотность.
9. Электрофильными частицами являются: –1. –2. + 3. + 4. –5. Указанные частицы имеют на валентном уровне вакантную орбиталь и могут принять пару электронов.
10. Электрофильными частицами являются: +1. +2. – 3. + 4. – 5. У указанных частиц имеется вакантная орбиталь, на которую может быть принята пара электронов.
11. Нуклеофильными частицами являются: – 1. +2. + 3. + 4. –5. Каждая из указанных частиц обладает неподеленной парой электронов, которая может быть предоставлена для образования химической связи.
12. Нуклеофильными частицами являются: +1. +2. +3. –4. –5. Указанные частицы являются донорами электронной пары, принадлежащей атому азота.
13.
Наиболее сильным основным центром молекулы никотина является: –1. π–электронная система шестичленного цикла; + 2. sр3–гибридный атом азота; –3. sр2–гибридный атом азота; –4. атом азота с пиридиновым строением; +5. атом азота в пятичленном цикле. Sp3-гибридный атом азота в пятичленном цикле обладает меньшей электроотрицательностью, чем пиридиновый азот и легче отдает на связь с протоном свою неподеленную пару электронов.
14. Наиболее сильным основным центром молекулы никотиновой кислоты является:
–1. пиридиновый атом кислорода; – 2. пиррольный атом азота; +3. пиридиновый атом азота; –4. один из sр2 –гибридных атомов кислорода; + 5. гетероатом шестичленного цикла. Азот обладает меньшей электроотрицательностью, чем кислород и легче предоставляет свою пару электронов для образования связи с протоном.
15.
Наиболее сильным ки0слотным центром молекулы оксипролина является: +1. гидроксильная группа с пиррольным строением кислорода; – 2. гидроксильная группа с sр3–гибридным кислородом; –3. N–Н кислотный центр; –4. ОН– группа, связанная с гетероциклом непосредственно; +5. ОН– группа, в составе функциональной группы карбоновых кислот. Кислород ОН-группы, входящей в состав карбоксильной группы, находится в sp2-гибридном состоянии и его электроотрицательность больше, чем таковая гетероатомов других кислотных центров данного соединения, более того, пиррольный кислород сопряжен с оксо-группой, которая является акцептором. По этим причинам связь О-Н в карбоксильной группе более полярна, а соответствующий кислоте анион более устойчив.
16. Наиболее сильным нуклеофильным центром молекулы аминалона (4–аминобута-новая кислота) является: +1. sр3 – гибридный атом азота; –2. sр2 – гибридный атом кислорода; – 3. пиридиновый атом кислорода; + 4. атом азота аминогруппы; –5. пиррольный гетероатом. Sp3-гибридный атом азота аминогруппы обладает наименьшей электроотрицательностью по сравнению с гетероатомами других нуклеофильных центров данного соединения и легче отдает свою пару электронов для образования химической связи с электрофилом.
17. Наиболее сильно выражены кислотные свойства у соединения: –1. уксусная кислота; –2. пропановая кислота; –3. 2-метилпропановая кислота; +4. 2,2,2-трихлорэтановая кислота; –5. 2-аминопропановая кислота. Электроноакцепторы увеличивают кислотные свойства, а в состав указанного соединения входят три акцепторные группы (атомы хлора).
18. Самой слабой кислотой является: +1. этанамин; –2. этанол; –3. фенол; –4. этановая кислота; –5. этантиол. В данном задании предложены соединения, в состав которых входят NH, OH и SH- кислотные центры, а так как атом азота обладает наименьшей электроотрицательностью, чем атом кислорода и меньшей поляризуемостью, чем атом серы, поэтому соединение, содержащее N-H- кислотный реакционный центр будет самой слабой кислотой.
19. Самым сильным основанием является: –1. 2-аминоэтанол; –2. этанамин; –3. метиламин; +4. диметиламин; –5. пиридин. Основные свойства более выражены у sp3-гибридных атомов азота и усиливаются электронодонорными группами (две метильные группы).
20. Основные свойства уменьшаются в ряду: –1. пиридин → этанол → этанамин; +2. этанамин → пиридин → этанол; –3. этанол → уксусная кислота → пропанол; –4. этиламин → диэтиламин → пиридин; –5. фенол → этантиол → пропанамин. В ряду этанамин → пиридин → этанол происходит уменьшение основных свойств, потому что в ряду этих соединений увеличивается электроотрицательность атома в основном центре ЭО (Nsp3) <ЭО (Nsp2) < ЭО (Osp3).
Дата добавления: 2015-11-26 | Просмотры: 2813 | Нарушение авторских прав |