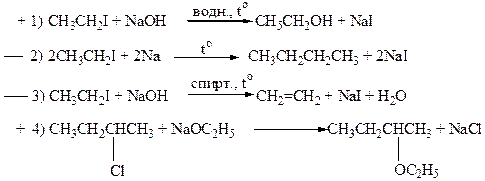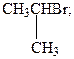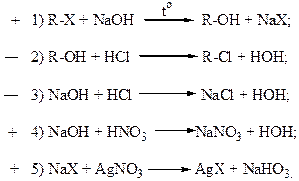|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ.1. Этилхлориду соответствует следующая информация: +1. является монохлорпроизводным этана; –2. вторичным хлоридом; –3. применяется как антисептик; +4. является первичным галогенпроизводным алифатических углеводородов; +5. используется для местной анестезии. Этилхлорид является первичным галогенпроизводным алифатического углеводорода этана, его монохлорпроизводным, так как один атом водорода замещен на атом хлора у первичного атома углерода. Этилхлорид применяется в медицине как местноанестезирующее (обезболивающее) средство, его действие обусловлено быстрым испарением этилхлорида, вызывающим сильное охлаждение.
2. Аллилгалогенидами являются: +1. 1-бромпропен-2; –2. 1-хлорпентен-1; –3. винилхлорид; –4. 1-бромпропен-1; +5. 1-хлорпропен-2. Аллилгалогенидами называют такие соединения в составе которых имеется атом галогена связанный с углеводородным радикалом 2-пропенилом, тривиальное название последнего аллил. Из приведенных в задании соединений аллил-радикал присутствует в 1-бромпропене-2 и 1-хлорпропене-2, поэтому эти вещества являются аллилгалонегидами.
3. Арилгалогенидами являются: –1. бензилхлорид; +2. b-нафтилбромид; –3. 2-хлорметилнафталин; +4. n-толилхлорид; –5. 1-бром-1фенилбутан. Арилгалогенидами называют такие соединения, в которых атом галогена непосредственно связан с ароматическим ядром. Они представляют собой разновидность ароматических соединений, а общее название всех ароматических радикалов арилы. У гомологов бензола в названии добавляется к корню суффикс –ил, отсюда для толуола –толил, для нафтола –нафтил. Из перечисленных в задании соединении к арилгалогенидам относятся β-нафтилбромид и n-толилхлорид.
4. Атом галогена является sp2-гибридным в составе: +1. 1-хлорпентен-1; –2. 2-метил-3-хлорпентан; –3. 1-хлорпентен-2; –4. бензилхлорид; +5. n-толилхлорид. В составе 1-хлорпропен-1 и n-толилхлорида атом галогена sp2-гибридный, так как он связан с sp2-гибридным атомом углерода, это вытекает из электронного строения молекул данных веществ.
5. Энергия связи углерод – галоген больше у первого галогенпроизводного в парах: +1. этилхлорид и этилиодид; –2. этилхлорид и винилхлорид; +3. винилхлорид и аллилхлорид; –4. бензилхлорид и винилхлорид; –5. бензилхлорид и хлорбензол. Энергия связи углерод-галоген увеличивается с уменьшением радиуса атома галогена от йода к фтору (уменьшается длина связи). Энергия связи углерод-галоген возрастает также в случае, когда атом галогена вступает в сопряжение (рπ-сопряжение), поэтому в перечисленных примерах больше энергия этой связи у первого галогенпроизводного в парах: этилхлорид и этилйодид, а также винилхлорид и аллилхлорид.
6. Влиянием атома галогена на углеводородный радикал обусловлены следующие реакционные центры молекул насыщенных галогенпроизводных: +1. электрофильный; –2. нуклеофильный; –3. основный; –4. ОН-кислотный; +5. b-СН-кислотный. В молекулах насыщенных галогенопроизводных влияние атома галогена на углеводородный радикал определяется его большей электроотрицательностью и смещением к нему электронной плотности, что приводит к поляризации σ-связи углерод-галоген. Это смещение электронной плотности к атому галогена обуславливает появление на атоме углерода электрофильного реакционного центра. Электроноакцепторное влияние атома галогена передается по цепи, поэтому формируется β-СН-кислотный центр.
7. Влиянием атома галогена на углеводородный радикал обусловлены следующие типы реакций насыщенных галогенпроизводных: –1. AN; +2. SN; –3. AE; –4. SE; +5. E. Распределение электронной плотности в молекулах насыщенных галогенопроизводных определяется разной электроотрицательностью атомов углерода и связанного с ним галогена. Электронная плотность смещается к галогену, что приводит к формированию электрофильного центра на атоме углерода, который связан с галогеном, и С-Н кислотного центра у β-углеродного атома. Атака нуклеофильного реагента по электрофильному центру обуславливает течение реакции по механизму SN. В более жестких условиях идет процесс элиминирования [E] с выделением галогеноводорода, при атаке – основания в β-СН-кислотный центр.
8. Реакция нуклеофильного замещения (SN) происходит с галогенпроизводным в результате атаки в соответствующий реакционный центр молекулы субстрата: +1. нуклеофила; –2. электрофила; –3. кислоты; –4. основания; –5. свободного радикала. У галогенпроизводных связь углерод-галоген поляризована из-за разной электроотрицательности этих атомов и на углероде формируется электрофильный центр из-за электроноакцепторного влияния галогена. Электрофильный центр подвергается атаке нуклеофила, при этом протекает реакция SN. Это возможно в результате высокой полярности связи углерод – галоген, что приводит к ее гетеролитическому расщеплению.
9. Реакция отщепления (b-элиминирование, Е) происходит с галогенпроизводным в результате атаки в соответствующий реакционный центр молекулы: –1. нуклеофила; –2. электрофила; –3. кислоты; +4. основания; –5. свободного радикала. Галогенпроизводные алифатического ряда имеют sp3-гибридизированный атом галогена, у которого более высокая электроотрицательность в сравнении с атомом углерода, и он смещает электронную плотность по σ-связям на себя. При этом в β-положении молекулы увеличивается подвижность протона и формируется С-Н кислотный центр. Наличие слабого β-СН-кислотного центра в молекулах галогенопроизводных предопределяет возможность его атаки основанием и протеканию реакции элиминирования (Е).
10. Вероятность протекания реакций отщепления (b-элиминирование, Е) у насыщенных галогенпроизводных увеличивается в ряду галогенпроизводных (слева направо): –1. третичные, первичные, вторичные; +2. первичные, вторичные, третичные; –3. вторичные, третичные, первичные; –4. первичные, третичные, вторичные; –5. третичные, вторичные, первичные. У насыщенных алкилгалогенидов электроакцепторное влияние атома галогена приводит к формированию β-СН-кислотного центра, что обеспечивает протекание реакции β-элиминирования в щелочной среде. Наиболее вероятно β-элиминирование (Е) у третичных производных, поскольку промежуточно образуется наиболее устойчивый карбакатион с наиболее пространственно закрытым электрофильным центром (затруднен подход нуклеофила реакции SN).
11. Реакциям нуклеофильного замещения (SN) соответствуют схемы:
Реакциям нуклеофильного замещения (SN) соответствуют примеры 1 и 4, поскольку в результате этих реакций 1) кратность связей в молекуле субстрата не изменяется, 2) происходит замещение «уходящей группы» (анион галогена) на активную частицу реагента (ОН-, С2Н5О-), 3) реагент имеет природу нуклеофила. Символ SN обозначает: S (замещение) – характеристика субстрата, N (нуклеофил) – характеристика реагента.
12. Спирты образуются в определенных условиях в результате реакции галогеналканов и галогенциклоалканов с: –1. КОН, спирт. р-р, to; –2. KHS; –3. KCN; +4. KOH, водный р-р, t; –5. КСН3СОО. У галогеналканов и галогенциклоалканов на атоме углерода, связанном с галогеном формируется электрофильный центр, который атакуется нуклеофилом (ОН-) с образованием спирта по механизму SN. Условие водного раствора щелочи (пример 4) способствуют лучшей стабилизации (за счет гидратации) карбокатиона или переходного состояния реакции SN. В спиртовом растворе щелочи (пример 1) более устойчивым оказывается переходное состояние реакций элиминирования, которое приводят к непредельным продуктам.
13. Сульфиды (тиоэфиры) образуются в результате реакций галогенпроизводных углеводородов с: +1. Na2S; –2. AgNO2; –3. NH2CH3; +4. NaSC2H5; –5. NaSH. Галогенпроизводные углеводородов с нуклеофильными реагентами Na2S и NaSH в результате реакции SN образуют тиоэфиры (сульфиды). Реакции идут по электрофильному центру, который формируется на атоме углерода, связанном с галогеном, в молекуле субстрата (галогенпроизводное). Реагент предоставляет в реакцию нуклеофильную частицу (S2-, HS-).
14. Сложные эфиры могут быть получены в реакциях алкилгалогенидов с: –1. AgNO2 или NaNO2; –2. KCN; –3. KOC2H5; +4. RCOOK; –5. K2S. Сложные эфиры могут быть получены при взаимодействии алкилгалогенидов (электрофильный субстрат) с нуклеофильным реагентом RCOOK (нуклеофил RCOO-) в реакциях SN.
15. Бромид тетраметиламмония можно синтезировать с помощью реакции нуклеофильного замещения, используя в качестве исходных веществ непосредственно: +1. N(CH3)3; –2. CH3NHCH3; –3. +4. CH3Br; –5. CH3CH2NH2. Реакцией нуклеофильного замещения, используя в качестве субстрата алкилгалогенид метилбромид, а в качестве нуклеофильного реагента-триметиламин, можно синтезировать бромид тетраметиламмония. При этом галогенпроизводное является субстратом с электрофильным центром на атоме углерода, связанном с галогеном. Триметиламин - нуклеофильный реагент, который атакует электрофильный центр метилбромида. Пространственную доступность к этому центру обеспечивает структура галогеналкила.
16. Реакциям, которые протекают по механизму SN1, соответствует следующая информация: +1. протекают с гетеролитическим расщеплением связей; +2. протекают через промежуточное образование карбкатиона; –3. являются синхронными, протекают через переходное состояние; +4. нестереоспецифичны; –5. стереоспецифичны. Реакции, которые протекают по механизму SN1 у sp3-гибридного атома углерода, идут с гетеролитическим расщеплением связи С-Х и образованием карбкатиона как промежуточной частицы на одном из этапов взаимодействия субстрата с нуклеофилом. Атака плоского карбкатиона нуклеофильным реагентом одинаково вероятна с обеих сторон плоскости, поэтому реакция нестереоспецифичная.
17. Реакциям, которые протекают по механизму SN2, соответствует следующая информация: –1. промежуточными частицами являются ионы; –2. продуктом является рацемат; +3. конфигурация заместителей в хиральном центре продукта противоположна субстрату; +4. реакции стереоспецифичны; +5. промежуточные частицы не образуются. На основе исследований кинетики и стереохимии органических реакций предложено два предельных механизма нуклеофильного замещения у тетрагонального (sp3-гибридного) атома углерода – бимолекулярное замещение SN2 и мономолекулярное замещение SN1. Для реакций, которые протекают по механизму SN2 у sp3-гибридного атома углерода характерно то, что они идут через переходное состояние без образования промежуточных частиц. Конфигурация заместителей в хиральном центре продукта противоположна субстрату, образуется только один стереоизомер, поэтому реакция стереоспецифична.
18. Из 2-хлор-3-метилбутана в результате реакции элиминирования HCl образуется преимущественно: –1. 2-метилбутен-1; +2. 2-метилбутен-2; –3. 3-метилбутен-1; –4. 3-метилбутин-1; –5. 1,2-диметилциклопропан. Из 2-хлор-3-метилбутана в результате реакции элиминирования HCl образуется преимущественно 2-метилбутен-2. Прогнозировать направление реакции и ее продукты позволяет правило Зайцева, из которого следует: если рядом с атомом углерода, который связан с галогеном, находятся третичный, вторичный и первичный атомы, то преимущественно отщепляется атом водорода у третичного углерода (при этом образуется наиболее термодинамически устойчивый непредельный углеводород.
19. Символ SN2 обозначает реакции алкилгалогенидов: –1. нуклеофильного субстрата; +2. замещения; +3. с нуклеофильным реагентом; –4. мономолекулярные; +5. бимолекулярные. В молекулах алкилгалогенидов, распределение электронной плотности между разными по электроотрицательности атомами С и галогена приводит к формированию электрофильного реакционного центра на углероде. Этот атом атакуется нуклеофильным реагентом, и протекает реакция нуклеофильного замещения по бимолекулярному (SN2) или мономолекулярному (SN1) механизму. Механизм SN2 наиболее характерен для первичных алкилгалогенидов, хотя он встречается и у вторичных алкилгалогенидов.
20. Определению алкилгалогенидов R-Х щелочным гидролизом соответствуют схемы реакций:
Алкилгалогениды под действием щелочей гидролизуются с образованием спирта и соли галогенводородной кислоты. Эта реакция используется для идентификации алкилгалогенидов R-X определением галогенид-иона. При этом избыток щелочи обязательно должен быть нейтрализован кислотой, в качестве которой используется только азотная кислота, а затем проводится реакция с нитратом серебра на галогенид. Признаком протекания реакции является получение нерастворимой соли галогенида серебра. Поэтому определению алкилгалогенидов R-X щелочным гидролизом соответствуют схемы реакции 1, 4, 5. Дата добавления: 2015-11-26 | Просмотры: 3014 | Нарушение авторских прав |