 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
АЛКАЛОИДЫ. НУКЛЕОЗИДЫ. НУКЛЕОТИДЫ.
1. Пятичленные гетероциклические соединения названы в примерах: –1. азин; +2. диазол-1,3; –3. диазепин-1,2; –4. оксазин; +5. тиазол-1,3. При построении систематического названия моноциклических соединений, содержащих один или несколько гетероатомов в цикле комбинируют подходящий префикс (или префиксы), обозначающий природу гетероатома, с корнем, обозначающим размер цикла и суффиксом, обозначающим насыщенность цикла. Согласно правилам IUPAC пятичленные гетероциклы обозначаются в названии корнем «-ол». Диазол-1,3 является пятичленным гетероциклом с двумя гетероатомами азота. Тиазол-1,3 – пятичленный гетероцикл, содержащий гетероатомы серы и азота.
2. Шестичленные гетероциклические соединения названы в примерах: +1. азин; +2. оксазин-1,2; –3. оксазол-1,3; –4. оксиран; –5. 3Н-адепин. При построении систематического названия шестичленных гетероциклов размер цикла отражается в названии корнем «-ин». К шестичленным гетероциклам относятся азин, содержащий гетероатом азота и оксазин-1,2, содержащий гетероатомы кислорода и азота.
3. Семичленные гетероциклические соединения названы в примерах: –1. тиазин-1,4; +2. 1Н-азепин; +3. диазепин-1,4; –4. оксазол-1,3; –5. оксазин-1,4. В систематической номенклатуре семичленных гетероциклов корень названия отражает размер цикла и обозначается «епин». 1Н – азепин относится к семичленным гетероциклам с одним гетероатомом азота, диазепин-1,4 содержит два гетероатома азота.
4. Только азотсодержащие гетероциклические соединения названы в примерах: –1. оксол; –2. тиофен; +3. азин; +4. диазепин-1,3; +5. диазол-1,2. В систематической номенклатуре гетероциклов префикс указывает на природу гетероатома, в частности, «аз» обозначает присутствие атома азота в гетероцикле, множительная приставка «ди» указывает на присутствие в гетероцикле двух гетероатомов азота. Азин является шестичленным гетероциклом с одним гетероатомом азота, диазепин-1,3 – семичленным гетероциклом с двумя гетероатомами азота, диазол-1,2 – пятичленным гетероциклом с двумя гетероатомами азота.
5. В составе гетероцикла есть и азот, и кислород в примерах: –1. азол; +2. оксазол-1,3; –3. тиазол-1,3; +4. оксазин-1,4; –5. тиазин-1,4. Наличие гетероатома кислорода в систематической номенклатуре гетероциклов обозначается префиксом «окса-«, наличие гетероатома азота – префиксом «аза» (опуская «а», так, как корень «-ол» и «-ин» начинаются с гласной буквы). Оксазол является пятичленным гетероциклом, содержащим гетероатомы кислорода и азота, оксазин-1,4 - шестичленный гетероцикл с гетероатомами кислорода и азота.
6. В составе гетероцикла есть и сера, и азот: –1. диазол-1,3; +2. тиазол-1,3; –3. диазин-1,3; +4. фенотиазин; –5. феноксазин. Наличие гетероатома серы в систематической номенклатуре гетероциклов обозначается префиксом «тиа-«, тогда как присутствие гетероатома азота – префиксом «аза» (опуская «а», там где это необходимо). Тиазол-1,3 относится к пятичленным гетероциклам, содержащим гетероатомы серы и азота, фенотиазин – конденсированная гетероциклическая система гетероатома серы и азота.
7. Пирролу соответствует систематическое название: –1. диазол-1,3; –2. азин; –3. диазин-1,3; +4. азол; –5. тиазол. Пиррол относится к пятичленным ароматическим гетероциклам с одним гетероатомом азота. В систематической номенклатуре азотсодержащих пятичленных гетероциклов природа гетероатома отражается префиксом «аза», тогда как размер пятичленного гетероцикла отражается корнем «ол», в связи с чем пирролу соответствует систематическое название азол.
8. Пиримидину соответствует систематическое название: –1. диазол-1,3; +2. диазин-1,3; –3. диазепин-1,4; –4. азин; –5. азол. Пиримидин относится к шестичленным ароматическим гетероциклам с двумя гетероатомами азота. В систематической номенклатуре азотсодержащих шестичленных гетероциклов природа гетероатома отражается префиксом «аза», множительная приставка «ди» указывает на присутствие двух гетероатомов азота в положениях 1 и 3 гетероцикла. Размер шестичленного гетероцикла отражается корнем «ин» в систематической номенклатуре.
9. Имидазолу соответствует систематическое название: +1. диазол-1,3; –2. азин; –3. диазин-1,3; –4. азол; –5. тиазол. Имидазол является пятичленным ароматическим гетероциклом с двумя гетероатомами азота. В систематической номенклатуре имидазола направление номерации цикла производится от пиррольного гетероатома азота к пиридиновому. Природа гетероатомов азота обозначается префиксом «аза», множительная приставка «ди» указывает на присутствие двух гетероатомов азота в положения 1 и 3 гетероцикла. Размер пятичленного гетероцикла обозначается в названии корнем «-ол».
10. К алкалоидам группы пиридина следует отнести: –1. хинин; +2. никотин; –3. морфин; –4. кокаин; –5. анибазин. Алкалоиды – гетероциклические азотсодержащие основания растительного происхождения. Классификация алкалоидов осуществляется либо по растениям, в которых они встречаются, либо по типу гетероциклической системы, лежащей в основе их строения. В составе никотина содержится ароматическое кольцо пиридина, связанное с N-метилпирролидиновым кольцом, что позволяет отнести его к группе пиридина.
11. К алкалоидам группы хинолина следует отнести: +1. хинин; –2. кофеин; –3. папаверин; –4. кодеин; –5. атропин. Методами деструкции было установлено, что хинин содержит одно хинолиновое и одно хинуклидиновое кольцо, что позволило отнести хинин к алкалоидам группы хинолина.
12. К алкалоидам группы тропана следует отнести: +1. кокаин; –2. теофиллин; +3. атропин; –4. анабазин; –5. кодеин. В основе строения алкалоидов кокаина и атропина лежит структура тропана (8-метил-8-азабицикло [3,2,1] октана), что позволяет их отнести к группе алкалоидов, тропанового ряда. Атропин представляет собой сложный эфир, при гидролизе дающий спирт тропин и (R, S) – троповую кислоту. Кокаин гидролизуется разбавленными растворами кислот и щелочей, до экгонина (тропин-2-карбоновая кислота), бензойной кислоты и метанола.
13. N-H кислотный реакционный центр имеют молекулы: –1. фурана; +2. пиррола; +3. имидазола; –4. пиримидина; –5. хинолина. В составе ароматических гетероциклов N-H-кислотный реакционный центр характерен для гетероатомов азота пиррольного строения. Пиррол относится к пятичленным ароматическим гетероциклам с одним гетероатомом азота, который обеспечивает ароматичность гетероцикла, принимая пиррольное состояние. Пара электронов пиррольного гетероатома азота принимает участие в образовании циклической сопряженной системе, поэтому пиррол практически лишен основных свойств и проявляет слабые NH-кислотные свойства (рКа=16,5). В составе имидазола N-H-кислотные свойства также связаны с наличием пиррольного гетероатома азота (рКа=14,5), слабые основные свойства имидазола обеспечиваются наличием второго атома азота пиридинового строения (рКВН+ – 7,0).
14. Кислотные свойства гетероциклических соединений проявляются в их реакциях с: –1. галогенпроизводными углеводородов; +2. основаниями; –3. кислотами; –4. ацилгалогенидами. –5. спиртами. Кислотные свойства не являются абсолютными, они относительны. Кислотные свойства обнаруживаются лишь в присутствии оснований, и, наоборот, основные – в присутствии кислот.
15. Проявляют кислотные свойства и образуют соли в реакциях с сильными основаниями: +1. пиррол; –2. тиофен; –3. пиридин; +4. барбитуровая кислота; –5. оксазол. Кислотные свойства пиррола обусловлены наличием N-H-кислотного центра гетероатома азота пиррольного строения. Кислотные свойства барбитуровой кислоты связаны с присутствием О-Н-кислотного центра в составе ее лактимной таутомерной формы. Оба соединения реагируют с сильными основаниями с образованием анионных солей.
16. Кислотные свойства имидазола (1,3-диазол) выражены больше, чем у: –1. барбитуровая кислота; –2. 2,4-дигидроксипиримидин; –3. серная кислота; +4. пиррол; –5. мочевая кислота. Кислотные свойства имидазола и пиррола обусловлены наличием NH-кислотного центра при гетероатоме азота пиррольного строения. NH-кислотные свойства имидазола (рКа=14,5) более выражены по сравнению с NH-кислотными свойствами пиррола (рКа=16,5), что можно объяснить большей полярностью ионизируемой N-H-связи в составе имидазола из-за электроноакцепторного влияния второго пиридинового гетероатома азота. Другие же приведенные здесь кислоты являются более сильными кислотами, т.к. они относятся либо к неорганическим (серная кислота), либо к ОН-кислотам (барбитуровая и мочевая кислоты).
17. Барбитуровая кислота (2,4,6-тригидроксипиримидин) в реакции с гидроксидом натрия при комнатной температуре образует: –1. продукты расщепления цикла; –2. соль малоновой кислоты, аммиак и карбонат натрия; –3. аммиак и карбонат натрия; +4. натриевую соль барбитуровой кислоты; –5. отсутствует реакция в этих условиях. При комнатной температуре барбитуровая кислота вступает в реакцию солеобразования с основаниями по ОН-кислотному центру в составе ее лактимной таутомерной формы. В реакции с гидроксидом натрия при комнатной температуре барбитуровая кислота образует мононатриевую соль.
18. В реакциях образования солей барбитуровая кислота (2,4,6-тригидроксипиримидин) ведет себя как: –1. однокислотное основание; +2. одноосновная кислота; –3. двухосновная кислота; –4. трехосновная кислота; –5. солей не образует. Барбитуровая кислота (рКа=4) несколько сильнее уксусной кислоты, ведет себя как одноосновная кислота и образует с основанием монозамещенные соли. Наиболее выражены, вероятно, кислотные свойства ОН-кислотного центра при С2 в лактимной таутомерной форме, что объясняется наличием двух электроноакцепторных гетероатомов азота пиридинового строения в положениях 1 и 3 гетероцикла, которые увеличивают полярность ионизируемой ОН+δ –связи.
19. В реакциях образования солей с основаниями мочевая кислота (2,6,8-тригидроксипурин) ведет себя как: –1. одноосновная кислота; +2. двухосновная кислота; –3. трехосновная кислота; –4. невозможно образование солей с основаниями; –5. субстрат реакций SN. Мочевая кислота ведет себя как слабая двухосновная кислота (рКа1 = 5,75; рКа2 = 10,3), так как существует в форме 2,8-дигидрокси-7Н, 9Н-пуринона-6. Такая форма обусловлена возможностью образования внутримолекулярной водородной связи между NHδ+ кислотным центром при N7 имидазольного цикла и n-основным центром пиридинового атома кислорода оксогруппы при С6 пиримидинового цикла.
20. В реакциях с основаниями при обычных условиях мочевая кислота (2,6,8-тригидроксипурин) образует соли: –1. соли аммония; –2. барбитураты; –3. соли азотистых оснований; +4. кислые и средние ураты; –5. соли пирилия. Будучи двухосновной кислотой, мочевая кислота образует два ряда солей: кислые - с одним молем эквивалентов щелочи; средние – с двумя молями эквивалентов щелочи, соли мочевой кислоты называются уратами.
21. Основные свойства гетероциклических соединений проявляются в их реакциях: –1. с основаниями; +2. с кислотами; –3. с гидрокарбонатами; –4. с галогенопроизводными углеводородов; –5. ацилгалогенидами. Основные свойства гетероциклических соединений связаны, как правило, с наличием гетероатомов пиридинового строения в качестве основных центров. Основные свойства гетероциклов проявляются в реакциях с кислотами.
22. Не образуют солей с кислотами: –1. хинолин; +2. фуран; +3. пиррол; –4. имидазол; –5. пиридин. В качестве гетероатома в составе пиррола содержится пиррольный атом азота, в составе фурана – пиррольный гетероатом кислорода, пара электронов которых находится на pz орбитали и, участвуя в формировании циклической сопряженной системы, обеспечивает ароматичность гетероциклов. Поэтому пиррол и фуран практически лишены основных свойств и не образуют солей с кислотами. По этой же причине пиррол и фуран ацидофобны – «боятся» кислот. В присутствии сильных минеральных кислот они теряют свою ароматичность и разрушаются (полимеризуются, осмоляются).
23. Являются основаниями и образуют соли в реакциях с кислотами: –1. нафталин; –2. фуран; +3. хинолин; +4. хинин; +5. алкалоиды. Проявляют основные свойства и образуют соли в реакциях с кислотами хинолин, а также хинин и другие алкалоиды. Основные свойства хинолина обеспечиваются наличием Nsp2 пиридинового строения, хинин содержит 2 основных центра – Nsp3 в составе хинуклидинового кольца и Nsp2-пиридиновый в составе хинолинового кольца. Другие алкалоиды проявляют основные свойства за счет основных центров, представленных Nsp3 либо Nsp2 пиридинового строения.
24. Основные свойства максимально выражены в ряду предложенных соединений у: –1. пиррол; +2. имидазол (диазол-1,3); –3. пиридин; –4. пиримидин (диазин-1,3); –5. оксазол-1,3. Максимально выражены основные свойства среди предложенных у имидазола. В составе имидазола основные свойства пиридинового гетероатома азота усилены за счет присутствия электронодонорного Nsp2 пиррольного строения. В молекуле оксазола-1,3 основным центром является пиридиновый гетероатом азота, на который пиррольный атом кислорода оказывает более слабое (чем пиррольный азот) электронодонорное влияние. Пиридин и пиримидин в качестве основного центра содержат Nsp2-пиридиновый, но у пиримидина в ароматическом цикле присутствует второй гетероатом Nsp2-пиридиновый, который является акцептором и снижает активность основного центра. Пиррол содержит в цикле Nsp2-пиррольный, у которого пара электронов вступает в сопряжение и является частью ароматической π-электронной системы соединения, вследствие чего пиррол не образует солей с кислотами.
25. Ацидофобными называют ароматические гетероциклические соединения, которые при действии на них: –1. сильных кислот образуют устойчивые соли; –2. не взаимодействуют ни кислотами, ни с основаниями; –3. сильных оснований образуют соли; +4. сильных кислот «осмоляются», т.к. происходит нарушение их ароматического строения; –5. ацилгалогенидов подвергаются реакциям SE. Ацидофобность (боязнь кислоты) – это нарушение ароматичности гетероциклов в присутствии сильных минеральных кислот, обусловленное присоединением протона. Пятичленные гетероциклические соединения с одним гетероатомом, имеющие низкую ароматичность разрушаются, полимеризуются (осмоляются) под действием минеральных кислот и являются ацидофобными.
26. Ацидофобными гетероциклическими соединениями являются: –1. тиофен; +2. пиррол; +3. фуран; –4. тетрагидрофуран; –5. имидазол (диазол-1,3). Ацидофобность (боязнь кислоты) проявляют пятичленные гетероциклические соединения, с одним гетероатомом, которые имеют низкую ароматичность из-за высокой электроотрицательности гетероатома (пиррол, фуран). Их циклы менее устойчивы и разрушаются (осмоляются) под действием сильных минеральных кислот. Тиофен не является ацидофобным из-за низкой основности атома серы, имидазол содержит Nsp2-пиридиновый, который является основным центром, образует соли с кислотами без потери ароматичности гетероцикла.
27. Таутомерия возможна для гетероциклических соединений, в молекулах которых присутствуют одновременно реакционные центры: –1. два кислотных; +2. кислотный и основный; –3. два основных; –4. основный и электрофильный; –5. электрофильный и нуклеофильный. Таутомерия – это явление существования в равновесной смеси двух изомеров, спонтанно превращающихся друг в друга. Для гетероциклических соединений таутомерные превращения связаны с присутствием в одном и том же цикле кислотного и основного центров. В результате внутримолекулярного переноса протона от кислотного к основному центру наблюдается явление таутомерии.
28. Таутомерные превращения возможны для следующих гетероциклических соединений: –1. фуран; –2. пиридин; –3. пиррол; +4. имидазол (диазол-1,3); +5. барбитуровая кислота. Таутомерные превращения связаны с одновременным присутствием кислотного и основного центров в составе одного и того же гетероциклического соединения. В цикле имидазола наблюдается явление прототропной таутомерии, связанное с обратимым переносом протона от NH-кислотного центра к основному (пиридиновому гетероатому азота). Для барбитуровой кислоты характерны явления лактим-лактамной и кето-енольной таутомерии, обусловленные обратимым переходом протона от ОН-кислотного центра лактимной и енольной формы к основному центру.
29. Лактим-лактамная таутомерия характерна для гетероциклических соединений: –1. изохинолин; +2. цитозин; +3. тимин; +4. мочевая кислота (2,6,8-тригидроксипурин); –5. имидазол (диазол-1,3). Лактим-лактамная таутомерия характерна для гидроксипроизводных шестичленных ароматических гетероциклов с гетероатомами азота. В растворе существует смесь таутомерных форм, возникающих в результате внутримолекулярного обратимого переноса протона от ОН-кислотного центра к основному центру представленному пиридиновым гетероатомом азота. Цитозин (4-амино-2-гидроксипиримидин), тимин (2,4-дигидрокси-5-метилпиримидин) и мочевая кислота (2,6,8-тригидроксипурин) содержат в лактимной форме ОН-кислотные центры и способны к лактим-лактамной таутомерии.
30. Ароматическое строение молекулы пиррола обеспечено тем, что: +1. σ-скелет имеет плоское циклическое строение; +2. сопряженная π-система замкнута; +3. неподеленная электронная пара атома азота участвует в образовании сопряженной системы; +4. число π-электронов равно 6 = 4n + 2; –5. число π-электронов равно 4 = 4n + 2. Ароматичность – это совокупность признаков, определяющих термодинамическую устойчивость ненасыщенных органических соединений: 1) все атомы цикла находятся в состоянии sp2-гибридизации; 2) σ-скелет молекулы плоский, замкнутый; 3) pz орбитали расположены перпендикулярно плоскости σ-скелета и образуют циклическую сопряженную систему; 4) в результате циклического сопряжения выделяется энергия сопряжения; 5) количество электронов, вступающих в сопряжение подчиняется правилу Хюккеля N = 4n + 2. Пиррол соответствует всем критериям ароматичности. Число сопряженных р-электронов в цикле пиррола равно 6, вследствие того, что пиррольный гетероатом азота вносит в сопряжение рz-орбиталь с парой электронов.
31. Для ароматического строения молекулы пиридина характерно то, что: +1. σ-скелет имеет плоское циклическое строение; –2. неподеленная электронная пара атома азота участвует в образовании циклической сопряженной π-электронной системы; +3. число π-электронов равно 6 = 4n + 2; +4. неподеленная электронная пара атома азота не участвует в сопряжении и расположена на гибридной орбитали в плоскости цикла; –5. число π-электронов равно 8 = 4n + 2. Пиридин изоэлектронен бензолу, и соответствует всем критериям ароматичности, т.к. в составе гетероцикла содержится пиридиновый гетероатом азота, неподеленная пара электронов которого расположена на гибридной орбитали в плоскости цикла и не участвует в сопряженной системе. Поэтому число р-электронов соответствует правилу Хюккеля и равно 6.
32. Для ароматического строения молекулы хинолина (бензо-[b]-пиридин) характерно то, что: +1. σ-скелет имеет плоское циклическое строение; +2. неподеленная электронная пара атома азота не участвует в образовании циклической сопряженной π-электронной системы; –3. число π-электронов равно 12 = 4n + 2; –4. неподеленная электронная пара атома азота участвует в сопряжении и образовании циклической сопряженной системы; +5. число π-электронов равно 10= 4n + 2. Хинолин изоэлектронен нафталину. Он соответствует всем критериям ароматичности, т.к. неподеленная пара электронов пиридинового атома азота не участвует в сопряжении и располагается на гибридной орбитали в плоскости цикла. Число сопряженных р-электронов соответствует правилу Хюккеля и равно 10.
33. Для ароматического строения пурина характерно то, что: +1. σ-скелет имеет плоское циклическое строение; +2. неподеленная электронная пара только одного из четырех атомов азота участвует в сопряжении и образовании циклической сопряженной π-электронной системы; +3. число π-электронов равно 10 = 4n + 2; –4. число π-электронов равно 8 = 4n + 2; –5. число π-электронов равно 16 = 4n + 2. Пурин является конденсированной системой из двух гетероциклов – пиримидина и имидазола. В составе пурина находятся три пиридиновых гетероатома азота, которые вносят в сопряжение на рz орбитали по одному электрону как атомы углерода и один пиррольный гетероатом азота, который вносит в циклическую сопряженную систему два электрона на рz орбитали. Пурин соответствует всем критериям ароматичности, число сопряженных р-электронов равно 10, что соответствует правилу Хюккеля.
34. a-Пиран (2Н-пиран, 1,2-оксин) является гетероциклическим соединением: –1. азотсодержащим; +2. кислородсодержащим; –3. ароматическим; +4. содержащим открытую цепь сопряжения; +5. ненасыщенным. a-Пиран (2Н-пиран) относится к шестичленным кислородсодержащим гетероциклам с максимальной ненасыщенностью. a-Пиран не является ароматическим соединением, т.к. не соответствует критериям ароматичности: в его составе присутствует sp3-гибридный атом углерода во втором положении цикла и поэтому отсутствует циклическая сопряженная система р-орбиталей. В составе a-пирана присутствует открытая цепь сопряжения включающая пиррольный гетероатом кислорода и две π-связи.
35. π-Избыточную электронную систему имеют гетероциклические соединения: –1. насыщенные пятичленные с одним гетероатомом в цикле; +2. ароматические пятичленные с одним гетероатомом в цикле; –3. насыщенные шестичленные с одним гетероатомом в цикле; –4. ароматические шестичленные с одним гетероатомом в цикле; –5. ароматические шестичленные с двумя гетероатомами в цикле. По количеству сопряженных р-электронов в циклической π-системе ароматические пятичленные гетероциклы с одним гетероатомом изоэлектронны бензолу, число π-электронов у них равно 6. Однако, ароматические пятичленные гетероциклы с одним гетероатомом π-избыточны по отношению к бензолу, у которого 6 π-электронов приходится на 6 атомов цикла, тогда как у пятичленных гетероциклов с одним гетероатомом 6 электронов приходится на 5 атомов цикла.
36. π-Избыточную электронную систему имеют гетероциклические соединения: +1. пиррол; –2. пиридин; +3. тиофен; +4. фуран; –5. пиримидин. Пятичленные ароматические гетероциклы (пиррол, тиофен, фуран) содержат в своем составе пиррольные гетероатомы азота, серы и кислорода, в связи с чем в циклической π-электронной системе у них сопряжены 6 электронов. По количеству р-электронов данные циклы изоэлектроны бензолу, однако 6 р-электронов у бензола приходится на 6 атомов цикла, а у пиррола, тиофена и фурана – на 5 атомов цикла, в связи с чем они являются π-избыточными.
37. π-Недостаточность электронной системы выражена максимально у: –1. пиридина; –2. пиррола; –3. тиофена; +4. пиримидина (диазин-1,3); –5. имидазола (диазол-1,3). π-Недостаточность сопряженной π-электронной системы у шестичленных гетероциклов, изоэлектронных бензолу, связана с присутствием гетероатомов пиридинового строения. Данные гетероатомы являются сильными электроноакцепторами и, смещая электронную плотность в π-электронной системе, вызывают уменьшение ее на атомах углерода в цикле. В связи с этим электронная плотность на атомах углерода в цикле меньше, чем у бензола. Наиболее π-недостаточным из всех перечисленных гетероциклов является пиримидин, у которого в цикле содержится два электроноакцепторных пиридиновых гетероатома азота. 38. Реакции электрофильного замещения (SE) протекают с максимальной скоростью и в наиболее мягких условиях у соединений: –1. бензол и его гомологи; +2. π-избыточные ароматические гетероциклы; –3. алканы и циклоалканы; –4. π-недостаточные ароматические гетероциклы; –5. алкены и циклоалкены. π-Избыточность ароматических гетероциклов приводит к увеличению электронной плотности в цикле, что обеспечивает высокую скорость реакций электрофильного замещения в ароматическом ядре. Реакции электрофильного замещения у π-избыточных гетероциклов протекают в мягких условиях и с большей скоростью по сравнению с бензолом и его гомологами.
39. Реакции электрофильного замещения (SE) протекают с минимальной скоростью у: –1. толуола (метилбензол); +2. пиримидина (диазин-1,3); –3. пиридина; –4. фурана; –5. пиразола (диазол-1,2). Реакции электрофильного замещения затруднены у π-недостаточных систем, каковыми являются шестичленные гетероциклы с пиридиновыми гетероатомами в цикле (пиридин, пиримидин). Гетероциклы с двумя гетероатомами (пиримидин) практически не участвуют в реакциях SE, такая возможность возникает только при введении в кольцо сильных электронодоноров.
40. Скорость реакций электрофильного замещения (SE) уменьшается в ряду соединений слева направо: –1. пиридин, пиррол, бензол; –2. бензол, пиррол, пиридин; –3. бензол, пиридин, пиррол; –4. пиридин, бензол, пиррол; +5. пиррол, бензол, пиридин. Скорость реакций электрофильного замещения снижается с уменьшением π-электронной плотности в ароматическом ядре. Большая скорость реакций SE у π-избыточных гетероциклов (пиррол), меньшая – у π-недостаточных гетероциклов (пиридин). Бензол занимает промежуточное положение.
41. Реакции сульфирования пиррола соответствует информация: –1. протекает в жестких условиях, при нагревании в присутствии Н2SO4 конц. или олеума; +2. в смеси продуктов преобладает пирролсульфокислота-2; +3. протекает в мягких условиях при комнатной температуре, в присутствии пиридинсульфотриоксида; +4. протекает по механизму SE; –5. характерен SN механизм. Сульфирование пиррола как и других ароматических соединений протекает по механизму SE. Характеризуется рядом особенностей, которые обусловлены π-избыточностью и ацидофобностью пиррола, а также его пониженной ароматичностью по сравнению с бензолом. π-Избыточность пиррола обеспечивает высокую скорость реакций SE, поэтому они протекают в мягких условиях, при комнатной температуре. Ацидофобность пиррола налагает ограничения на условия проведения SE реакций. В реакции сульфирования невозможно применять H2SO4 (конц.), т.к. это вызывает разрушение пиррольного цикла, потерю ароматических свойств, полимеризацию и осмоление. В связи с этим сульфирование осуществляется особыми сульфирующими агентами, такими как пиридинсульфотриоксид. Реакция SE протекает через образование π-комплекса, который превращается в σ-комплекс и далее в продукт. Более устойчив σ-комплекс, образующийся при атаке электрофила в a-положение, поэтому он формируется с большей скоростью и в смеси продуктов преобладает пирролсульфокислота-2.
42. Продуктами бромирования фурана в присутствии оснований являются: +1. 2-бромфуран; +2. 2,5-дибромфуран; +3. 2,3,4,5-тетрабромфуран; +4. 2,5-дигидро-2,5-дибромфуран; –5. реакция бромирования невозможна. Особенности реакции бромирования фурана по механизму SE обусловлены его π-избыточностью и низкой ароматичностью. Реакция SE протекает с большей скоростью в a-положении, поэтому в смеси продуктов преобладают 2-бромфуран и 2,5-дибромфуран. Но, поскольку, фуран π-избыточен, то при избытке реагента реакция бромирования (SE) может протекать и по β-положению с образованием 2,3,4,5-тетрабромфурана. Низкая ароматичность фурана является причиной протекания AE реакций. В этих реакциях фуран ведет себя как сопряженный диеновый углеводород, у которого бромирование осуществляется по концам сопряженной цепи с образованием 2,5-дигидро-2,5-дибромфурана.
43. Реакция алкилирования пиррола протекает с образованием продуктов: –1. N-алкилпиррола; +2. 2-алкилпиррола; +3. 2,5-диалкилпиррола; –4. N,N-диалкилпиррола; –5. реакция невозможна. Реакция алкилирования пиррола протекает по механизму SE в ароматическом кольце, преимущественно в a-положении, с образованием 2-алкилпиррола или 2,5-диалкилпиррола.
44. Реакции ацилирования имидазола соотвествует информация: +1. протекает по механизму SN; –2. протекает по механизму SE; +3. образуется продукт реакции N-ацилимидазол; –4. образуется продукт реакции N,N-диацилимидазол; –5. реакция невозможна. Имидазол (1,3-диазол) содержит в гетероцикле 2 гетероатома азота, один из которых имеет пиридиновое строение, Пиридиновый гетероатом азота является электроноакцептором, в связи с чем на нем концентрируется избыток электронной плотности (больше чем на атомах углерода гетероцикла). Кроме того, пиридиновый гетероатом азота содержит на валентном уровне свободную пару электронов расположенную на sp2-гибридной орбитали. В связи с этим атом азота пиридинового типа проявляет нуклеофильные свойства более сильные, чем атомы углерода в составе имидазола и выступает в реакции ацилирования в качестве нуклеофильного реагента. Ацилгалогениды в этой реакции являются электрофильными субстратами, реакция протекает по механизму SN.
45. По механизму SE протекают реакции пиридина со следующими реагентами: –1. CH3I; +2. KNO3, H2SO4 (конц.), to; +3. H2SO4 (SO3), to; –4. (CH3CO)2O; +5. Br2 (кат.). Пиридин является неацидофобным ароматическим гетероциклом, поэтому для реакций SE не требуется особых реагентов, сульфирование и нитрование протекают в присутствии концентрированных H2SO4 и HNO3 (либо KNO3 + H2SO4 (конц.)). π-Недостаточность ароматического гетероцикла пиридина обусловливает жесткие условия протекания SE – нагревание, либо наличие катализатора (Br2)кат.)). Реакции алкилирования (с CH3I) и ацилирования (c (CH3CO)2O) протекают не по атомам углерода ароматического кольца, а по атому азота, на котором повышена электронная плотность. Поэтому последние реакции протекают по SN механизму.
46. По механизму SN протекают реакции пиридина со следующими реагентами: +1. KOH, to, сплавл.; +2. KNH2 (NH3 жидк.); –3. H2SO4, to; –4. KNO3, H2SO4, to; –5. HCl. У π-недостаточной системы пиридина возникает способность к реакциям SN в ароматическом кольце, которая связана с электроноакцепторным влиянием атома азота пиридинового типа. Благодаря этому влиянию, электронная плотность особенно понижена в положениях 2, 4 и 6 пиридинового кольца, здесь возникают электрофильные центры, на которые направлена атака нуклеофильных реагентов (ОН-, NH2- и др.). Поэтому реакции SN протекают в пиридиновое кольцо в положения 2, 4 или 6 (с КОН, при нагревании в безводной среде, с KNH2 в растворе NH3).
47. Реакция хинолина с КОН при нагревании в безводной среде (SN) протекает: +1. в a-положение пиридинового кольца; –2. в β-положение пиридинового кольца; +3. в γ-положение пиридинового кольца; –4. в бензольное кольцо по 5 и 8 атома углерода; –5. в бензольное кольцо по 6 и 7 атомам углерода. Реакции хинолина с нуклеофильными реагентами протекают по электронодефицитному пиридиновому кольцу в a- и γ-положения, где понижена электронная плотность. За счет электроноакцепторного влияния Nsp2-пиридинового атома в a- и γ-положениях возникают электрофильные центры по которым протекают SN реакции.
48. Реакция сульфирования хинолина (SE) H2SO4 (конц.) при to <200о протекает предпочтительно: –1. в бензольное кольцо по 6 и 7 атомам углерода; –2. в бензольное кольцо по 5 атому углерода; +3. в бензольное кольцо по 8 атому углерода; –4. в a- и γ-положение пиридинового кольца; –5. в β-положение пиридинового кольца. Реакции SЕ у хинолина протекают в бензольном кольце, в котором электронная плотность повышена по сравнению с пиридиновым кольцом. Ориентация электрофила предпочтительна в 5 и 8 положения бензольного кольца. В реакции сульфирования при to <200о объемная сульфогруппа ориентируется предпочтительно в 8 положение, т.к. в 5 положении ориентация затруднена из-за пространственной помехи, связанной с присутствием атома водорода в 4 положении пиридинового кольца. В 8 положении пространственные затруднения отсутствуют.
49. Никотиновая кислота (пиридин-3-карбоновая кислота) может быть получена при: –1. восстановлении пиридина; –2. окислении 4-метилпиридина; –3. ацилировании пиридина; +4. окислении 3-метилпиридина; +5. окислении 3-этилпиридина. Никотиновая кислота получается при окислении 3-метилпиридина и 3-этилпиридина KMnO4 в присутствии концентрированной серной кислоты при нагревании. Ароматический гетероцикл пиридина устойчив к окислению (подобно бензолу). В указанных условиях окислению подвергаются гомологи пиридина по a-углеродному атому с образованием пиридинкарбоновых кислот.
50. Возможность протекания реакций нуклеофильного замещения (SN) максимальна в ряду ароматических соединений, для которых характерно: –1. электронное строение бензола; +2. π-недостаточное электронное строение; –3. электронное строение фурана; –4. π-избыточное электронной строение; –5. электронное строение пиразола (диазол-1,2). Способность к реакциям SN возникает в ароматическом цикле π-недостаточных гетероциклов и связана с электроноакцепторным влиянием гетероатомов пиридинового строения. В отличие от бензола, электронная плотность в различных положениях, например, пиридинового ядра неодинакова. Максимальна электронная плотность на атоме азота, а в положениях 2,4 и 6 - минимальна, что обеспечивает протекание реакции SN в этих положениях в кольце пиридина.
51. Возможность протекания реакций нуклеофильного замещения (SN) уменьшается в ряду соединений слева направо: –1. пиридин, пиримидин, пиридазин; –2. пиррол, оксазол, бензол; –3. пиридин, бензол, пиримидин; –4. бензол, пиридин, пиридазин; +5. пиридазин, пиридин, бензол. Максимальная скорость реакций SN у пиридазина, т.к. он является более π-недостаточной системой, чем пиридин из-за присутствия в цикле двух электроноакцепторных гетероатомов азота пиридинового строения. Пиридин проявляет способность к реакциям SN, т.к. содержит в цикле один электроноакцепторной атом азота пиридинового строения. Наименее склонен к таким реакциям бензол.
52. Мурексидная реакция характерна для: –1. барбитуровой кислоты; +2. теофиллина; –3. хинина; –4. атропина; +5. мочевой кислоты. Мурексидная проба является качественной реакцией на все гидроксипроизводные пурина. Среди предложенных соединений таковыми являются теофиллин (1,3-диметилксантин) и мочевая кислота (2,6,8-тригидрокси-7Н-пурин). Если нагреть эти соединения с азотной кислотой, а после охлаждения обработать аммиаком, то раствор окрашивается в фиолетовый цвет за счет образования соли пурпурной кислоты – мурексида.
53. Талейохинная реакция характерна для: –1. теобромина; –2. пиррола; 3. пиридина; +4. хинина; –5. кофеина. Талейохинная реакция применяется для обнаружения хинина. При прибавлении к раствору хинина или его солей концентрированной бромной воды, а затем раствора аммиака появляется интенсивное зеленое окрашивание. Продукт взаимодействия хинина с бромной водой называется талейохином. В связи с этим реакция носит название «талейохинная проба».
54. Цианидиновая реакция характерна для: –1. хинина; +2. кверцетина; –3. мочевой кислоты; –4. пуриновых алкалоидов; –5. пиримидина. Цианидиновая проба применяется для обнаружения флавоноидов, в данном случае кверцетина. При восстановлении кверцетина атомарным водородом в момент его выделения (Mg + HCl) и последующей дегидратации образуется цианидинхлорид, окрашивающий раствор в розовый цвет в кислой среде.
55. Общие алкалоидные реакции характерны для: –1. пиррола; –2. барбитуровой кислоты; +3. атропина; +4. папаверина; +5. никотина. Существует ряд реакций, носящих название общеалкалоидных, при помощи которых можно осадить алкалоиды в виде нерастворимых простых или двойных солей. Простые соли образуются в реакции алкалоидов с танином и пикриновой кислотой, двойные соли – в растворе йода в йодиде калия. В каждом случае реакция сопровождается образованием осадка с характерной окраской – белой, желтой, шоколадно-коричневой, соответственно.
ЛИПИДЫ. 1.Липиды являются: –1. низкомолекулярными хорошо растворимыми в воде веществами; –2. высокомолекулярными (полимерными) водорастворимыми веществами; –3. биополимерами, малорастворимыми в воде; +4. низкомолекулярными водонерастворимыми веществами; –5. газообразными в обычных условиях веществами. Липиды это низкомолекулярные вещества, их молекулы не являются продуктами реакций полимеризации или поликонденсации. В то же время молекулы липидов содержат в своем составе достаточно объемные неполярные (или малополярные) фрагменты. Поэтому липиды растворяются в органических растворителях, а в таком полярном растворителе как вода они, практически, не растворяются.
2. Липиды классифицируют по способности их молекул к гидролитическому расщеплению на: –1. a-аминокислоты, пептиды и белки; +2. омыляемые и неомыляемые; –3. моно-, олиго- и полисахариды; –4. нуклеозиды и нуклеотиды; –5. рибо- и дезоксирибонуклеиновые кислоты. Омылением называется щелочной гидролиз сложных эфиров высших карбоновых кислот. Все липиды по химическому строению их молекул можно поделить на две большие группы: сложные эфиры (жиры, воски, фосфолипиды) – их молекулы в результате гидролиза расщепляются на спирты и кислоты, это омыляемые липиды; изопреноиды (терпены, терпеноиды, стероиды) – их молекулы не гидролизуются, говорят, что они структурно однородны, это неомыляемые липиды.
3. Омыляемые липиды по химической природе являются: –1. изопреноидами; –2. производными стерана (гонана); +3. сложными эфирами; –4. полиамидами; –5. многоатомными спиртами и полуацеталями. Омыляемыми называют липиды, молекулы которых способны подвергаться гидролитическому расщеплению на структурные фрагменты, каждый из которых в отдельности не может быть отнесен к классу липидов. Установлено, что все омыляемые липиды в результате гидролиза (щелочного или кислотного) образуют смесь спирта и кислоты (или ее солей): воски расщепляются на высшие одноатомный спирт и карбоновую кислоту; жиры – на трехатомный спирт глицерин и, обычно, высшие карбоновые кислоты; глицерофосфолипиды – на глицерин, высшие карбоновые кислоты и фосфорную кислоту. Поэтому все омыляемые липиды (воски, жиры, фосфолипиды) следует отнести по их главной химической природе к сложным эфирам.
4. Неомыляемые липиды по химическому строению молекулы являются: –1. сложными эфирами; –2. полиэфирами; –3. полиамидами; +4. изопреноидами; –5. многоатомными спиртами и ацеталями. К неомыляемым липидам, т.е. неспособным к расщеплению молекул на фрагменты с помощью гидролиза, относятся терпены и терпеноиды, стероиды. Все эти соединения в отличие от омыляемых липидов сложными эфирами не являются, они могут иметь в составе молекулы сложно-эфирную группу только в качестве заместителя. Терпены, терпеноиды и стероиды это природные соединения, их молекулы образуются в результате многостадийных биохимических реакций. Но по составу и строению молекул они могут быть представлены как результат сочленения определенного числа изопреновых звеньев (углеродный скелет молекулы изопрена, т.е. 2-метилбутадиена-1,3
5. К омыляемым липидам относятся: –1. стероиды; +2. воски; –3. терпеноиды; +4. фосфолипиды; +5. жиры. Все омыляемые липиды являются сложными эфирами. Причем сложно-эфирная функциональная группа связывает главные структурные части молекулы липида: остатки спирта и кислоты. Воски, как сложные эфиры, образованы высшими одноатомным спиртом и карбоновой кислотой. Жиры трехатомным спиртом глицерином и высшими (но, часто, и масляной) карбоновыми кислотами. Фосфолипиды – эфиры L-фосфатидовых кислот и гетерофункциональных спиртов.
6. К неомыляемым липидам относятся: +1.терпены и терпеноиды; –2. твердые жиры и масла; –3. жиры и воски; +4. стероиды; –5. фосфо- и гликолипиды. Терпены, терпеноиды и стероиды относят к неомыляемым липидам. По химическому строению это изопреноиды. Их молекулы неспособны к гидролизу (омылению) с расщеплением молекулы на компоненты нелипидной природы.
7. Омыляемые липиды классифицируют на: –1. способные к гидролитическому расщеплению и структурно однородные соединения, молекулы которых не подвергаются гидролизу; –2. мономеры и полимерные соединения; –3. терпены (терпеноиды) и стероиды; +4. простые и сложные; –5. сложные эфиры и изопреноиды. Омыляемые липиды классифицируют на простые и сложные. Все омыляемые липиды подвергаются гидролизу, но в результате гидролитического расщепления молекулы простых и сложных липидов дают разное число компонентов. Молекулы простых омыляемых липидов в результате гидролиза расщепляются на два вида компонентов: спирт (высший одноатомный или трехатомный спирт глицерин) и, обычно, высшие карбоновые кислоты. Молекулы сложных омыляемых липидов расщепляются на большее число видов компонентов, например, глицерин, карбоновые кислоты, фосфорную кислоту и гетерофункциональный спирт (см. фосфолипиды).
8. Неомыляемые липиды классифицируют на: –1. простые и сложные липиды; –2. жиры, воски, фосфолипиды и др.; –3. белки и пептиды; –4. РНК и ДНК; +5. терпены (терпеноиды) и стероиды. Неомыляемые липиды классифицируют на терпены (терпеноиды) и стероиды. Терпены и стероиды имеют одинаковый принцип химического строения, они изопреноиды. Доказана общность их биохимического синтеза. Тем не менее это две разные группы соединений, разные как по происхождению (терпены преимущественно содержатся в растениях, стероиды чаще встречаются в организмах животных), так и по их физиологическому действию, биологической роли.
9. К простым омыляемым липидам относят: –1. терпены и терпеноиды; –2. стероиды; +3. воски; +4. жиры (твердые жиры и масла); –5. фосфолипиды. К простым омыляемым липидам относят воски и жиры (твердые жиры и масла). Все простые омыляемые липиды в результате гидролиза образуют два вида продуктов – спирт и кислоту. Например, молекулы восков расщепляются на высший одноатомный спирт и высшую карбоновую кислоту. Молекула жира – на трехатомный спирт глицерин и высшие карбоновые кислоты (довольно часто при гидролизе природных жиров образуется и масляная кислота).
10. К сложным омыляемым липидам относят: –1. терпены и терпеноиды; –2. стероиды; –3. воски; –4. жиры (твердые жиры и масла); +5. фосфолипиды. К сложным омыляемым липидам относят фосфолипиды. Сложные омыляемые липиды в результате гидролиза образуют не два, а больше видов продуктов. Например, глицерофосфолипиды (сложные эфиры L-фосфатидовых кислот) при полном гидролизе расщепляются на гетерофункциональный спирт, фосфорную кислоту, смесь карбоновых кислот и глицерин.
11. Большинство природных жиров, как сложные эфиры, образованы высшими карбоновыми кислотами и: –1. высшими одноатомными спиртами; –2. двухатомным спиртом этиленгликолем; +3. трехатомным спиртом глицерином; –4. гетерофункциональными спиртами; –5. спиртами любой природы. Большинство природных жиров, как сложные эфиры, образованы высшими карбоновыми кислотами и трехатомным спиртом глицерином. Сложные эфиры это функциональные производные карбоновых кислот. Один из возможных способов их синтеза – реакция карбоновой кислоты со спиртом (реакция SN). Установлено, что природные жиры в качестве спиртового компонента в составе молекул содержат остаток трехатомного спирта глицерина.
12. В составе молекул твердых жиров преобладают остатки: –1. ненасыщенных жирных кислот; –2. олеиновой кислоты; –3. линолевой кислоты; +4. насыщенных жирных кислот; –5. линоленовой кислоты. В составе молекул твердых жиров преобладают остатки насыщенных жирных кислот. Жиры – простые липиды. По химическому строению являются сложными эфирами, которые образованы, обычно, высшими карбоновыми кислотами и трехатомным спиртом глицерином. Установлено, что в составе молекул твердых жиров преобладают остатки насыщенных карбоновых кислот.
13. В составе молекул жидких жиров (масла) преобладают остатки: +1. ненасыщенных жирных кислот; –2. стеариновой кислоты; –3. пальмитиновой кислоты; –4. насыщенных жирных кислот; –5. масляной кислоты. В составе молекул жидких жиров (масла) преобладают остатки ненасыщенных жирных кислот. Это установленный факт.
14. К насыщенным жирным высшим карбоновым кислотам относятся: +1. пальмитиновая; +2. стеариновая; –3. арахидоноввая; –4. олеиновая; –5. линолевая. К насыщенным жирным высшим карбоновым кислотам относятся пальмитиновая и стеариновая кислоты. Насыщенными называют соединения, в составе молекул которых есть только простые связи. Пальмитиновая кислота – С15Н31СООН – н.- гексадекановая кислота. Стеариновая кислота – С17Н35СООН – н.- октадекановая кислота.
15. К ненасыщенным жирным высшим карбоновым кислотам относятся: –1. пальмитиновая; –2. стеариновая; +3. олеиновая; –4. масляная; +5. линоленовая К ненасыщенным жирным высшим карбоновым кислотам относятся олеиновая и линоленовая кислоты. В составе молекул ненасыщенных жирных кислот есть двойные связи с цис- конфигурацией заместителей. Если двойных связей две или больше, все двойные связи имеют цис- конфигурацию и являются несопряженными. Олеиновая кислота, С17Н33СООН, цис-октадецен-9-овая кислота. Линоленовая, С17Н29СООН, цис, цис, цис-ооктадекатриен-9,12,15-овая кислота.
16. Для строения молекул жирных насыщенных кислот характерны следующие особенности: –1. система сопряженных двойных связей; –2. двойные связи несопряжены, они разделены sp3—гибридным атомом углерода; +3. зигзагообразная конформация углеродной цепи; –4. цис- конфигурация каждой двойной связи; –5. двойные связи, обычно, могут иметь как цис-, так и транс-конфигурацию. Для строения молекул жирных насыщенных кислот характерна зигзагообразная конформация углеродной цепи. В углеводородных радикалах насыщенных карбоновых кислот есть только простые связи, поэтому для них характерны конформации алканов. Наиболее термодинамически устойчивой является зигзагообразная конформация, поскольку в этой форме радикала отсутствуют заслоненные положения связей и заместителей (атомов).
17. Для строения молекул жирных ненасыщенных кислот характерны следующие особенности: –1. система сопряженных двойных связей; –2. транс-конфигурация каждой двойной связи; –3. цис-конфигурация одних и транс-конфигурация других двойных связей; +4. цис-конфигурация каждой двойной связи; +5. двойные связи несопряженные, каждая их пара разделена метиленовой группой. Для строения молекул жирных ненасыщенных кислот характерна цис-конфигурация каждой двойной связи в углеводородном радикале, при этом двойные связи несопряженные. Эти особенности строения ненасыщенных жирных кислот были установлены в результате изучения состава и строения природных жиров.
18. Стеариновая кислота имеет систематическое название: –1. н-гексадекановая; –2. бутановая; –3. цис-октадецен-9-овая; –4. цис, цис-октадекадиен – 9,12-овая; +5. н-октадекановая. Стеариновая кислота С17Н35СООН имеет систематическое название н.-октадекановая. В молекуле есть восемнадцать атомов углерода (С18), т.е. 8+10 = окта + дека, и соответствующий углеводород неразветвленного строения следует назвать нормальный октадекан. Карбоксильная группа обозначается суффиксом –овая кислота. Систематическое название дано по заместительной номенклатуре.
19. Олеиновая кислота имеет систематическое название: –1. н-гексадекановая; –2. бутановая; +3. цис-октадецен-9-овая; –4. цис, цис-октадекадиен – 9,12-овая; –5. н-октадекановая. Олеиновая кислота C17H33COOH имеет систематическое название цис-октадецен-9-овая кислота. Систематическое название дано по заместительной номенклатуре с учетом конфигурации заместителей у двойной связи. Родоначальной структурой является углеродный скелет октадекана (8+10 атомов углерода). Двойная связь обозначена суффиксом -ен от девятого атома углерода, карбоксильная группа обозначена как -овая кислота, поскольку ее атом углерода входит в родоначальную структуру.
20. Масляная кислота имеет систематического название: –1. н-гексадекановая; +2. бутановая; –3. цис-октадецен-9-овая; –4. цис, цис-октадекадиен – 9,12-овая; –5. н-октадекановая. Масляная кислота СН3-CH2-CH2-COOH имеет систематическое название бутановая кислота, потому что ее молекула является производной от бутана, углеводорода нормального строения с четырьмя атомами углерода в молекуле.
21. Природные воски как сложные эфиры образованы, обычно, высшими карбоновыми кислотами и: –1. спиртами любой природы; –2. этиленгликолем; –3. глицерином; –4. многоатомными спиртами; +5. высшими одноатомными спиртами. Природные воски как сложные эфиры образованы, обычно, высшими карбоновыми кислотами и высшими одноатомными спиртами. Такое строение восков было установлено в результате их исследования. Например, в пчелином воске содержится мирицилпальмитат, т.е. сложный эфир мирицилового спирта (С31Н63ОН) и пальмитиновой кислоты (С15Н31СООН).
22. Примерами природных восков являются: –1. холестерин; +2. спермацет; –3. ретиналь; +4. ланолин; 5. кокосовое масло. Примерами природных восков являются спермацет и ланолин. Спермацет представляет собой, главным образом, цетилпальмитат (
23. К воскам по составу и химическому строению молекулы следует отнести: –1. 3-линолеоил-1-олеоил-2-стеароилглицерин; –2. 1-пальмитоил-2-олеоил-L-глицеро-3-фосфохолин; –3. этилацетат; +4. цетилпальмитат; –5. C31H63OH. К воскам следует отнести по составу и химическому строению молекулы цетилпальмитат
24. К жирам по составу и химическому строению молекулы следует отнести: +1. 3-линолеоил-1-олеоил-2-стеароилглицерин; –2. 1-пальмитоил-2-олеоил-L-глицеро-3-фосфохолин; –3. этилацетат; –4. цетилпальмитат; –5. C31H63OH. К жирам по составу и химическому строению молекулы следует отнести 3-линолеоил-1-олеоил-2-стеароилглицерин. Природные жиры это сложные эфиры трехатомного спирта глицерина и высших насыщенных (например, С17Н35СООН стеариновая кислота) и ненасыщенных (например, С17Н31СООН линолевая и С17Н33СООН олеиновая кислоты) кислот.
25. К фосфолипидам по составу и химическому строению молекулах следует отнести: –1. 3-линолеоил-1-олеоил-2-стеароилглицерин; +2. 1-пальмитоил-2-олеоил-L-глицеро-3-фосфохолин; –3. этилацетат; –4. цетилпальмитат; –5. C31H63OH. К фосфолипидам по составу и химическому строению следует отнести 1-пальмитоил-2-олеоил-L-глицеро-3-фосфохолин. Большая часть фосфолипидов это сложные эфиры L-фосфатидовых кислот и гетерофункциональных спиртов (например, холин HO-CH2-CH2-NÅ(CH3)3). Структурной основой фосфатидовых кислот является глицерин, ацилированный по двум гидроксильным группам остатками высших карбоновых кислот (например, пальмитиновой и олеиновой) и фосфорилированный остатком фосфорной кислоты по третьей гидроксильной группе.
26. Высшими одноатомными спиртами, известными как компоненты природных восков, являются: –1. C17H35COOH; –2. CH2OH-CHOH-CH2OH; +3. C11H21CH2OH; –4. изобутиловый; +5. С16Н33ОН. Высшими одноатомными спиртами, известными как компоненты природных восков, являются, например, ланолиновый спирт С11Н21СН2ОН и цетиловый спирт С16Н33ОН. Высшими называют спирты, молекулы которых имеют более десяти атомов углерода. Одноатомными называют спирты, содержащие в своем составе одну функциональную группу –ОН.
27. К сложным омыляемым липидам относятся: –1. жиры; +2. глицерофосфолипиды; –3. масла; –4. воски; –5. стероиды. К сложным, т.е. образующим при гидролизе не два, а больше групп продуктов, омыляемым липидам относятся глицерофосфолипиды. Глицерофосфолипиды это сложные эфиры L-фосфатидовых кислот и гетерофункциональных спиртов. Фосфатидовую кислоту можно рассматривать как сложный эфир фосфорной кислоты и глицерина, ацилированного по двум гидроксильным группам остатками высших карбоновых кислот. Т.о. в молекуле глицерофосфолипида есть не менее четырех сложно-эфирных фрагментов, способных к гидролитическому расщеплению. Поэтому в результате гидролиза глицерофосфолипида образуется несколько (более двух) групп продуктов: глицерин, карбоновые кислоты, фосфорная кислота, гетерофункциональный спирт.
28. Глицерофосфолипиды по химической природе являются: –1. высшими карбоновыми кислотами; –2. многоатомными спиртами; –3. простыми эфирами глицерина и высших одноатомных спиртов; +4. сложными эфирами L-фосфатидовых кислот; –5. сложными эфирами высших одноатомных спиртов и высших карбоновых кислот. Глицерофосфолипиды (лицетины и кефалины) по химической природе являются сложными эфирами L-фосфатидовых кислот. В качестве спиртового компонента этих сложных эфиров известны, например, холин, коламин, серин.
29. Фосфатидовой кислотой по составу и химическому строению молекулы является: –1. цетилпальмитат; –2. 2-линолеоил-1-стеароил-L-глицеро-3-фосфосерин; –3. пропилдиэтилфосфат; –4. L-2-линолеоил-3-олеоил-1-стеароилглицерин; +5. 2-линоленоил-1-пальмитоил-L-глицеро-3-фосфорная кислота. Фосфатидовой кислотой по составу и химическому строению молекулы является 2-линоленоил-1-пальмитоил-L-глицеро-3-фосфорная кислота. Фосфатидовые кислоты это сложные «моно» эфиры фосфорной кислоты и глицерина, ацилированного по двум гидроксильным группам, остатками высших карбоновых кислот. В отличие от фосфатидовых кислот, глицерофосфолипиды (см. вариант ответа 2) являются «ди» эфирами фосфорной кислоты, т.к. имеют еще один сложноэфирный фрагмент между остатками фосфорной кислоты и гетерофункционального спирта.
30. Обязательными компонентами бислоя клеточных мембран вследствие дифильности своего строения являются: –1. твердые жиры; –2. масла; –3. воски; –4. терпеноиды; +5. глицерофосфолипиды. Обязательными компонентами бислоя клеточных мембран вследствие дифильности своего строения являются глицерофосфолипиды. «Полярную голову» их структуры образует фосфорилированный конец глицериновой основы липида. Кислотная ионизация фосфорного остатка и основная ионизация остатка гетерофункционального спирта создают биполярный ион. «Неполярный хвост» структуры липида образован диацилированным концом глицериновой основы.
31. Омыляемые липиды как сложные эфиры способны подвергаться гидролизу при нагревании: –1. только в кислой среде; –2. только в щелочной среде; +3. как в кислой, так и в щелочной среде; –4. неверно, гидролиз вообще невозможен, –5. нет подходящего варианта ответа. Омыляемые липиды как сложные эфиры способны подвергаться гидролизу при нагревании как в кислой, так и в щелочной среде потому, что и кислоты (Н+) и основания (например, ОН-) катализируют гидролиз сложных эфиров (реакция SN). Кислоты увеличивают активность электрофильного раакционного центра сложного эфира, протонируя пиридиновый атом кислорода функциональной группы, и затем формируют уходящую группу. Основания дают в реакцию более активный, чем электронейтральная молекула воды, нуклеофильный реагент (например, ОН-).
32. Продуктами гидролиза восков в щелочной среде при нагревании являются: –1. глицерин и соли, обычно, высших карбоновых кислот (мыло); +2. соль высшей карбоновой кислоты и высший одноатомный спирт; –3. глицерин, соли высших карбоновых кислот и соли фосфорной кислоты; –4. соли высшей карбоновой кислоты и высшего спирта; –5. глицерин, соли высших карбоновых кислот, соли фосфорной кислоты и, например, коламин. Продуктами гидролиза восков в щелочной среде при нагревании являются соль высшей карбоновой кислоты и высший одноатомный спирт. Природные воски это сложные эфиры высших карбоновых кислот и высших одноатомных спиртов. Поэтому гидролиз воска дает в качестве продуктов эти соединения. Но в щелочных условиях карбоновые кислоты образуются в виде их солей. Спирты в этих условиях солей не образуют.
33. Продуктами гидролиза цетилпальмитата в щелочной среде при нагревании являются: –1. С15Н31СООН + С16Н33ONa; –2. C15H31COOH + C16H33OH; –3. C15H31COONa + C16H33ONa; +4. C15H31COONa + C16H33OH; –5. нет правильного ответа. Дата добавления: 2015-11-26 | Просмотры: 2099 | Нарушение авторских прав |
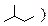 . Поэтому неомыляемые липиды называют изопреноидами.
. Поэтому неомыляемые липиды называют изопреноидами.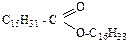 ), в состав ланолина входят сложные эфиры, образованные высшими карбоновыми кислотами и ланолиновым спиртом С11Н21СН2ОН. Природные воски это сложные эфиры высших карбоновых кислот и высших одноатомных спиртов.
), в состав ланолина входят сложные эфиры, образованные высшими карбоновыми кислотами и ланолиновым спиртом С11Н21СН2ОН. Природные воски это сложные эфиры высших карбоновых кислот и высших одноатомных спиртов.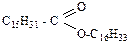 . Природные воски являются сложными эфирами высших карбоновых кислот (например, пальмитиновая кислота С15Н31СООН) и высших одноатомных спиртов (например, цетиловый спирт С16Н33ОН).
. Природные воски являются сложными эфирами высших карбоновых кислот (например, пальмитиновая кислота С15Н31СООН) и высших одноатомных спиртов (например, цетиловый спирт С16Н33ОН).