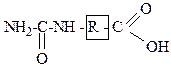|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
СУЛЬФОНОВЫЕ КИСЛОТЫ.1. Выберите из предложенных ниже соединений функциональные производные угольной кислоты: – 1. бутаноилбромид; +2. диэтилкарбонат; +3. этилкарбамат; – 4. втор.-бутилхлорид; +5. мочевина. Эти соединения являются полными (2,5) и смешанными (3) функциональными производными угольной кислоты.
2. Продуктами гидролиза этилкарбамата в кислой среде являются: – 1. С2H5OH + CO2 + H2О; +2. C2H5OH + CO2 + ÅNH4; – 3. C2H5О- + CO32- + NH3; – 4. C2H5O- + HCO3- + Н2О; – 5. C2H5OH + CO32- + NH3.
3. К монопроизводным угольной кислоты относятся: +1. хлормуравьиная кислота; +2. карбаминовая кислота; – 3. карбамид; – 4. диэтилкарбонат; – 5. фосген. Эти соединения обладают общей формулой
4. К полным функциональным производным угольной кислоты относятся: +1. фосген; +2. диметилкарбонат; +3. мочевина; – 4. карбаминовая кислота; – 5. хлоругольная кислота. Эти соединения обладают общей формулой
5. Смешанными функциональными производными угольной кислоты являются: +1. бензилоксикарбонилхлорид; +2. этилхлорформиат; +3. метилкарбамат; – 4. мочевина; – 5. карбаминовая кислота. Эти соединения обладают общей формулой 6. Для функциональных производных угольной кислоты характерны реакции нуклеофильного замещения, протекающие по: – 1. нуклеофильному центру; – 2. С-Н кислотному центру; +3. электрофильному центру; – 4. основному центру; – 5. О-Н кислотному центру. Функциональные производные угольной кислоты выступают в реакциях нуклеофильного замещения в качестве субстратов (предоставляют электрофильный центр).
7. Выберите соединения, которые могут вступать во взаимодействие с бензилоксикарбонилхлоридом с образованием устойчивых продуктов: +1. метиламин; – 2. диэтиловый эфир; +3. Н2О (Н+); +4. Н2О (ОН-); – 5. HCl. Бензилоксикарбонил хлорид имеет сильный электрофильный центр, используемый в реакциях с нуклеофильными реагентами – (1, 3, 4).
8. Выберите соединения, вступающие во взаимодействие с фосгеном: +1. аммиак; – 2. трет.-бутиламмония хлорид; +3. бензол при t и наличичии AlCl3; +4. 2-аминобутановая кислота; – 5. диизопропиловый эфир. Фосген является субстратом в реакциях нуклеофильного замещения (с соединениями 1 и 4) и электрофильным реагентом в реакциях электрофильного замещения (с соединением 3).
9. Главными реакционными центрами мочевины являются: +1. основный; +2. N-H кислотный; – 3. С-Н кислотный; +4. электрофильный; +5. нуклеофильный. Определяется электронным строением мочевины:
10. Выберите утверждения, характеризующие основные свойства мочевины: +1. обусловлены атомом кислорода; +2. являются слабыми; +3. это однокислотное основание; – 4. являются сильными; – 5. обусловлены атомами азота. Определяется электронным строением мочевины:
11. В реакции замещения мочевина как нуклеофильный реагент вступает со следующими веществами: +1. ацетилхлорид; +2. пропионовый ангидрид; – 3. метил-неопентиловый эфир; +4. малоновый эфир; +5. изобутилхлорид. Эти соединения являются субстратами в реакциях нуклеофильного замещения (предоставляют электрофильный центр).
12. Нуклеофильные свойства мочевины проявляются в реакциях, протекающих по механизму: +1. AN; – 2. SN (мочевина в качестве субстрата); +3. SN (мочевина в качестве реагента); – 4. SE – 5. AE. Протекание реакций по этим механизмам предусматривает использование мочевины в качестве нуклеофильного реагента.
13. Биуретовая реакция является качественной на: – 1. мочевину; +2. биурет; – 3. аминокислоты; +4. пептиды; +5. белки. Биуретовая реакция служит для обнаружения пептидной связи [
14. Выберите названия уреидов карбоновых кислот: – 1. 3-уреидопропановая кислота; +2. уреид бутановой кислоты; – 3. 3-уреидобутановая кислота; +4. уреид валериановой кислоты; – 5. биурет. Эти соединения обладают общей формулой:
15. Продуктами гидролиза 2-уреидобутановой кислоты в кислой среде являются:
Продуктами гидролиза являются СО2, аминокислота и аммиак, причем аммиак и аминогруппа аминокислоты в кислой среде протонируются.
16. Выберите утверждения, характеризующие основные свойства гуанидина: – 1. обусловлены атомом азота пиррольного типа; +2. обусловлены атомом азота пиридинового типа; +3. выражены сильнее, чем у мочевины; +4. катион гуанидина более устойчив, чем катион мочевины; – 5. выражены слабее, чем у мочевины. Определяется электронным строением гуанидина:
17. К сульфоновым кислотам относятся: +1. бензолсульфоновая кислота; +2. n-толуолсульфоновая кислота; – 3. ди-(м-толил)сульфид; – 4. ди-(2-нитробензол)сульфоксид; +5. бензолдисульфоновая 1,3-кислота. Эти соединения имеют сульфогруппу (-SO3H).
18. Выберите утверждения, характеризующие кислотные свойства сульфоновых кислот: +1. обусловлены ОН-кислотным центром; +2. выражены сильнее, чем у карбоновых кислот; +3. сульфонат – анион устойчив за счет делокализации отрицательного заряда; – 4. выражены слабее, чем у карбоновых кислот; – 5. обусловлены С-Н-кислотным центром. Определяется электронным строением сульфогруппы:
19. К функциональным производным арилсульфоновых кислот можно отнести следующие: – 1. сульфиды; – 2. сульфоны; +3. сульфогалогениды; +4. алкилсульфонаты; +5. сульфамиды. Эти соединения обладают общей формулой:
20. Функциональными производными арилсульфоновых кислот являются: +1. тозилхлорид; +2. о-нитробензолсульфамид; – 3. ди-(n-этилбензол)сульфид; +4. этилбензолсульфонат; – 5. ди-(м-карбоксибензол)сульфон. Эти соединения обладают общей формулой:
21. Сульфохлорид из бензолсульфоновой кислоты можно получить с помощью: +1. хлорида фосфора (V); – 2. хлорида натрия; +3. тионилхлорида; +4. хлорсульфоновой кислоты; – 5. хлора в щелочных условиях. Эти реагенты предоставляют активный нуклеофильный реагент Cl-, способный заместить –ОН в сульфогруппе.
22. Тозилхлорид в качестве субстрата вступает во взаимодействие со следующими из ниже перечисленных веществ: +1. изопропиловым спиртом в щелочной среде; +2. аммиаком; – 3. трет.-бутиламмоний хлоридом; – 4. метилхлоридом; – 5. бензальдегидом. Тозилсульфохлорид в качестве субстрата предлагает свой электрофильный центр на атоме серы, т.е. вступает во взаимодействие с нуклеофильными реагентами (1,2).
23. С помощью этилбензолсульфоната (алкилирующий агент) можно получить следующие вещества: +1. диэтиловый эфир; +2. диэтиламин; +3. пропаннитрил; – 4. этансульфоновая кислота; – 5. этилхлорид. Этилбензолсульфонат является хорошим алкилирующим субстратом – предлагает свой электрофильный центр в алкильном радикале, т.е. вступает во взаимодействие с нуклеофильными реагентами этанолом, аммиаком, цианидами с образованием, соответственно, соединений 1,2 и 3.
24. Выберите утверждения, характеризующие кислотные свойства сульфамида: +1. обусловлены N-H кислотным центром; +2. выражены сильнее, чем у амидов карбоновых кислот; +3. имеют тот же порядок (рКа), как и у фенолов; – 4. выражены слабее, чем у амидов карбоновых кислот; – 5. обусловлены С-Н кислотным центром. Определяется электронным строением сульфамида:
25. Тозиламид подвергается гидролизу в кислой среде с образованием следующих продуктов:
Гидролиз сульфамидов осуществляется только в кислой среде, при этом образуется сульфокислота и соль аммония.
26. Хлор- и дихлорамин Т получают в щелочной среде с использованием гипохлоритов: +1. из тозиламида; – 2. из бензолсульфамида; – 3. из n-толиламина; – 4. из анилина; – 5. из м-метилбензамида. Из тозиламида при эквимолярном количестве реагентов образуется хлорамин Т, а при избытке гипохлорита – дихлорамин Т. 27. Из предложенных ниже выберите общую формулу сульфаниламидных лекарственных препаратов:
Сульфанидамидные препараты имеют в своем составе фрагмент:
28. Выберите утверждения, характеризующие процесс десульфирования ароматических сульфоновых кислот; +1. реакция десульфирования является обратимой; +2. осуществляется при нагревании кислоты с перегретым паром; – 3. проводится в обычных температурных условиях; – 4. реакция десульфирования протекает только в прямом направлении; – 5. является качественной реакцией на сульфокислоты ароматического ряда. Процесс сульфирования аренов является обратимым. Протекание процесса в обратном направлении (реакция десульфирования) осуществляется в присутствии избытка воды при высокой температуре (перегретый пар).
29. Из сульфоновых кислот, используя стадию десульфирования, можно получить соединения следующих классов: +_1. фенолы; +2. амины; +3. тиолы; +4. нитрилы; – 5. замещенные сульфокислоты. При реакции сульфоновых кислот с замещением сульфогруппы (реакции нуклеофильного замещения) можно использовать различные нуклеофильные реагенты, например, фенолы, амины, тиолы, цианиды.
30. Выберите названия уреидокислот: +1. 2-уреидобутановая кислота; – 2. уреид гексановой кислоты; – 3. мочевина; +4. 3-уреидопентановая кислота; – 5. уреид пропановой кислоты. Эти соединения обладают общей формулой:
31. Сульфаниламиды подвергаются гидролизу: +1. в кислой среде; – 2. в щелочной среде; – 3. в нейтральной среде; – 4. как в щелочной среде, так и в нейтральной среде; – 5. как в кислой так и щелочной среде. Сульфамиды подвергаются гидролизу только в кислой среде, в щелочной – они образуют соли.
Дата добавления: 2015-11-26 | Просмотры: 1955 | Нарушение авторских прав |
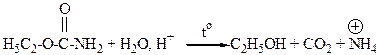
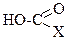 где Х = Cl (1) или Х = NH2 (2).
где Х = Cl (1) или Х = NH2 (2). , где Х = Y = Cl (1), х=у=-ОСН3(2), или Х = Y = NH2 (3).
, где Х = Y = Cl (1), х=у=-ОСН3(2), или Х = Y = NH2 (3).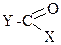 , где Х =
, где Х =  , Y = Cl (1) или Х =
, Y = Cl (1) или Х = 
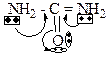
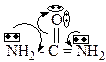
 ].
].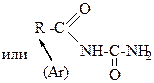
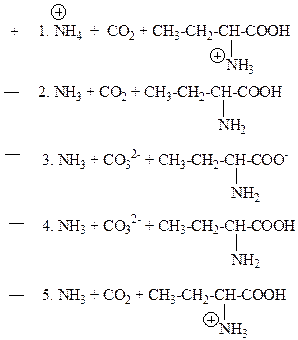
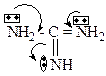

 , где Х=галоген (3), или –OR (4), или NH2 (5).
, где Х=галоген (3), или –OR (4), или NH2 (5).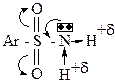
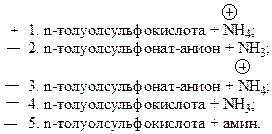
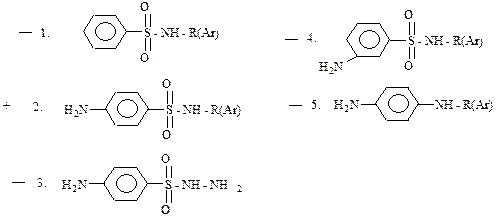
 , т.е.являются замещенными по атому азота сульфамидной группы производными сульфаниламида.
, т.е.являются замещенными по атому азота сульфамидной группы производными сульфаниламида.