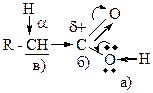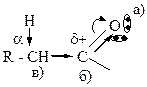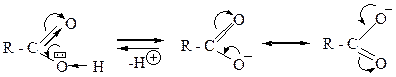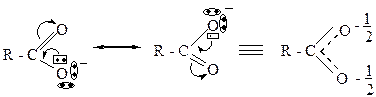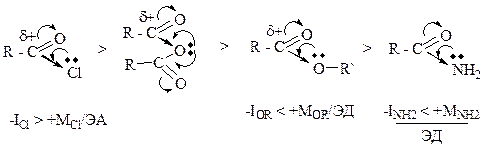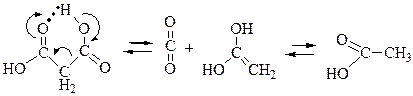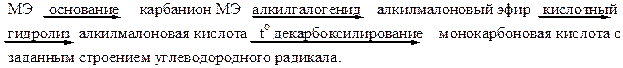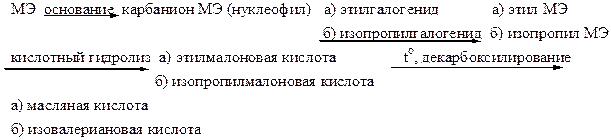|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ.1. К классу карбоновых кислот относятся соединения: – 1. 2-метилпропанамид; +2. 2-метилпропановая кислота; – 3. 2-гидроксипропаналь; +4. пропен-2-овая кислота; – 5. 2-метилпропансульфоновая кислота. Данные соединения имеют в молекулах карбоксильную группу, обозначаемую в систематическом названии по заместительной номенклатуре суффиксом –овая кислота.
2. Функциональными производными карбоновых кислот являются: +1. ангидриды; – 2. кетоны; – 3. амины; +4. амиды; +5. сложные эфиры. Функциональные группы данных соединений можно рассматривать как результат замещения гидроксила в карбоксильной группе карбоновой кислоты на другую функциональную группу: ацила – в ангидридах; амино – в амидах; алкокси – в сложных эфирах.
3. К функциональным производным карбоновых кислот относятся: – 1. циклогексанол; +2. метилэтаноат; +3. этаноилхлорид; +4. N-метилпропанамид; – 5. пропановая кислота. Функциональные группы данных соединений можно рассматривать, как результат замещения гидроксила в карбоксильной группе соответствующей карбоновой кислоты на другую функциональную группу: метокси- в метилэтаноате, хлор- в этаноилхлориде; метиламино – в N-метилпропанамиде.
4. По числу карбоксильных групп в молекуле карбоновые кислоты классифицируют на: +1. монокарбоновые; +2. дикарбоновые; – 3. ароматические; +4. поликарбоновые; – 5. алифатические В молекулах карбоновых кислот с углеводородным радикалом может быть связана одна (1), две (2) или несколько (4) карбоксильных групп.
5. По природе углеводородного радикала карбоновые кислоты классифицируют на: – 1. монокарбоновые; – 2. дикарбоновые; +3. ароматические; +4. алициклические (насыщенные и ненасыщенные); +5. алифатические (насыщенные и ненасыщенные). В молекулах карбоновых кислот карбоксильная группа может быть связана с ароматическим (3), алифатическим (насыщенным или ненасыщенным) (5) или алициклическим (насыщенным или ненасыщенным) (4) углеводородным радикалом.
6. Ароматическими карбоновыми кислотами являются: – 1. циклогексанкарбоновая кислота; +2. бензойная кислота; – 3. глутаровая (пентандиовая) кислота; +4. фталевая (бензолдикарбоновая) кислота; – 5. бензолсульфокислота. В молекулах одна- (2) или две- (4) карбоксильные группы связаны с ароматическим углеводородным радикалом.
7. Алифатическими (ациклическими) монокарбоновыми кислотами являются: – 1. циклогексанкарбоновая кислота; – 2. бензойная кислота; +3. пропановая кислота; – 4. глутаровая (пентандиовая) кислота; +5. валериановая (пентановая) кислота. В молекулах одна карбоксильная группа связана с алифатическим ациклическим углеводородным радикалом.
8. Алифатические карбоновые кислоты имеют в своих молекулах обусловленные карбоксильной группой реакционные центры: +1. ОН-кислотный; – 2. нуклеофильный на атоме серы; +3. электрофильный; +4. a-СН-кислотный; – 5. NH-кислотный.
В результате распределения электронной плотности в карбоксильной группе образуются ОН-кислотный (а) и электрофильный (б) реакционные центры. Электроноакцепторное влияние карбоксильной группы на радикал в результате отрицательного индуктивного эффекта усиливает поляризацию связи a-СН- и формирует a-СН кислотный центр (в).
9. Функциональные группы как карбоновых кислот, так и их функциональных производных обуславливают в молекулах реакционные центры: +1. электрофильный; +2. основный; – 3. ОН-кислотный; +4. a-СН-кислотный; – 5. NH-кислотный. Общим для карбоновых кислот и их функциональных производных является ацильный фрагмент:
На пиридиновом атоме кислорода, имеющем неподеленные электронные пары, находится основный центр (а); поляризацией σ- и π-связей С=О формируется электрофильный центр (б); электроноакцепторное влияние оксогруппы вследствие ее отрицательного индуктивного эффекта усиливает поляризацию связи a С-Н и формирует a-СН кислотный центр (в).
10. С участием ОН-кислотного реакционной центра в молекулах карбоновых кислот протекают реакции: – 1. нуклеофильного замещения - образования функциональных производных; +2. ионизации в водных растворах; – 3. a-галогенирования (по Гелю-Фольгарду-Зелинскому); – 4. элиминирования; +5. образования солей с основаниями. При отщеплении протона из ОН кислотного центра карбоновой кислоты под действием основания (H2O, OH-, NH3 и др.) образуется стабильный карбоксилат-анион и гидратированный протон в водных растворах или соль в растворах оснований.
11. С участием электрофильного реакционного центра в молекулах карбоновых кислот протекают реакции: +1. нуклеофильного замещения - образования функциональных производных; – 2. ионизации в водных растворах; – 3. a-галогенирования (по Гелю-Фольгарду-Зелинскому); – 4. элиминирования; – 5. образования солей с основаниями. Электрофильный реакционный центр в карбоксильной группе карбоновых кислот подвергается атаке нуклеофильным реагентом, который замещает гидроксил с образованием функциональных производных карбоновых кислот.
12. По a-СН-кислотному реакционному центру в молекулах карбоновых кислот протекают реакции: – 1. нуклеофильного замещения – образования функциональных производных; – 2. ионизации в водных растворах; +3. a-галогенирования (по Гелю-Фольгарду-Зелинскому); – 4. образования солей с основаниями; – 5. восстановления. В результате электроноакцепторного влияния карбоксильной группы на углеводородный радикал увеличивается подвижность протонов у a-углеродного атома, что позволяет проводить реакции a-галогенирования с галогеном в присутствии следов фосфора (или галогенида фосфора). Кислотность a- С-Н кислотного центра ниже, чем ОН-кислотного.
13. В результате реакции гидроксида натрия с бензойной кислотой образуется: – 1. метилбензоат; – 2. бензамид; +3. бензоат натрия; – 4. ацетат натрия; – 5. салициловая (о-гидроксибензойная) кислота. Бензойная кислота вступает в реакцию с гидроксидом натрия как основанием по наиболее сильному ОН-кислотному реакционному центру с образованием соответствующей соли.
14. При взаимодействии пропановой кислоты с этиловым спиртом в кислой среде при нагревании образуется: +1. этилпропаноат; – 2. пропанамид; – 3. пропаноат натрия; – 4. a-бромпропановая кислота; – 5. аланин (a-аминопропановая кислота). Пропановая кислота вступает в реакцию с этиловым спиртом как нуклеофильным реагентом по электрофильному реакционному центру. Реакция протекает как нуклеофильное замещение (SN) гидроксила в карбоксильной группе на этоксигруппу с образованием соответствующего сложного эфира. Протон (кислая среда) является катализатором – ускоряет реакцию за счет усиления электрофильного реакционного центра субстрата (пропановой кислоты).
15. При действии брома на пропановую кислоту в присутствии следов фосфора образуется: – 1. этилпропаноат; – 2. пропанамид; – 3. пропаноат натрия; +4. a-бромпропановая кислота; – 5. аланин (a-аминопропановая кислота). Пропановая кислота с бромом в присутствии следов фосфора вступает в реакцию a-галогенирования (a-бромирования) по a-СН-кислотному реакционному центру.
16. Реакции нуклеофильного замещения у функциональных производных карбоновых кислот протекают по реакционному центру: – 1. ОН-кислотному; +2. электрофильному; – 3. a-СН-кислотному; – 4. NH-кислотному; – 5. нет правильного варианта. В реакции нуклеофильного замещения функциональные производные карбоновых кислот вступают как субстраты с нуклеофильным реагентом, который атакует соответственно электрофильный реакционный центр в субстрате.
17. Максимальная выраженность кислотных свойств карбоновых кислот в ряду органических соединений (кроме сульфоновых кислот) обусловлены: +1. сильным электроноакцепторным влиянием оксо-группы (С=О) на ОН-кислотный центр. +2. значительной полярностью связи ОН и ее способностью к ионизации; – 3. подвижностью протона в a-СН кислотном центре в результате электроноакцепторного влияния СООН группы; +4. стабильностью карбоксилат-аниона; – 5. низкой устойчивостью карбоксилат-аниона. ОН-кислотные свойства выше, чем СН-кислотные, так как большая электроотрицательность атома кислорода по сравнению с атомом углерода обуславливает большую полярность связи ОН и ее способность к отщеплению протона. Максимальная выраженность ОН-кислотных свойств у карбоновых кислот обусловлена особенностями электронного строения карбоксильной группы (а): сильное электроноакцепторное влияние оксо-группы (С=О) на О-Н кислотный центр приводит к значительному увеличению полярности связи ОН и ее способности к ионизации. Полная делокализация отрицательного заряда в карбоксилат-анионе (б) обуславливает его стабильность.
18. Устойчивость карбоксилат-аниона обусловлена наличием в нем: – 1. π,π-сопряжения; +2. р,π-сопряжения; – 3. циклической сопряженной системы; +4. полной делокализации отрицательного заряда; – 5. концентрацией отрицательного заряда на одном из атомов. Устойчивость карбоксилат-аниона обусловлена полной делокализацией отрицательного заряда в его открытой р,π-сопряженной системе.
19. Для ОН-кислотных свойств у карбоновых кислот справедливы утверждения: +1. муравьиная кислота – самая сильная в ряду насыщенных монокарбоновых кислот; – 2. фенолы более сильные ОН-кислоты, чем спирты; – 3. электроноакцепторные заместители в углеводородном радикале уменьшают основные свойства; +4. дикарбоновые кислоты в целом более сильные, чем монокарбоновые; +5. сила дикарбоновых кислот уменьшается с увеличением расстояния между карбоксильными группами. Электронодонорные заместители, такие как углеводородные радикалы, уменьшают полярность связи О-Н и ее способность к ионизации, то есть уменьшают силу карбоновых кислот. Поэтому в ряду насыщенных монокарбоновых кислот самая сильная – муравьиная кислота, не имеющая углеводородный радикал. Электроноакцепторные заместители увеличивают полярность связи ОН и ее способность к ионизации, то есть увеличивают силу карбоновых кислот. Вторая карбоксильная группа в дикарбоновых кислотах является электроноакцепторным заместителем по отношению к первой карбоксильной группе. Поэтому дикарбоновые кислоты более сильные, чем монокарбоновые. С увеличением количества σ-связей между ними электроноакцепторное влияние затухает, так как затухает индуктивный эффект по цепи σ-связей. Поэтому сила дикарбоновых кислот также уменьшается.
20. Ряду кислот: муравьиная, этановая, пропановая соответствует последовательность рКа: – 1. 3,75 → 4,87 → 4,75; +2. 3,75 → 4,75 → 4,87; – 3. 4,75 → 3,75 → 4,87; – 4. 4,87 → 4,75 → 3,75; – 5. 4,75 → 4,87 → 3,75. Увеличение рКа соответствует уменьшению кислотных свойств. СН3 и С2Н5 - соответственно в этановой и пропановой кислотах являются электронодонорными заместителями и уменьшают силу данных карбоновых кислот по сравнению с муравьиной кислотой. Электронодонорное влияние С2Н5 - выше чем СН3-, поэтому пропановая кислота слабее, чем этановая.
21. Ряду кислот: уксусная (этановая) → монохлоруксусная → трихлоруксусная соответствует последовательность рКа: +1. 4,75 → 2,86 → 1,66; – 2. 2,86 → 4,75 → 1,66; – 3. 2,86 → 1,66 → 4,75; – 4. 1,66 → 4,75 → 2,86; – 5. 1,66 → 2,86 → 4,75. Уменьшение рКа соответствует увеличению кислотности. Атомы Cl являются электроноакцепторными заместителями и увеличивают кислотные свойства карбоновых кислот в данном ряду.
22. Ряду кислот: пропановая → малоновая (пропандиовая) →щавелевая (этандиовая) соответствует последовательность рКа: (диссоциация дикарбоновых кислот по 1 ступени): – 1. 1,27 → 2,86 → 4,87; – 2. 1,27 → 4,87 → 2,86; – 3. 2,86 → 1,27 → 4,87; – 4. 2,86 → 4,87 → 1,27; +5. 4,87 → 2,86 → 1,27. Уменьшению рКа соответствует увеличение кислотности. Вторая карбоксильная группа является электроноакцепторным заместителем и увеличивает кислотные свойства дикарбоновых кислот по сравнению с монокарбоновой. С увеличением количества σ-связей между карбоксильными группами затухает их отрицательный индуктивный эффект и взаимное электроноакцепторное влияние друг на друга, поэтому кислотные свойства малоновой кислоты ниже, чем щавелевой.
23. При растворении в воде карбоновой кислоты: – 1. среда щелочная; – 2. рН > 7; – 3. среда нейтральная; +4. рН < 7; +5. среда кислая. При растворении в воде карбоновой кислоты происходит ионизация ее карбоксильной группы за счет ОН-кислотного центра с образованием карбоксилат-аниона и гидратированного протона. Появление протонов обуславливает кислую реакцию среды – рН < 7.
24. Малорастворимые в воде карбоновые кислоты, обычно, растворяются в: – 1. сильных минеральных кислотах; – 2. физиологическом растворе; +3. насыщенном растворе NaHCO3; +4. растворе щелочи; – 5. насыщенном растворе Na2SO4. Малорастворимая в воде карбоновая кислота в растворе щелочи вступает с ней в реакцию по ОН-кислотному реакционному центру и образует соль. Соль имеет ионное строение и более растворима в воде, чем исходная карбоновая кислота. Аналогично карбоновая кислота реагирует с NaHCO3 - солью более слабой, чем она, угольной кислоты.
25. При добавлении щелочи при комнатной температуре растворяются: +1. фенол; – 2. анилин; +3. коричная кислота; +4. бензойная кислота; – 5. метилбензоат. При комнатной температуре щелочь вступает в реакцию как основание и реагирует с наиболее сильными среди прочих ОН-кислотными реакционными центрами фенола и карбоновых кислот. В результате реакций образуются соли, которые имеют ионное строение и поэтому лучше растворимы в воде, чем исходные вещества.
26. В насыщенном растворе NaHCO3 растворяются: – 1. β-нафтол; +2. бензойная кислота; – 3. метилбензоат; +4. коричная кислота; +5. фталевая кислота. NaHCO3 является солью угольной кислоты, которая слабее карбоновой кислоты, но сильнее, чем любой из фенолов. Поэтому только карбоновые кислоты способны вступать в реакцию солеобразования с NaНCO3. Образующиеся в результате реакции соли карбоновых кислот имеют ионное строение и более растворимы в воде, чем исходные соединения.
27. Карбоновая кислота как субстрат вступает в реакцию образования функциональных производных с: +1. галогенидами фосфора (РHal5, PHal3); – 2. алкилгалогенидами; +3. спиртом в кислой среде; – 4. галогеноводородными кислотами; – 5. алкилсульфатами. Галогениды фосфора (РHal5, PНal3), спирт предоставляют нуклеофильные частицы, с которыми карбоновая кислота при определенных условиях вступает в реакцию образования функциональных производных как субстрат.
28. Масляная (бутановая) кислота вступает в реакцию образования сложного эфира с: +1. CH3CH2OH/HÅ, to; – 2. CH3CH2Br/NaOH, to; – 3. SOCl2 или PCl5, to; – 4. NH3/to; +5. (CH3)2CHOH/HÅ, to. Этиловый и изопропиловый спирты являются нуклеофильными реагентами, с которыми масляная кислота вступает в реакцию образования сложного эфира как субстрат по электрофильному центру, а реакция протекает, как нуклеофильное замещение. Данные нуклеофильные реагенты являются источниками алкоксигрупп, на которые замещается гидроксильная группа карбоновой кислоты при образовании сложного эфира.
29. Изомасляная (2-метилпропановая) кислота вступает в реакцию образования своего хлорангидрида (ацилхлорида) с: – 1. CH3-CH2-OH/HÅ, to; – 2. CH3-CH2-Br/OH-, to; +3. SOCl2/to; +4. PCl3/to; – 5. NH3/to. Являются реагентами, с которыми изомасляная кислота вступает в реакцию образования хлорангидрида как субстрат по электрофильному центру.
30. Метиловый эфир 3-метилбутановой (изовалериановой) кислоты вступает в реакцию образования амида с: – 1. CH3CH2OH/HÅ, to; – 2. CH3CH2Br/OH-, to; – 3. SOCl2, to; +4. NH3, to; – 5. (CH3)2CHOH/HÅ, to. Является нуклеофильным реагентом, с которым метиловый эфир изовалериановой кислоты вступает в реакцию образования амида как субстрат по электрофильному центру. Реакция протекает как нуклеофильное замещение. При этом метокси-группа в метоксикарбонильной группе сложного эфира замещается на амино-группу.
31. Продукт реакции уксусной (этановой) кислоты с метиловым спиртом следует отнести к классу: – 1. ацилгилогенида; – 2. простого эфира; +3 сложного эфира; – 4. амида; – 5. нитрила. Уксусная кислота с метиловым спиртом, как нуклеофильным реагентом, вступает в реакцию нуклеофильного замещения, как субстрат, по электрофильному центру. В результате реакции гидроксильная группа в составе карбоксильной замещается на метокси-группу. По образовавшейся метоксикарбонильной группе соединение относится к классу сложного эфира.
32. Продукт реакции пропионовой кислоты с тионилхлоридом следует классифицировать как: +1. ацилгалогенид; – 2. простой эфир; – 3. сложный эфир; – 4. амид; – 5. нитрил. Пропионовая кислота с тионилхлоридом, как реагентом вступает в реакцию нуклеофильного замещения как субстрат, по электрофильному центру. В результате реакции гидрокси-группа в составе карбоксильной замещается на хлор. По образовавшейся функциональной группе –СOCl соединение относится к классу ацилгалогенида.
33. Из масляной (бутановой) кислоты при нагревании в присутствии P2O5 образуется: – 1. ацилгалогенид; – 2. простой эфир; – 3. сложный эфир; +4. ангидрид; – 5. амид. P2O5 как водоотнимающее средство способствует реакции образования ангидрида из 2-х молекул карбоновой кислоты с отщеплением молекулы воды.
34. Подвергаются гидролизу в кислой среде с образованием карбоновых кислот: – 1. простые эфиры; +2. сложные эфиры; – 3. амины; +4. амиды; – 5. гликозиды. Являются функциональными производными карбоновых кислот. С водой, как нуклеофильным реагентом, вступают в реакцию гидролиза по электрофильному реакционному центру. Гидролиз протекает по механизму нуклеофильного замещения. В результате реакции уходящая группа замещается на гидрокси-группу и образуется карбоксильная группа карбоновой кислоты. 35. Гидролизуются в кислой среде с образованием карбоновой кислоты: +1. этилэтаноат; – 2. этилхлорид; +3. бензамид; – 4. метилфениловый эфир; +5. уксусный ангидрид. Являются функциональными производными карбоновых кислот. С водой, как нуклеофильным реагентом, вступают в реакцию гидролиза по электрофильному реакционному центру. Реакция протекает по механизму нуклеофильного замещения. В результате уходящая группа замещается на гидрокси-группу и образуется карбоксильная группа карбоновой кислоты.
36. В ряду галогеноангидриды → ангидриды → сложные эфиры → амиды уменьшаются: +1. величина положительного заряда в электрофильном центре; +2. устойчивость уходящих групп – соответствующих анионов в реакциях SN; – 3. устойчивость к гидролизу; +4. ацилирующая способность в реакциях SN; +5. скорость реакций со спиртами, аммиаком, аминами. В данном ряду уменьшается величина положительного заряда в электрофильном центре, так как уменьшается электроноакцепторное, увеличивается электронодонорное влияние групп –Cl (Br) → -O-CO-R → -OR → -NH2:
Уменьшение устойчивости уходящих групп в ряду Cl- → R-COO- → OR- → NH2- кореллирует с увеличением их основности. Вышеперечисленные факторы обуславливают уменьшение ацилирующей способности и скорости в реакциях нуклеофильного замещения, к которым относятся реакции функциональных производных карбоновых кислот со спиртами, аммиаком, аминами и водой.
37. Наибольшей ацилирующей способностью обладает: – 1. этанамид; – 2. метилэтаноат; +3. ацетилхлорид; – 4. уксусная кислота; – 5. N-метилэтанамид. Среди перечисленных субстратов реакций ацилирования ацетилхлорид имеет максимальный положительный заряд в электрофильном центре, так как среди прочих уходящих групп Z хлор-электроноакцептор. Кроме того, галогенид-анион имеет максимальную устойчивость в ряду уходящих групп функциональных производных карбоновых кислот.
38. Скорость гидролиза в равных условиях максимальна у: – 1. бензамида; +2. уксусного ангидрида; – 3. этилацетата; – 4. бензойной кислоты; – 5. бензонитрила. Реакцию гидролиза можно рассматривать как реакцию ацилирования воды, в которой вода выступает как нуклеофильный реагент, а реакция протекает как SN. Среди перечисленных субстратов данной реакции наибольшей ацилирующей способностью обладает уксусный ангидрид, так как имеет в этом ряду максимальный заряд в электрофильном центре и наиболее устойчивую уходящую группу.
39. Вступают в реакцию с гидроксиламином с образованием гидроксамовых кислот: +1. N-метиламид; +2. метилбутаноат; – 3. бутановая кислота; – 4. бензальдегид; +5. уксусный ангидрид. Являются функциональными производными карбоновых кислот. С гидроксиламином как нуклеофильным реагентом вступают в реакцию нуклеофильного замещения как субстраты по электрофильному центру. Результатом реакции является замещение уходящей группы Z на NHOH и образование функциональной группы гидроксамовой кислоты.
40. «Гидроксамовая проба» может быть использована для определения: – 1. карбоновых кислот; – 2. альдегидов; – 3. простых эфиров; +4. функциональных производных карбоновых кислот; – 5. кетонов. Только функциональные производные карбоновых кислот вступают в реакцию с гидроксиламином с образованием гидроксамовых кислот, которые образуют цветные комплексы с ионами Fe3+.
41. «Гидроксамовой пробой» можно определить: – 1.ацетальдегид; +2. метиловый эфир пропионовой кислоты; – 3. метилэтилкетон; +4. этанамид; +5. этилбутаноат. Являются функциональными производными карбоновых кислот и вступают в реакцию с гидроксиламином с образованием гидроксамовых кислот, которые образуют цветные комплексы с ионами Fe3+.
42. Щелочным гидролизом с идентификацией продукта реакции индикаторной бумагой у отверстия пробирки можно определить: +1. этанамид; +2. бензамид; – 3. этилацетат; – 4.N-фенилэтанамид; – 5. анизол (метилфениловый эфир). Являются незамещенными амидами. Вступают в реакцию щелочного гидролиза с выделением аммиака, который вызывает посинение влажной индикаторной бумаги (рН>7) у отверстия пробирки.
43. Декарбоксилируются при нагревании (100-200оС) кислоты: – 1. гексановая; – 2. глутаровая (пентандиовая); – 3. янтарная (бутандиовая); +4. малоновая (пропандиовая); +5. щавелевая (этандиовая). Являются a(5)- и β(4) – дикарбоновыми кислотами, в молекулах которых карбоксильные группы проявляют сильное электроноакцепторное влияние друг на друга, способствуя декарбоксилированию. С увеличением количества σ-связей между карбоксильными группами (2,3) их индуктивный эффект сильно затухает, снижая способность к декарбоксилированию. Декарбоксилирование β-дикарбоновых кислот облегчается так же вследствие их способности к образованию 6-членного переходного состояния, в котором происходит перенос протона с одновременными разрушением С1-С2-связи и промежуточным образованием енола:
44. Образуют циклические ангидриды при нагревании кислоты: – 1. гексановая; +2. глутаровая (пентандиовая); +3. янтарная (бутандиовая); – 4. малоновая (пропандиовая); – 5. щавелевая (этандиовая). Относительное положение двух карбоксильных групп на углеродном скелете молекул данных дикарбоновых кислот позволяет образовывать термодинамически устойчивые 5- и 6-членные циклы.
45. И субстратом и реагентом является сложный эфир в реакции: – 1. переэтерификации; – 2. гидролиза; +3. сложноэфирной конденсации; – 4. аммонолиза; – 5. «гидроксамовой пробы». Только в реакцию сложноэфирной конденсации среди прочих реакций нуклеофильного замещения вступает 2 молекулы сложного эфира. Одна является обычным субстратом по электрофильному центру, вторая - реагентом. Нуклеофильная частица (карбанион) образуется из реагента в результате депротонирования его a-СН-кислотного центра под действием сильного основания.
46. Реакция сложноэфирной конденсации протекает с участием реакционных центров в молекуле сложного эфира: – 1. только электрофильного; +2. электрофильного в субстрате и a-СН-кислотного в реагенте; – 3. ОН-кислотного; – 4. основного; – 5. NH-кислотного. В реакцию сложноэфирной конденсации вступают 2-молекулы сложного эфира: одна – как субстрат по электрофильному центру, вторая – как реагент. При депротонировании a-СН-кислотного центра реагента под действием сильного основания образуется нуклеофильный реакционный центр (карбанион).
47. Продукт сложноэфирной конденсации следует классифицировать как: – 1. только сложный эфир; – 2. кетон и карбоновая кислота; – 3. только кетон; +4. кетон и сложный эфир; +5. сложный эфир β-оксокарбоновой кислоты. Реакция сложноэфирной конденсации протекает как нуклеофильное замещение между двумя молекулами сложного эфира. Одна из них вступает как субстрат по электрофильному центру. Из второй молекулы сложного эфира образуется нуклеофильный реагент депротонированием ее a-СН-кислотного центра. В результате реакции алкокси-группа в COOR- группе субстрата замещается на –CHR-COOR группу реагента. Продукт реакции по β-оксо-группе относится к классу кетонов, по COOR группе – к классу сложных эфиров, иначе – к классу сложных эфиров β-оксокарбоновых кислот.
48. На основе малонового эфира (МЭ) синтезируют: +1. монокарбоновые кислоты с заданным строением углеводородного радикала; – 2. a-метилкетоны с заданным строением второго углеводородного радикала; – 3. простые эфиры; +4. производные пиримидина; – 5. нет правильного варианта ответа. Монокарбоновую кислоту с заданным строением углеводородного радикала получают по следующей схеме:
Производные пиримидина синтезируют реакцией нуклеофильного замещения между малоновым или алкилмалоновым эфиром и мочевиной.
49. На основе малонового эфира можно синтезировать: +1. масляную (бутановую) кислоту; +2. изовалериановую (3-метилбутановую) кислоту; – 3. метилэтилкетон; – 4. диэтиловый эфир; +5. барбитуровую кислоту. Масляную (а) и изовалериановую (б) кислоты синтезируют на основе малонового эфира по схеме:
Барбитуровую кислоту синтезируют реакцией нуклеофильного замещения между малоновым эфиром как электрофильным субстратом с мочевиной как нуклеофильным реагентом.
50. Для строения функциональной группы амидов характерны: +1. Значительная делокализация неподеленной пары атома N в сторону оксо-группы; – 2. малая прочность связи С-N; +3. частично-двойной характер связи С-N; +4. преимущественно плоская конфигурация; – 5. свободное вращение вокруг связи С-N. Данные особенности связаны с электронным строение амидной группы. Атомы С и О – sp2- гибридны, атом N имеет преимущественно sp2- гибридное состояние и пиррольное строение, поэтому у амидной группы преимущественно плоская конфигурация. Такое строение обуславливает р, π-сопряжени р-орбитали атома N с π-связью оксо-группы. Вследствие этого неподеленная пара атома N значительно делокализована по сопряженной системе в сторону оксо-группы и связь С-N частично двойная. Частично двойной характер связи С-N повышает ее прочность, а сопряжение препятствует свободному вращению вокруг связи С-N.
51. Амиды карбоновых кислот вступают в реакции: – 1. декарбоксилирования; +2. образования солей с сильными основаниями или сильными кислотами; +3. гидролиза как в кислой, так и в щелочной среде; +4. амидо-иминольной таутомерии; – 5. цикло-оксотаутомерии. Амиды карбоновых кислот вступают в реакции с сильными основаниями и сильными кислотами, так как имеют основный на пиридиновом атоме кислорода и NH-кислотный реакционные центры. Вследствие амфотерности для них характерна амидо-иминольная таутомерия. Амиды вступают в реакции гидролиза как в кислой, так и в щелочной среде, так как имеют электрофильный реакционный центр, способный к реакциям нуклеофильного замещения с такими нуклеофильными реагентами как H2O/HÅ и ОН-.
52. Этанамид вступает в реакции: – 1. декарбоксилирования; +2. образования солей с сильными основаниями или сильными кислотами; +3. гидролиза как в кислой, так и в щелочной среде; +4. амидо-иминольной таутомерии; – 5. цикло-оксотаутомерии. Этанамид вступает в реакции с сильными основаниями и сильными кислотами, а также амидо-иминольной таутомерии внутри амидной группы, так как имеет в этой группе основный центр на пиридиновом атоме кислорода и NH-кислотный центр. Вступает в реакции гидролиза как в кислой так и в щелочной среде, так как имеет электрофильный центр в амидной группе, способный к реакциям SN с такими нуклеофильными реагентами, как H2O/HÅ и ОН-.
53. Фенолфталеин имеют малиновое окрашивание в условиях: – 1. рН < 7; – 2. рН = 7; +3. рН = 8-10; – 4. рН > 10; – 5. сильнощелочная среда. В щелочной среде при рН 8-10 образуется динатриевая соль фенолфталеина. Соль имеет сопряженный хромофор с длинной цепью сопряжения, обуславливающий малиновое окрашивание. В сильнощелочной среде при рН>10 образуется тринатриевая соль фенолфталеина, которая не имеет окрашивающего хромофора и поэтому бесцветна. Не имеет окрашивающих хромофоров исходная молекула фенолфталеина при рН < 7 и рН = 7.
54. Малиновое окрашивание фенолфталеина обуславливает его: – 1. электронейтральная молекула; – 2. мононатриевая соль; +3. динатриевая соль; – 4. тринатриевая соль; – 5. нет правильного ответа. Динатриевая соль фенолфталеина, в отличие от других состояний, имеет сопряженный хромофор с длинной цепью сопряжения, который обуславливает малиновое окрашивание.
55. Все карбоновые кислоты имеют характеристические группы: +. С = О; – 2. S – Н; – 3. N – H; +. О – Н; – 5. С = С. Характеристические группы С = О и О – Н образуют функциональную карбоксильную группу карбоновых кислот.
56. Все функциональные производные (кроме нитрилов) карбоновых кислот имеют характеристическую группу: + С = О; – 2. N – Н; – 3. О – Н; – 4. S – Н; – 5. С – О – С. Характеристическая группа С = О является общей для функциональных групп (кроме нитрилов) функциональных производных карбоновых кислот.
57. Валентные колебания группы С = О в ИК-спектре карбоновых кислот лежат в диапазоне: – 1. 3550 – 3200; – 2. 2962 – 2926; – 3. 2265 – 2210; – 4. 1150 – 1085; +. 1725 – 1680. Среди перечисленных диапазонов характеристических частот только 1725 – 1680 см -1 лежат внутри диапазона валентных колебаний двойных связей.
58. Валентные колебания группы ОН в ИК-спектре карбоновых кислот лежат в диапазоне: – 1. 3550 – 3200; +. 2700 – 2500; – 3. 2265 – 2210; – 4. 1725 – 1680; – 5. 1150 – 1085. Среди перечисленных диапазонов характеристических частот 2700-2500 см-1 лежат внутри диапазона валентных колебаний связей Н-Х ~ 4000-2500 см-1. Частота валентных колебаний увеличивается с повышением прочности связи. Поскольку электроноакцепторное влияние оксогруппы увеличивает полярность связи О-Н и поэтому подвижность протона в карбоновых кислотах по сравнению со спиртами и фенолами, частота валентных колебаний ее снижается до диапазона 2700-2500 см-1.
59. Большинство незамещенных амидов имеют характеристические группы: +. С = О; +. N – Н; – 3. О – Н; +. С – Н; – 5. С – О – С. Характеристические группы С = О и N – Н относятся к амидной группе, а С – Н к углеводородному радикалу большинства незамещенных амидов (кроме формамида и амида трихлоруксусной кислоты).
60. Нитрилы имеют характеристическую группу: – 1. С = О; – 2. N – Н; +3. С º N; – 4. С – О – С; – 5. О – Н. Характеристическая группа С º N относится к функциональной группе нитрилов. В отличие от других функциональных производных карбоновых кислот нитрилы не имеют характеристической группы С = О.
61. Валентные колебания группы С º N в ИК-спектре нитрилов лежат в диапазоне: – 1. 3500 – 3400; – 2. 2962 – 2926; +3 2265 – 2210; – 4. 1725 – 1700; – 5. 1150 – 1085. Среди перечисленных диапазонов характеристических частот только 2265-2210 см-1 лежат внутри диапазона частот валентных колебаний тройных связей.
Дата добавления: 2015-11-26 | Просмотры: 2406 | Нарушение авторских прав |