|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
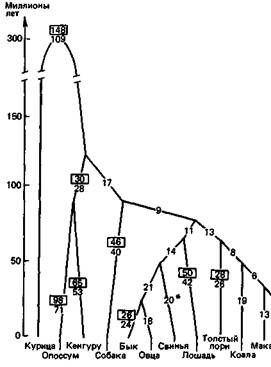
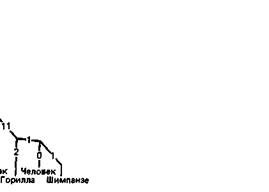
Эволюция человека.
Похожие схемы можно построить и для других белков, а также, объединив соответствующие данные, для совокупности всех известных белков. Они могут охватывать не только позвоночных, но и более широкий круг таксонов, включающий беспозвоночных и даже (при использовании таких универсальных белков, как гистоны или цитохром С) растения, грибы и микроорганизмы. Темпы эволюции разных белков. Можно провести сравнение числа мутаций, зафиксированных в разных белках при прохождении определенного числа этапов видообразования. Оказывается, что некоторые белки эволюционируют с гораздо большей скоростью, чем другие (табл. 7.4). Гистоны, например, удивительно стабильны, тогда как эволюция фибринопептидов шла очень быстро. Учитывая, что в ходе эволюции фиксируется лишь незначительная часть всех мутаций-приблизительно одна на 3,5 миллиона [1914], - мы можем без колебаний отвергнуть объяснение, связы- вающее различия в скорости эволюции с различиями в частотах возникновения мутаций; по-видимому, причину правильнее искать в функциях соответствующих белков. Например, функция фибринопептидов не является очень специфичной (они отщепляются в процессе превращения фибриногена в фибрин). Этим, возможно, и объясняется высокая скорость их эволюции. С другой стороны, конформация гистонов, очевидно, подвергается очень сильным ограничениям. Они вступают в тонкое пространственное взаимодействие с ДНК. Весьма вероятно, что эти белки выполняют какую-то критическую функцию, которая нарушается даже при небольших изменениях в их молекулах. Дупликации генов. Как отмечалось в разд. 4.3, молекула гемоглобина А (НbА) состоит из двух α- и двух ß-цепей; HbF вместо ß-цепей содержит γ-цепи, a HbA2δ-цепи. Во многих гомологичных сайтах цепей всех четырех типов находятся одинаковые аминокислоты. Наиболее очевидное Дата добавления: 2015-12-16 | Просмотры: 534 | Нарушение авторских прав |