|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Эволюция человека 19
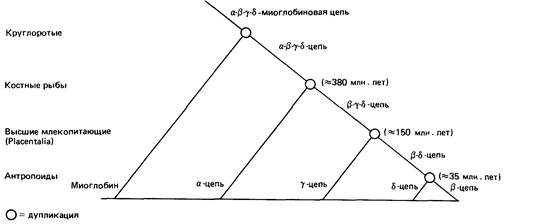
объяснение данного факта состоит в том, что все эти гены, а также ген цепи миоглобина, произошли от одной предковой последовательности. Для такой функциональной дифференциации требовалась дупликация этих генов. В результате одна из копий продолжала выступать в прежней роли, в то время как другая имела возможность приобрести новую функцию. На рис. 7.10 показаны этапы дуплицирования гемоглобиновых генов, приуроченные к стадиям эволюции и привязанные с известным приближением к временной шкале. Дупликации генетического материала - отдельных генов, коротких участков хромосом и генома в целом (полиплоидизация) - имеют ключевое значение для эволю- ции. В ходе эволюции млекопитающих полиплоидизация, по-видимому, уже не происходила [157]; в то же время небольшие дупликации и нехватки возникали довольно часто. Эволюция генов, кодирующих белковые домены. До сих пор мы рассматривали только изменения в аминокислотных последовательностях. Известно, однако, что белки имеют специфическую трехмерную структуру, которая обычно создается двумя или более расположенными друг за другом «доменами», т. е. последовательностями с молекулярной массой в 20000, свернутыми таким образом, что количество контактов внутри домена оказывается намного больше, чем между последовательностями разных доменов. При сравнении доменов из разных белков обнаружилось, что конформационное сходство распространено существенно шире, чем ожидалось на основании результатов сопоставления аминокислотных последовательностей. Белковые домены могут иметь очень похожие конформации и при отсутствии сходства в аминокислотных последовательностях. В ходе эволюции фиксация мутаций происходила только в том случае, если соответствующая аминокислотная замена не нарушала конформации белка [1979]. Согласно теоретическим расчетам, всего 200-500 доменов могли послужить основными единицами, из которых составлено громадное число различных белков, имеющихся у живых организмов. Как отмечалось в разд. 2.3.3, гены эукариот состоят из нескольких экзонов (экспрессируемых последовательностей ДНК), разделенных нитронами (неэкспрессируемыми последовательностями). Отдельные экзоны, по-видимому, часто содержат последовательности ДНК, кодирующие такой белковый домен. Например, можно показать, что ген фактора VIIIC (разд. 2.3.3.7) соответствует трем доменам, обозначаемым буквами А, В и С. Домен А состоит из 330 аминокислот, домен В-из 980, а домен С-из 150. Эти домены располагаются в порядке А1А2-В-АЗ-С1-С2. Домен А обнаруживает неожиданную, но «значительную гомологию с церулоплазмином» - медьсодержа-
щим белком сыворотки, который также имеет три домена А, но не содержит доменов В и С (см. разд. 2.3.7). Полезные или нейтральные мутации? Почему определенные аминокислоты в последовательности за длительный период замещаются другими? Существуют два возможных объяснения: либо эти замены приводят к усовершенствованию функциональных свойств молекулы, дающему ей селективное преимущество, либо мутации нейтральны или даже слабо вредны и фиксируются в результате генетического дрейфа или случайно (разд. 6.4). Последнее объяснение особенно ревностно отстаивает Кимура [1941; 1942]. Во введении к своей монографии [1941] Кимура пишет: «Теория нейтральности утверждает, что большинство эволюционных изменений на молекулярном уровне, выявляемых при сравнительном изучении аминокислотных последовательностей белков и нуклеотидных последовательностей ДНК, обусловлено не дарвиновским отбором, а случайным дрейфом селективно нейтральных или почти нейтральных мутаций. Эта теория не отрицает роли естественного отбора в определении направления адаптивной эволюции, однако она предполагает, что адаптивную природу имеет лишь незначительная часть эволюционных изменений первичной структуры ДНК, тогда как громадное боль-
шинство фенотипически «молчащих» замен нуклеотидов не оказывает никакого существенного влияния на выживание и воспроизведение... В теории нейтральности утверждается также, что большая часть внутривидовой изменчивости на молекулярном уровне, проявляющейся, например, в виде полиморфизма белков, нейтральна, и поэтому большинство полиморфных аллелей, имеющихся у какого-либо вида, поддерживается за счет мутационного процесса и случайной элиминации.... (Она) трактует полиморфизм белков и ДНК как переходную фазу молекулярной эволюции и отвергает представление, согласно которому большинство таких систем полиморфизма имеет адаптивное значение и в пределах вида поддерживается одной из форм балансирующего отбора». С другой стороны, Кимура проводит ясное различие между положительным (приспосабливающим) отбором, который, как он полагает, очень редко действует на молекулярном уровне, и отрицательным отбором, благодаря которому происходит элиминация большого числа вредных мутаций. Он даже дает оценку, согласно которой нейтральными (или слабо вредными) могут быть лишь» 10% всех новых мутаций;» 90% новых мутаций относятся к категории безусловно вредных и не имеют шансов зафиксироваться в популяции. Гипотеза «нейтральности» вызвала жаркие дискуссии среди генетиков-популяцио- Дата добавления: 2015-12-16 | Просмотры: 631 | Нарушение авторских прав |