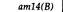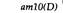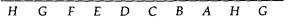|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Мутантные бактериофаги
Как уже говорилось в предыдущей главе, лишь немногие фаговые гены имеют мутации, изменяющие морфологию негативных колоний. С другой стороны, очевидно, что во всех существенных для размножения генах фага, могут происходить летальные мутации, делающие невозможным появление фагового потомства. Мутанты, не жизнеспособные
194 Организация и передача генетического материала
в одних условиях и развивающиеся нормально в других, называются условно летальными. Они могут быть размножены и исследованы. В генетике фагов важны два основных типа условно летальных мутантов. Первый тип - это температурочувствителъные мутанты (ts). Большинство фагов способно инфицировать хозяина и размножаться в широком интервале температур. Температурочувствительные мутанты многих фагов Е, coli способны размножаться при 30°С (пермиссивные условия), но теряют эту способность и обнаруживают свой мутантный фенотип при температуре 40-42°С (непермиссивные условия). При такой температуре негативные колонии не образуются. Известны также мутанты, чувствительные к холоду (сs). Появление температурной чувствительности почти всегда свидетельствует о том, что в каком-то участке ДНК, кодирующем некоторый белок, произошла мутация, повлекшая за собой аминокислотную замену. В результате белок становится нестабилен при непермиссивной температуре и утрачивает активность. Второй тип условно летальных мутантов - супрессорчувствительные мутанты (sus). Фаги с мутацией sus могут размножаться при инфицировании бактериальных клеток с геном супрессора Su +, т.е. в пермиссивных условиях, но не в состоянии размножаться при инфицировании клеток других штаммов, не содержащих гена супрессора (Su—), т. е. в непермиссивных условиях. Фаг дикого типа размножается в клетках обоих типов (табл. 7.1). Супрессорчувствительные мутации в отличие от мутаций специфичности к хозяину не влияют на способность фага адсорбироваться. Такой фаг нормально прикрепляется к поверхности бактерии, вводит в нее свою ДНК и даже может убить клетку-хозяина, но не способен к размножению. Существуют три класса супрессорчувствительных мутаций, amber(am), ochre (och) и οpal(οp). Здесь мы лишь упомянем о них как о генетических маркерах. Они могут затрагивать все гены, кодирующие синтез белков. Мутация нарушает синтез белка в клетках хозяина типа Su –, но не препятствует синтезу белка в клетках типа Su +. Биохимическую природу этих мутаций и механизм супрессии мы обсудим в гл. 12. После этого краткого обзора различных типов мутантных фагов вернемся к генетическому анализу фаговых мутаций. Это позволит нам понять организацию генома вирусов.
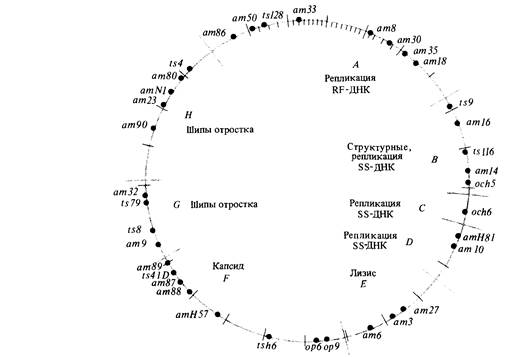
7. Геном вируса 195 Комплементационный анализ условно летальных мутаций фага Фаг фХ174-мелкий вирус, содержащий кольцевую одноцепочечную молекулу ДНК (рис. 7.3). После проникновения в клетку-хозяина синтезируется комплементарная цепь ДНК и образуется двухцепочечная молекула, которая затем в начале скрытого периода реплицируется по полуконсервативному механизму. После того как нарабатывается достаточное количество белков головки и начинается сборка фагов, ДНК начинает реплицироваться посредством видоизмененного сигма-механизма, при котором синтезируется только фаговая цепь, и в головку фагов включаются одноцепочечные кольцевые молекулы фаговой ДНК. Эта последовательность необходимых для размножения фага событий была расшифрована посредством генетического анализа. В таблице 7.2 перечислены 39 условно летальных мутаций фага фХ174; все они лишают фаг способности к размножению при инфицировании в непермиссивных условиях. Для того чтобы определить, влияют ли две независимо возникшие мутации на одну и ту же генетическую функцию или на разные, можно использовать комплементационный тест, описанный в предыдущей главе. Бактериальные клетки одновременно заражают фагами обоих мутантных типов при непермиссивных условиях, например при температуре 42°С, если оба мутанта чувствительны к температуре. Если в таких дважды инфицированных бактериальных клетках потомство фагов возникает, можно сделать вывод, что каждый фаг осуществляет функцию, которую не может осуществить другой (см. рис. 6.6). Такие две мутации называются комплементарными и относятся к разным генам. Выполняемый таким образом тест на комплементацию полностью аналогичен описанному в гл. 6 для мутантов эукариот. Возникает как бы «диплоидная» инфицированная клетка, в которой хромосома каждого фага несет по одной мутации, и наблюдается «диплоидный» фенотип, т. е. потомство фага либо возникает, либо нет. Заметим, что для выполнения теста на комплементацию нам не надо определять генотип фагового потомства. Комплементационный анализ перечисленных в табл. 7.2 мутантов показывает, что они относятся к восьми различным группам комплементации. Так, например, при заражении непермиссивных бактерий фагами am10 (цистрон D) и ат9 (цистрон G) их клетки лизируются, и, следовательно, потомство фагов возникает. Напротив, при заражении непермиссивного хозяина фага ат9 и ат32 потомство не возникает, и, следовательно, эти две мутации относятся к одной и той же группе комплементации (цистрон G). Если считать, что частота возникновения мутаций во всех генах примерно одинакова, то из факта, что в большинстве групп комплементации локализовано по нескольку мутаций, по-видимому, следует, что все эти мутации в совокупности затрагивают все важные гены фХ174. Другими словами, исследовано достаточное количество независимых мутаций для построения генетической карты. Далее мы увидим, что такое разделение на группы комплементации правильно отражает (за единственным исключением) механизм биохимического функционирования фага.
196 Организация и передача генетического материала
7. Геном вируса 197
Рекомбинационный анализ мутантов фага Когда фаги с различными мутантными генотипами заражают клетку, в которой они могут размножаться, то в потомстве обнаруживаются фаги как с родительскими, так и с рекомбинантными генотипами. Скрещивание между двумя различными ts-мутантами фага выполняют при пермиссивной температуре (30°С), а скрещивание между sus-мутантами фага -в клетках Su + -штамма. Суммарное число потомков всех генотипов определяют, высевая на чашки определенный объем культуры в пермиссивных условиях. Количество рекомбинантов дикого типа легко определить посевом такой же пробы в непермиссивных условиях, когда негативные колонии образуют лишь фаговые частицы дикого типа (см. рис. 6.2), точно так же, как это было с rII -мутантами фага Т4. Скрещивание фагов не вполне аналогично скрещиванию эукариотических организмов. Мы знаем, что при скрещивании двух эукариотических родителей 1) генетический вклад каждого родителя в потомство одинаков (это обеспечивается мейозом) и 2) если генетические маркеры не сцеплены, то в потомстве возникает равное число родительских и рекомбинантных генотипов. При скрещивании фагов, однако, относительный генетический вклад родителей в потомство, как было установлено, зависит от относительного числа родительских фагов каждого типа в данной инфицированной бактериальной клетке. Например, если отношение численностей родительских фагов с генотипами А и В равно А/В = 10/1, то часто обнаруживается, что число рекомбинантных потомков превосходит число потомков родительского типа В. При скрещивании фагов число родительских генотипов может быть больше двух. Если одна и та же клетка заражена фагами с тремя различными генотипами А, В и С, то в потомстве некоторые фаги будут обладать рекомбинантным генотипом ABC. Ясно, что динамика скрещивания фагов более сродни проблемам популяционной биологии, чем проблемам индивидуального скрещивания организмов, обладающих мейозом. Совокупность родительских геномов фагов, инфицирующих клетку, пред-
198 Организация и передача генетического материала
7. Геном вируса 199
* Приводимые значения х 10 4. + Только эти частоты рекомбинаций цистрона А использовались при построении рисунка 14.19. Числа в скобках означают количество повторностей независимого определения частоты рекомбинации; приводится среднее значение. По Benbow R.M. et. al. (1971). J. Virol, 7, 549.
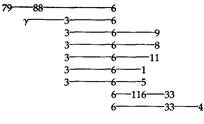
200 Организация и передача генетического материала ставляет собой популяцию-основателя. Эти геномы реплицируются и рекомбинируют с другими геномами, обладающими теми же или отличными генотипами. Рекомбинантные генотипы реплицируются наряду с родительскими, и при лизисе зараженной клетки освободившиеся фаговые частицы представляют собой выборку геномов из общего генофонда, содержащегося в клетке в момент упаковки ДНК в головки фагов. Кроме того, не все реплицирующиеся геномы родительского типа с равной вероятностью рекомбинируют с геномами других родительских типов. Например, такая ситуация имеет место, если фаг с генотипом А исходно адсорбировался на одном конце длинной бактерии, а фаг с генотипом В - на другом. Исключение некоторых геномов из фонда скрещивания приводит к низкой отрицательной интерференции (с несколько больше 1), наблюдаемой в большинстве скрещиваний между фагами. Причина этого явления состоит в том, что геномы, входящие в фонд скрещивания, т.е. уже участвовавшие в одном акте рекомбинации, имеют больший шанс принять участие и во втором рекомбинационном событии по сравнению с произвольным геномом, который может вовсе не входить в фонд скрещивания. Хотя механизмы скрещивания у фагов и у эукариотических организмов различны, тем не менее понятия, используемые в генетике эукариот, могут быть применены и к скрещиванию между фагами. Для этого необходимо контролировать проникновение фаговых частиц каждого из двух родительских генотипов в инфицированные клетки и время, отводимое на репликацию и рекомбинацию. Когда эти два фактора контролируются, то есть скрещивание осуществляется в определенных стандартных условиях, то можно определить сцепление между генетическими маркерами и оценить частоту рекомбинации, что позволяет строить генетические карты. Отношения между перечисленными в табл. 7.2 мутациями фага фХ174 анализировали посредством двухфакторных и трехфакторных скрещиваний. Двухфакторные скрещивания между супрессорчувствительными мутантами осуществляли следующим образом: культуру бактерий Su+ заражали двумя мутантными штаммами фага с высокой множественностью (по 5 фаговых частиц каждого типа на бактериальную клетку). Использование такой множественности дает нам уверенность в том, что все клетки инфицируются обоими фагами. После лизиса бактерий по числу негативных колоний на индикаторной культуре, обладающей соответствующими Su+ -генами, определяли общее число фагов в потомстве. При скрещивании фаговых мутантов susamber в качестве хозяина использовали штамм Su+amber;при скрещивании между susamber- и sus ораl-мутантами или между susamber и susochre индикатором служил бактериальный штамм с обоими генами Su +. Число рекомбинантов дикого типа, возникающих при скрещивании, определяли по числу негативных колоний на индикаторной культуре Su –, на которой могли размножаться только фаги дикого типа. Частоты рекомбинации, обнаруженные при скрещивании между этими мутантами фага фХ174, представлены в табл. 7.3. Для того чтобы определить, в каком порядке расположены описанные мутации на генетической карте, использовали трехфакторные скрещивания. При этом применялся метод, несколько отличный от описанного для трехфакторных скрещиваний в гл. 5, поскольку в этом случае было необходимо отбирать рекомбинантов дикого типа по двум
7. Геном вируса 201
маркерам. В описанной ранее ситуации никакого отбора в потомстве не производилось и могли наблюдаться все восемь возможных комбинаций генотипов. Рассмотрим изображенное на рис. 7.4 скрещивание amAtsC x атВ. Если атА и атВ сцеплены друг с другом теснее, чем каждый из них с tsC, что устанавливается в двухфакторных скрещиваниях, то tsC используют в качестве неселектируемого маркера при анализе потомства от скрещивания на Su-индикаторе при пермиссивной температуре. Потомки дикого типа в отношении аллелей amber будут формировать негативные колонии независимо от того, содержит их генотип tsC или соответствующий аллель дикого типа. Доля фагов, несущих аллели tsC и tsC + среди рекомбинантов, позволяет различить последовательности генов amAamBtsC и tsCamAamB. Если в потомстве представлен преимущественно дикий тип, значит, гены расположены в последовательности tsCamAamB. Если же большинство составляют температурочувствительные фаги, значит, порядок расположения генов на карте amAamBtsC. Последовательность, установленная таким скре-
202 Организация и передача генетического материала Таблица 7.4. Частоты рекомбинации, наблюдаемые при трехфакторных скрещиваниях мутантов фХ174*
7. Геном вируса 203
* Приводимые значения х 10 4. + Это означает, что при скрещивании было получено всего несколько потомков. По BenbowR.M. et. al. 1971. J. Virol., 7, 549.
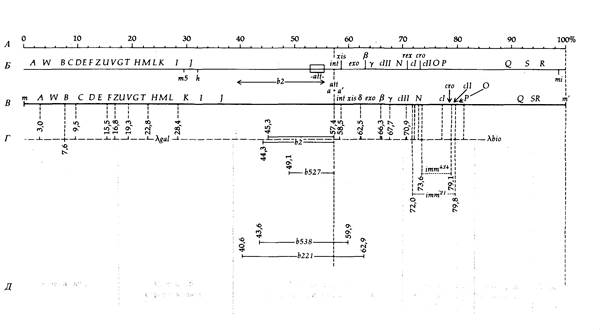
204 Организация и передача генетического материала щиванием, проверяется затем в реципрокном скрещивании (рис. 7.4). Результаты этих трехфакторных скрещиваний представлены в табл. 7.4. Приводимые в табл. 7.3 и 7.4 данные однозначно свидетельствуют о том, что генетическая карта фага фХ174 имеет форму кольца. Заметим, например, что ген Я тесно сцеплен как с геном G, так и с геном А. Аналогичным образом каждый ген тесно сцеплен с двумя соседними, расположенными по обе стороны от него, и поэтому единственно возможная форма карты-кольцевая. Карта, изображенная на рис. 7.5, отражает тот факт, что геном фага фХ174 представляет собой кольцевую молекулу ДНК. На карте видно, что некомплементирующие мутации локализованы в смежных участках генома. Это означает, что функциональные единицы, выявляемые с помощью комплементационного теста, совпадают со структурными единицами генома. Границы между генами на карте указаны произвольно, поскольку использовавшиеся при построении карты мутации не позволяют точно локализовать эти границы. Исследования различных нарушений процесса размножения у конкретных мутантов в непермиссивных условиях позволяют приписать каждому цистрону определенную функцию, как это указано на рис. 7.5. Геном фага фХ174 представляет собой одноцепочечную кольцевую молекулу ДНК, содержащую 5386 нуклеотидов. Эта нуклеотидная последовательность была успешно расшифрована в 1977 г. Фредериком Сэнгером и его коллегами. Соотношение между генетической картой, изображенной на рис. 7.5, и химической картой будет обсуждаться в гл. 12. Умеренный бактериофаг λ Исследования умеренного бактериофага λ внесли важный вклад в генетику. Фаг λ содержит линейную молекулу ДНК длиной примерно 49 000 н. п., то есть почти в 10 раз более длинную, чем геном фага фХ174. Фаг λ представляет большой интерес, поскольку его генетические регуляторные механизмы довольно сложны. Когда чувствительную бактериальную клетку заражают умеренным бактериофагом, например фагом λ (рис. 7.6), возможны два варианта дальнейших событий. В первом случае фаг реплицируется, производит множество потомков и разрушает клетку. Во втором случае фаговая инфекция приводит к лизогенизации клетки, при этом фаг встраивается в бактериальную хромосому и превращается в пассивный участок бактериального генома. В таком состоянии фаг представляет собой профаг или провирус, реплицирующийся лишь как часть генома хозяина и в таком виде попадающий в дочерние клетки. При этом многие гены фага, потенциально летальные для клетки-хозяина, находятся в неактивном состоянии, или репрессированы. Однако иногда фаг может индуцироваться, переводя клетку на путь лизиса; клетка погибает, высвобождая многочисленное потомство фага (рис. 7.6). Таким образом, фаг λ служит моделью генетической системы вирус-хозяин. Изучение его функционирования послужило основой для современных представлений об опухолеродных вирусах млекопитающих, способных встраиваться в геном, таких как вирус полиомы и SV40. В этой главе мы рассмотрим различные типы
7. Геном вируса 205
мутаций, обнаруженные у фага λ, а также генетическую и физическую карты его генома. Экспрессия и регуляция генома фага λ будут подробно рассмотрены в гл. 15. Гены фага λ Для идентификации мутантов фага λ, так же как и других бактериофагов, анализируют негативные колонии (бляшки). Гены фага λ можно разбить на две группы: существенные для формирования негативных колоний (обозначаются прописными буквами) и несущественные (обозначаются строчными буквами или буквами греческого алфавита). Существенные гены идентифицируются с помощью условно летальных мутаций: либо sus, либо ts, как уже обсуждалось выше. Комплемента-
206 Организация и передача генетического материала
ционный анализ этих мутаций показал, что они локализованы в 25 различных цистронах. Семь цистронов отвечают за формирование нормальной головки фага, семь других - за формирование нормального хвостового отростка. Эти гены либо кодируют структурные белки, входящие в состав фага, либо необходимы для правильной сборки фаговых частиц. Два гена обеспечивают лизис клетки и высвобождение потомства фага. Еще два гена необходимы для репликации ДНК фага λ, остальные три гена играют важную регуляторную роль. Несущественные гены идентифицируются по морфологии негативных колоний или при делециях участков генома, в которых они локализованы. Фаги λ дикого типа при посеве на восприимчивого хозяина образуют мутные негативные колонии, поскольку некоторые из инфицированных клеток становятся лизогенными. Клетки, содержащие профаг λ, иммунны по отношению к заражению фагом λ и поэтому размножаются внутри негативной колонии, делая ее мутной. Некоторые мутации (clear, с) придают фагу способность формировать прозрачные бляшки. Эти мутанты не способны к лизогенизации, и инфицированная ими клетка всегда разрушается. Мутации clear обнаружены в четырех раз-
7. Геном вируса 207
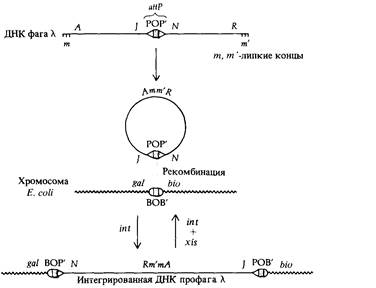
208 Организация и передача генетического материала личных генах: cI, cII, cIII и су. Другие несущественные гены идентифицируются по мутантным фагам, которые имеют крупную делецию, но тем не менее способны формировать негативные колонии. Делеции в фаге λ обнаружить легко, поскольку несущие делеции фаги содержат в головке меньше ДНК по сравнению с нормальными, а следовательно, их ДНК характеризуются иной плотностью, что выявляется при центрифугировании в градиенте хлористого цезия. Такие мутации с измененной плотностью ДНК обозначаются буквой Ь. Фаговая частица может утратить до 22% ДНК из середины молекулы, не утрачивая способности формировать негативные колонии. Однако фаги с такими делециями не способны к лизогении или генетической рекомбинации, поскольку у них все же нарушены некоторые функции. На рис. 7.7 изображена генетическая карта, построенная по данным о частоте рекомбинаций между мутациями, затрагивающими размножение фагов. Замечательная особенность этой карты в том, что гены, ответственные за осуществление родственных физиологических функций, сгруппированы вместе (гены формирования головки, формирования хвостового отростка, гены, ответственные за лизис). Другая важная особенность генетической карты фага λ — это ее линейность: выделенная из фаговых частиц λ ДНК имеет форму линейных двухцепочечных молекул. Профаг λ Мутантные гены, содержащиеся в профаге λ и встроенные в бактериальный геном, можно картировать, используя описанные в следующих главах методы генетики бактерий. Такие исследования показали, что профаг λ встраивается в геном Е. coli между генами gal и bio, контролирующими потребление сахара галактозы и синтез витамина биотина соответственно. Последовательность генов на генетической карте профага сравнивали с соответствующей последовательностью на генетической карте фага (рис. 7.8). Они, как ни странно, не тождественны: любая из них получается из другой посредством циклической перестановки. Это различие в последовательности генов возникает из-за механизма, с помощью которого λ-ДНК встраивается в бактериальную хромосому. Линейная молекула ДНК фага λ имеет комплементарные одноцепочечные концы, состоящие из 12 нуклеотидов. После проникновения в клетку бактерии-хозяина эти «липкие» концы сшиваются ДНК-лигазой и образуется кольцевая молекула. Кольцевая молекула ДНК фага λ может затем встроиться в бактериальную хромосому при участии фагового гена int, кодирующего белок, который катализирует сайт-специфическую рекомбинацию между участком прикрепления ДНК фага к хромосоме бактерии (attP) и соответствующим бактериальным сайтом (attB или attλ). При этом хромосома λ разрывается в attP-сайте, который локализован в середине генетической карты фага, и в результате происходит изменение последовательности генов в профаге, как это показано на рис. 7.8. После внедрения в бактериальную хромосому все гены λ, кроме двух, перестают работать (инактивируются) и оказываются под контро-
7. Геном вируса 209
лем репрессора - белка, кодируемого геном cI. Наличие репрессора создает у Е. coli (λ) иммунитет к инфицированию другими фагами λ. Προфаг λ реплицируется как часть родительской хромосомы и наследуется дочерними клетками. В популяции лизогенных бактерий примерно 1 из 106 клеток в каждом поколении вследствие спонтанной индукции профага лизируется и освобождает многочисленное потомство фагов λ (рис. 7.6). Такая способность бактериальной культуры с профагом спонтанно продуцировать фаг объясняет происхождение термина лизогения. Причины спонтанной индукции не ясны, однако известно, что нарушение способности клетки-хозяина реплицировать собственную ДНК может вызвать индукцию. Так, например, ультрафиолетовое облучение индуцирует большинство содержащих профаг клеток культуры. Описаны температурочувствительные мутации сI -гена, вызывающие индукцию при повышенной температуре. Эти мутации дают удобный экспериментальный метод изучения последовательных этапов индукции. Первое событие, связанное с индукцией, - выход профага из хромосомы. Механизм этого процесса аналогичен механизму включения профага. Выход из хромосомы контролируется двумя генами фага λ, int и xis; результатом является образование кольцевого генома λ, который начинает реплицироваться посредством θ-механизма и продуцирует множество дочерних геномов. Впоследствии механизм репликации ДНК меняется на σ-тип. Образующиеся при этом линейные геномы фага инкапсулируются в белковую головку (см. гл. 4). Профаг λ почти всегда вырезается из хромосомы бактерии точно по своим границам, образуя кольцевую форму интактного генома λ. Иногда, однако, вырезание происходит неточно, что приводит к образованию кольцевой молекулы ДНК, в которой один из концевых участков генома профага утрачен, а вместо него включен участок хромосомы Е. coli, смежный с другим концом генома профага (рис. 7.9). Такие гибридные молекулы могут продуцировать новые жизнеспособные фа-
210 Организация и передача генетического материала
говые частицы лишь в том случае, если не утрачены какие-либо существенные гены генома λ. Те молекулы, в которые попадает ген bio E, coli (λ bio), жизнеспособны, так как в них обычно отсутствуют лишь несущественные гены между attP и геном N. Напротив, молекулы, в которые попадает ген gal E. coli обычно неполноценны в результате утраты существенных генов, локализованных между attP и левым концом хромосомы. Если какие-либо существенные гены утрачены и фаг не способен формировать негативные колонии, его называют дефектным и в название такого фага вносится буква d: λdgal. Фаги λdgal или λdbio (в случае, если утрачен существенный ген N) способны размножаться в присутствии нормального фага λ, компенсирующего функции, нарушенные у этих фагов. Фаги λdgal и λbio легко выявить благодаря их способности трансдуцировать гены gal+ и bio+ в gаl– или bio– бактерии. Эти трансдуцирующие фаги также могут лизогенизировать клетки E. coli (λdgal). Размер замещенного участка в геноме λ конкретных фаговых штаммов λdgal или λbio можно оценить с помощью комплементационного и рекомбинационного тестов. Например, фаг λdgal можно испытывать на способность либо образовывать рекомбинанты дикого типа в скрещиваниях со множеством различных мутантных линий фага, либо комплементировать с известными мутантами при смешанном инфицировании. В табл. 7.5 представлены данные о наличии или отсутствии рекомбинантов дикого типа при скрещивании нескольких фагов λdgal с носителями определенных sus-мутаций в различных цистронах. Если в данном штамме λdgal отсутствует соответствующий ген дикого типа, то рекомбинанты дикого типа не образуются. Эти данные позволяют определить положение левого конца, встроенного в геном λ участка гена gal относительно мутаций sus на генетической карте, как это изображено на
7. Геном вируса 211
рис. 7.10. Правый конец этого участка всегда совпадает с сайтом интеграции attP. После того как получен набор λdgαl фагов с картированными левыми концами, уже легко оказывается определить положение неизвестных точечных мутаций относительно этих концов: требуется лишь узнать, образуются ли рекомбинанты дикого типа между неизвестным мутантом и фагом соответствующей линии λdgαl. Эта методика аналогична методике картирования rII -мутаций с помощью делеций (см. гл. 6). Дата добавления: 2015-12-16 | Просмотры: 1218 | Нарушение авторских прав |


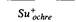
 Х174
Х174







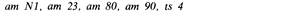
 Х174
Х174