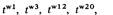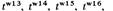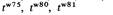|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Комплементационный анализ у высших эукариотС гетероаллельностью у высших эукариот мы впервые столкнулись в гл. 2 при обсуждении доминантности или рецессивности аллелей гена, определяющего окраску меха у кроликов. Комплементационный тест позволяет анализировать мутации, затрагивающие сложные фенотипы высших организмов. Рассмотрим две рецессивные мутации томатов: dwarf (d) (карликовость) и pubescent (p) (опушенность плодов). Нормальному фенотипу соответствует высокое растение с гладкими плодами. Являются ли эти мутации аллелями одного гена? A priori можно было предположить, что у этих двух мутантов затронуты различные генетические и физиологические функции. Для того чтобы определить, затрагивают ли d и ρ одну и ту же генетическую функцию, можно использовать комплементационный тест. При скрещивании гомозигот р/р с гомозиготами d/d потомство обладает нормальным фенотипом. Каждая родительская гамета привносит в зиготу один нормальный ген и один поврежденный. Генотип потомства должен иметь формулу dp + / /d+ р. Как мы и предположили вначале, d + и ρ+ - различные гены. В качестве другого примера рассмотрим две независимые рецессивные мутации дрозофилы, обнаруженные разными генетиками и названные raspberry (ras) и prune (pn) соответственно. Обе мутации сцеплены с полом и в гемизиготном и гомозиготном состоянии дают практически одинаковый фенотип: глаза темно-рубинового цвета. Для того чтобы определить, не тождественны ли эти мутации, можно использовать тест на комплементацию. При скрещивании самок ras/ras с самцами pn/Y yдочерей глаза были дикого типа. Следовательно, эти две мутации должны затрагивать различные генетические функции. Хромосома с мутацией ras одновременно может быть носителем аллеля рп +, а хромосома с мутацией рп - носителем аллеля ras +, поэтому в F 1
6. Тонкая структура гена 177
самки имеют генотип рп + / + ras, и эти две мутации могут быть названы комплементарными. Напротив, сцепленные с полом рецессивные мутации white (w), apricot (a), coffee (cf) и buff(bf), также влияющие на цвет глаз, в гомозиготном и гемизиготном состоянии проявляются по-разному. При этом у самок, гетерозиготных по любой паре из этих мутаций, цвет глаз отличается от дикого типа. Следовательно, каждая из этих мутаций должна затрагивать одну и ту же генетическую функцию, но по-разному. Другими словами, эти мутации не комплементарны друг другу, т.е. являются аллелями одного гена (гена white), и поэтому для их обозначения используются символы wa, wcf и wbf. Эти различные мутации гена w + могут служить примером множественного аллелизма (см. гл. 2). Рекомбинационное исследование этих мутаций мы обсудим в следующем разделе. Тест на комплементарность особенно удобен при анализе рецессивных летальных мутаций. Комплементационный анализ оказался решающим методом при исследовании мутаций локуса Т у мыши, поскольку многие из мутаций этого локуса подавляют рекомбинацию в участке хромосомы, в котором они находятся, делая таким образом рекомбинационный анализ невозможным. Доминантная мутация, называемая Brachyrury (Т), возникает спонтанно в лабораторных линиях и легко выявляется, поскольку гетерозиготные мыши (Т/ +) имеют короткий хвост. Гомозиготы (Т/Т) погибают на эмбриональной стадии развития. Вскоре после открытия этой мутации обнаружилось, что некоторые линии, обладающие близким к дикому типу фенотипом, являются носителями рецессивных мутаций, обозначенных буквой t. При скрещивании таких линий с гетерозиготами Т/ + потомство получается бесхвостым (рис. 6.13). Эти t-мутации представляют собой рецессивные летали (рис. 6.14). Изображенное на рисунке скрещивание дает чистую линию T/t, поскольку, во-первых, лишь мыши с этим генотипом выжи-
178 Организация и передача генетического материала
вают и способны давать потомство в следующем поколении, а, вовторых, t-мутации обычно «запирают» рекомбинацию, и этот генотип сохраняется из поколения в поколение. Чистые линии такого типа называются сбалансированными леталями и, с точки зрения генетика, очень удобны, поскольку, для того чтобы сохранить две мутации для будущих исследований, нет необходимости производить отбор в каждом поколении.
6. Тонкая структура гена 179 В географически сильно разобщенных природных популяциях мышей было обнаружено большое число t-мутаций. Комплементационный анализ рецессивных летальных t-мутаций, проводимый путем скрещивания различных сбалансированных линий (рис. 6.14), показал, что в некоторых комбинациях потомство жизнеспособно и обладает нормальными хвостами, в других гибнет на эмбриональной стадии. Известные летальные t-мутации распадаются на шесть групп комплементации (табл. 6.3). Гетерозиготные комбинации мутаций, относящихся к одной группе комплементации, летальны, тогда как двойные гетерозиготы по рецессивным леталям, относящимся к разным группам комплементации, жизнеспособны. Рекомбинационный анализ Картирование тонкой структуры гетероаллелей у высших эукариотических организмов выполнялось почти исключительно на D. melanogaster. Популярность этого генетического объекта объясняется легкостью культивирования мух и малой продолжительностью генерации. Выявление кроссинговера между гетероаллелями требует постановки тысяч скрещиваний и определения генотипов потомков, а это очень длительная и трудоемкая процедура. В некоторых случаях для выявления редких рекомбинантов может использоваться методика химического отбора, и тогда разрешающая способность рекомбинационного анализа приближается к достигаемой при использовании условно летальных систем у микроорганизмов. Наиболее детально исследован у дрозофилы цистрон rosy (ry) - структурный ген, ответственный за синтез фермента ксантиндегидрогеназы (КДГ). Мухи, у которых этот фермент не работает (нуль-активные мутанты), легко определяются по красновато-коричневому цвету глаз, возникающему из-за отсутствия пигмента изоксантоптерина. Личинки, у которых отсутствует КДГ, очень чувствительны также к отравляющему действию пурина, при добавлении его в корм (рис. 6.15). Таким образом, использование корма, содержащего пурин, может служить способом выделения редких рекомбинантов дикого типа при скрещиваниях носителей различных КДГ нуль-гетероаллелей. Самки, гетерозиготные по двум гетероаллелям rosy (ryx/ryy), в большом количестве скрещиваются с самцами, гетерозиготными по двум другим гетероаллелям этого гена (rуA/rуB). Поскольку у самцов D. melanogaster рекомбинация не происходит, то гетерозиготы дикого типа в потомстве могут появляться лишь в результате рекомбинации между r ух и rуу и обладать одним из двух возможных генотипов: r у + /rуА или ry + /ryB. Активность КДГ у личинок, гетерозиготных по ry+, достаточна для того, чтобы позволить им потреблять корм, содержащий пурин, без риска для жизни. Все остальное потомство, гетерозиготное по различным гетероаллелям rosy, погибает от пурина, добавляемого в пробирки с яичками сразу после того, как из этих пробирок удаляют родителей. Типичный эксперимент по выделению рекомбинантов дикого типа ставится сразу на не-
180 Организация и передача генетического материала
скольких сотнях содержащих пурин пробирках. Суммарную численность погибшего потомства можно оценить, оставив одну-две пробирки без пурина и подсчитав число мух в них. Полученная таким образом карта тонкой структуры КДГ-нуль-мутантов представлена на рис. 6.16. На карте, кроме того, указано положение нескольких чувствительных к пурину мутантов с низкой активностью КДГ, но с цветом глаз дикого типа. Изображено также положение нескольких электрофоретических вариантов фермента КДГ с измененной последовательностью аминокислот, но сохраняющих ферментативную активность. Положение на карте точек (сайтов), соответствующих различным электрофоретическим вариантам, нельзя определить непосредственно, используя корм, содержащий пурин, поскольку все эти варианты обладают ферментативной активностью. Сначала получают КДГ-нуль-мутанты соответствующих вариантов этих генов, выделяя их по красновато-коричневому цвету глаз. Сайты этих нуль-мутаций различны для различных электрофоретических вариантов. Затем эти сайты используются как неселективные маркеры при скрещивании нуль-мутантов для выделения rу +-рекомбинантов. Молекула КДГ состоит из двух одинаковых полипептидных единиц по 160 000 дальтон каждая. Для кодирования полипептида такой длины требуется молекула ДНК, содержащая около 4500 пар нуклеотидов. Если предположить, что мутанты КДГ определяют общую длину соответствующего структурного гена (0,005 сМ), то 0,01 сМ = 9000 нуклеотидным парам (н. п.) ДНК. С другой стороны, эухроматиновая часть гаплоидного генома дрозофилы, в которую попадает подавляющее большинство всех картируемых генов, содержит примерно 1,5·108 н.п. при длине 275 сМ;
6. Тонкая структура гена 181
следовательно, 0,01 cM = 5400 н. п. ДНК. Близость этих двух независимых оценок соотношения между масштабной единицей генетической карты и структурой ДНК свидетельствует о том, что разрешающая способность генетического анализа тонкой структуры гена у дрозофилы сравнима с достигаемой в генетике фагов и микроорганизмов. Анализ тонкой структуры проведен для многих других генов дрозофилы даже в отсутствие специальных систем отбора, аналогичных пуриновой. Наиболее известен ген белоглазия (white), многочисленные мутации которого обусловливают различный цвет глаз в гомозиготном состоянии и в гетерозиготах с различными сочетаниями мутантных аллелей. Впервые описанный Морганом аллель w1 необычен тем, что дает совершенно белые глаза. Некоторые из мутантных аллелей white перечислены в табл. 6.4. Рекомбинационный анализ мутантов, представленных в табл. 6.4, позволил построить карту тонкой структуры, изображенную на рис. 6.17. Построение этой карты потребовало визуального определения фенотипа миллионов мух в потомстве от различных типов скрещивания. Картированные аллели локализуются в восьми различных сайтах, способных к рекомбинации. Все перечисленные в табл. 6.4 аллели рецессивны (за исключением двух: wBwx и wDZL), и тест на комплементацию
182 Организация и передача генетического материала
показывает, что все они влияют на функцию, определяющую нормальный цвет глаз. Однако при этом в гене white присутствует и некоторое функциональное разнообразие. Мутации, расположенные в правых сайтах (w1 и wspl), действуют как доминантные супрессоры расположенного по соседству гена цвета глаз zeste, тогда как мутации пяти левых сайтов такого действия не оказывают. Механизм этой супрессии неизвестен. Техника рекомбинантной ДНК позволила проанализировать тонкую структуру гена white методом рестрикционного картирования его ДНК.
6. Тонкая структура гена 183
Эта методика будет описана в гл. 9, но сами результаты анализа можно изложить сейчас. Рестрикционный анализ ДНК многих мутантов, из числа представленных в табл. 6.4, позволяет определить делеции и вставки, превышающие размером 50 н. п. Более мелкие изменения, в том числе замены отдельных нуклеотидных пар, пока неразличимы. Как указывается в табл. 6.4, из 14 исследованных независимых спонтанных мутантов восемь содержат вставки больших участков ДНК и один (wsp2) представляет собой делецию участка длиной не менее 100 н. п. Из пяти индуцированных рентгеновским облучением мутаций две оказались крупными делециями. Большинство мутаций, обусловленных вставками, если не все, связаны с присутствием подвижных элементов в последовательности дикого типа гена white. Подвижные элементы - это длинные последовательности нуклеотидов, встроенные в геномы практически всех эукариот и прокариот, и изредка способные случайно менять свою локализацию. Эти особенности мы обсудим в следующих главах. Одна из наиболее интенсивно исследовавшихся мутаций wa1 обусловлена вставкой элемента copia. Этот элемент представляет собой нуклеотидную последовательность длиной около 5000 н. п, включающую ДНК провируса РНК-ретровируса, инфицирующего дрозофилу.
184 Организация и передача генетического материала Карта делеций и вставок в участке ДНК, соответствующем гену white, изображена на рис. 6.17. Как уже упоминалось, она складывается из двух функциональных областей. Левая область, включающая wal, и лежащие слева от нее мутации содержат много мутаций, качественно влияющих на пигментацию глаза. Считается, что этот участок кодирует некоторый пока еще неизвестный полипептид (или полипептиды), ответственный за пигментацию глаз. Все мутации в правой области сопряжены с сильными изменениями нормальной последовательности ДНК. Их фенотипическое действие лучше всего можно себе представить, считая, что они влияют на проявление (экспрессию) левой области гена white. Хотя граница между левой и правой областями четко не установлена, однако мы знаем, что область, кодирующая полипептид, и управляющая область содержат по крайней мере по 7000 н.п. или несколько больше. Исследование хромосомных перестроек, лежащих справа и слева, но не затрагивающих сам ген white, дают верхнюю оценку его размера-примерно 14000 н.п. ДНК. Анализ тонкой структуры гена white у дрозофилы и rII -генов фага Т4 показывает, что изучение фенотипических различий может служить мощным методом генетического анализа нуклеотидной организации ДНК. Изучение генетической организации началось с исследования тонкой структуры гена white за 40 лет до того, как стала известна химическая структура вещества наследственности. Детальный анализ генетической структуры, ставший возможным благодаря нашему пониманию структуры ДНК, предвещает грядущие в ближайшем будущем времена, когда тонкая структура гена может быть изучена в мельчайших деталях. Применение метода рекомбинантных ДНК к исследованию тонкой структуры гена white закрывает одну из самых ярких глав в истории генетики. Литература
6. Тонкая структура гена Дата добавления: 2015-12-16 | Просмотры: 811 | Нарушение авторских прав |