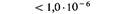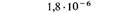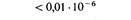|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
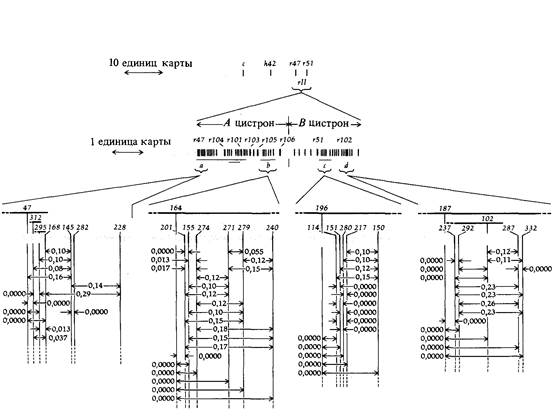
Природа мутаций в области rIIВ модели структуры ДНК Уотсона и Крика предполагается, что замена одной нуклеотидной пары в нормальной нуклеотидной последовательности гена может привести к формированию мутантного фенотипа. Можно предположить, что мутация, в основе которой лежит замена одной нуклеотидной пары, должна обладать следующими свойствами: 1) обратные мутации, переводящие мутантный фенотип в нормальный, должны происходить примерно с той же частотой, что и прямые; 2) ей должна соответствовать определенная точка на генетической карте; 3) такая мутация должна обладать способностью к рекомбинации с любыми другими точечными мутациями, за исключением тех, которые представляют собой независимые замены той же нуклеотидной пары. Некоторые из изученных Бензером rII -мутантов обладали перечисленными свойствами, другие - нет. Данные, представленные в табл. 6.2, показывают, что частота обратных мутаций к дикому типу у различных rII мутантов, способных к рекомбинации друг с другом, сильно различается. Некоторые из rII -мутантов вполне стабильны и не ревертируют к дикому типу (т.е. не дают бляшек на E. coli К (λ)); другие ревертируют к дикому типу с измеримыми и характерными частотами. Генетическая карта rII -мутантов, представленных в табл. 6.2, изображена на рис. 6.3. Результаты рекомбинационного анализа более широкого набора из 60 независимо полученных rII -мутантов представлены на карте Таблица 6.2. Характеристика восьми rII -мутантов фага Т4
164 Организация и передача генетического материала
6. Тонкая структура гена 165 (рис. 6.4). Тщательное изучение этой карты показывает, что некоторые из rII -мутантов (а именно не ревертирующие к дикому типу) рекомбинируют, давая rII + потомство не со всеми остальными rII -мутантами, но лишь с некоторыми из них. Соответственно эти мутации занимают на генетической карте участки большие, чем точечные мутации (размер участка зависит от конкретной мутации), и изображены жирными черными линиями, перекрывающими на карте мутации, с которыми они не рекомбинируют. Например, рассмотрим карту области α на рис. 6.4. Мутант 168 рекомбинирует с мутантами 295 и 312, но ни один из этих трех мутантов не дает рекомбинантов дикого типа с мутантом 47. Все эти четыре мутанта рекомбинируют с мутантами 145, 282 и 228. Если мутанты 168 и 295 - это точечные мутации, то мутант 47 должен возникать в результате изменения более чем одной точки на генетической карте (т.е. изменения более чем одной нуклеотидной пары). Относительно мутантов типа 47 было показано, что они представляют собой делеции многих последовательных пар нуклеотидов. Исследование рекомбинации двойных rII -мутантов показало, что такие мутации как бы вырезают из генетической карты участки, расположенные между фланкирующими генетическими маркерами, это неудивительно, поскольку у таких мутантов физически отсутствует участок ДНК между этими маркерами (рис. 6.5). Из этих исследований был сделан важный вывод: фенотипически неразличимые rII -мутации могут быть следствием либо замены отдельной нуклеотидной пары, либо делеции некоторого числа пар нуклеотидов. Свойства, обнаруживаемые у таких делеции, нельзя считать неожиданными. Действительно, вряд ли утрата некоторого числа нуклеотидных пар может быть обратимым процессом, поскольку при этом должны восстанавливаться точное число и последовательность этих пар. Аналогично скрещивание между носителем такой делеции и штаммом с точечной мутацией, расположенной в участке, отсутствующем у партнера по скрещиванию, не должно приводить к появлению рекомбинантов дикого типа. Ни один из геномов, участвующих в таком
166 Организация и передача генетического материала скрещивании, не содержит нужной нуклеотидной пары в месте точечной мутации. Следовательно, восстановление нуклеотидной последовательности дикого типа невозможно. Функциональные особенности rII -мутаций Генетический анализ состоит в экспериментальном изучении отношений, существующих между мутантами. Для определения характера этих отношений используются два основных приема- рекомбинационный тест и тест на комплементацию. Рекомбинационный тест, как мы уже отмечали в предыдущем разделе, определяет взаимное пространственное расположение мутаций на генетической карте. Комплементационный тест, с другой стороны, определяет функциональные отношения мутантов. Все rII -мутанты обладают одинаковым фенотипом (табл. 6.1). Одинаковы ли их генетические функции? Для ответа на этот вопрос клетки Е. coli К (λ) заражали различными парными комбинациями мутантов rII, как это схематически изображено на рис. 6.6. Если в такой дважды инфицированной клетке возникает потомство фага, то это означает, что каждый из двух мутантных фагов осуществляет функцию, которую не в состоянии осуществлять второй мутант. Такие два мутанта называют комплементарными. С другой стороны, если в такой дважды инфицированной клетке потомства фагов не возникает, то это означает, что оба мутанта не способны осуществлять одну и ту же функцию. Комплементационный анализ rII -мутантов легко проводится с помощью так называемого spot-теста. Клетки, инфицированные rII -мутантом с множественностью 0,1 (примерно один фаг на десять бактериальных клеток) смешиваются с теплым расплавленным агаром, и смесь наносится на поверхность питательной среды в чашке Петри. Когда агар затвердевает, на его поверхность капают несколько капель среды, содержащей другой rII -мутант. В месте падения капель некоторые клетки инфицируются обоими мутантами. Если при этом происходит комплементация, то в инфицированных клетках возникает потомство фагов обоих родительских генотипов (а также рекомбинантных генотипов). Это потомство инфицирует затем все остальные бактериальные клетки в покрытом каплей участке и убивает их. Таким образом, комплементация проявляется в лизисе бактерий на месте капли (рис. 6.7). Результаты комплементационного теста показывают, что все rII-му тации, за исключением некоторых делеций, распадаются на две группы, обозначаемые как А и В. Следовательно, rII -фенотип может быть обусловлен утратой одной из двух генетических функций, А или В. Например, принадлежащий группе А мутант 104 не дает потомства при одновременном заражении с мутантами 47, 101 и 106 (рис. 6.4) и дает потомство при совместной инфекции с фаговыми мутантами из группы В, например 51 и 102. Делеций, которые не могут быть отнесены ни к одной из этих групп, включают в себя на генетической карте границу между этими двумя группами комплементации и потому утрачивают обе функции.
6. Тонкая структура гена 167
168 Организация и передача генетического материала
Цистрон Использованный Бензером тест на комплементацию оценивает функциональные отношения между мутациями, находящимися в транс-конфигурации (рис. 6.8). Если две мутации принадлежат к одной группе комплементации и находятся в транс-положении, то они не комплементируют и потомства не возникает. С другой стороны, если эти же две мутации находятся в цис-положении, то потомство образуется. Например, если бактериальную клетку штамма К (λ) одновременно заражают двойным rII -мутантом и фагом Т4 дикого типа, то образуется потомство обоих генотипов. Фаг дикого типа осуществляет функции, необходимые для успешной репликации как генома дикого типа, так и мутантного генома. Если же две мутации относятся к разным группам комплементации, то и в цис-, и в транс-положениях они проявляют одинаковый фенотип: потомство возникает в обоих случаях. Фенотипическое различие между цис- и транс-конфигурациями двух мутаций служит основой для генетического теста на общность функции, аналогичного цис-транс-тесту, впервые использованному Эдвардом Левисом при исследовании функциональных взаимоотношений псевдоаллелей различных генов дрозофилы. Например, мутации Star (5) и asteroid (ast) определяют форму и строение глаз дрозофилы. Первоначально считалось, что эти мутации аллельны, поскольку в мейозе они
6. Тонкая структура гена 169
170 Организация и передача генетического материала всегда расщеплялись. Мутация ast обозначалась как star-рецессивная (s), чтобы указать на ее аллелизм по отношению к Star-доминантной мутации (S). Однако тщательное исследование потомства от самок с генотипом alSho/ + st, подвергнутых возвратному скрещиванию с самцами alsho/alsho, показало, что изредка при этом могут возникать потомки дикого типа s +. Частота возникновения таких особей составляет около 1:10 000, и во всех случаях они оказались рекомбинантными по фланкирующим (расположенным по обе стороны от этих мутаций) маркерам al (aristaless) и ho. Генотип таких особей + + ho/alsho. Существование такого рекомбинантного потомства свидетельствовало о том, что мутации S и s расположены в разных точках хромосомы, причем S слева от s. Чтобы отразить этот факт, пришлось star-рецессивную мутацию переименовать в asteroid. Однако, поскольку обе мутации оказывают сходное влияние на фенотип, вопрос об их функциональных отношениях оставался открытым. Для ответа на него были сконструированы генотипы, содержащие эти мутации в циc-(Sast/+ +) и трансположении (S + ast). Оказалось что цис- и транс-конфигурации этих мутаций имеют разное фенотипическое проявление (рис. 6.9), следовательно, обе мутации влияют на одну и ту же генетическую функцию. Для обозначения таких функциональных отношений между очень тесно сцепленными мутациями был введен термин псевдоаллелизм. Учитывая важность цис-транс-теста для определения функциональной генетической единицы, Бензер предложил для обозначения групп комплементации rII -мутаций термин «цистрон». С тех пор употребление термина «цистрон» в качестве синонима гена (как единицы функции) стало общепринятым. Картирование rII -мутаций с помощью делеций Известно, что при скрещивании мутантов со штаммами, несущими делеции в соответствующей этой мутации области генетической карты, нельзя получить рекомбинантов дикого типа. Этот факт дает в руки исследователей мощный метод анализа, которым Бензер воспользовался для картирования тысяч независимых rII -мутаций. Обдуманно упорядоченный набор делеций, представленный на рис. 6.10, делит rII область на 47 отрезков, определяемых соседними концами различных пар делеций. Для того чтобы новую мутацию отнести к одному из этих 47 отрезков, достаточно произвести чуть больше десятка скрещиваний, при которых фиксируется лишь наличие или отсутствие рекомбинантов дикого типа при посеве на Е. coli К (λ). Эта методика схематически изображена на рис. 6.11. После того как установлена локализация некоторого числа независимых rII -мутаций в определенном отрезке, остается установить лишь их взаимное расположение друг относительно друга, и нет необходимости определять их положение относительно мутаций, локализованных в других участках карты. Построенная таким способом (рис. 6.12) карта тонкой структуры спонтанных rII -мутаций показывает, что эти мутации более или менее случайно разбросаны по генетической карте. Исключение составляют две «точки», представляющие собой высокомутабильные участки ДНК.
6. Тонкая структура гена 171
Эта карта демонстрирует важный факт, что rII -мутации, приводящие к утрате функции, т.е. к одному и тому же фенотипу, могут происходить во многих различных точках цистрона. Ясно, что число возможных аллелей rII очень велико. На реальность более глубокой дифференциации тонкой генетической структуры указывает тот факт, что спонтанные точечные мутации, расположенные в разных частях карты, ревертируют к дикому типу с различными и характерными для каждой мутации частотами. Следовательно, природа этих различных спонтанных мутаций, обусловливающих один и тот же фенотип, не может быть одинаковой. Сравнение карты спонтанных мутаций с аналогичной картой, построенной для мутаций, индуцированных специальными химическими мутагенами, показывает, что участки повышенной мутабильности в этих картах расположены в разных местах, хотя и специфичны для каждой из них (рис. 6.12). Это в свою очередь свидетельствует о существовании еще более тонкой структуры генетического материала. При картировании мутаций, полученных всеми возможными способами, установлена принадлежность 200 мутаций rIIА -цистрону
172 Организация и передача генетического материала
6. Тонкая структура гена 173
и 108 мутаций rII В-цистрону. В настоящее время известно, что протяженность rIIA составляет 1800 нуклеотидных пар, а rII В-850. Малое количество мутаций во многих участках карты и много меньшее общее число мутаций по сравнению с числом нуклеотидных пар наводит на мысль о том, что область rII еще далеко не до конца исследована. Кроме того, многие мутации могут оставаться невыявленными в силу того,
174 Организация и передача генетического материала
6. Тонкая структура гена 175 что возникающие при этом генетические изменения никак не проявляются фенотипически. Вырожденность генетического кода (см. гл. 12) означает, что замены некоторых пар нуклеотидов не приводят к заменам аминокислот в белках, кодируемых соответствующим цистроном. Ясно, однако, что число точек (сайтов) на карте области rII, мутации в которых приводят к изменению в фенотипе, составляет значительную часть от общего числа нуклеотидных пар в этой области. Дата добавления: 2015-12-16 | Просмотры: 1174 | Нарушение авторских прав |