|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология
|
Предварительные замечания
Самым простым объектом, необходимым для регистрации биологического действия токсиканта, является клетка. При изучении механизмов токсического действия это положение не редко опускают, концентрируя внимание на оценке характеристик взаимодействии химического вещества с молекулами-мишенями (см. выше). Такой упрощенческий подход, оправданный на начальных этапах работы, совершенно не допустим при переходе к изучению основной закономерности токсикологии - зависимости "доза-эффект". На этом этапе необходимо изучить количественные и качественные характеристики реакции всего эффекторного аппарата биообъекта на возрастающие дозы токсиканта, и сопоставить их с закономерностями действия ксенобиотика на молекулярном уровне.
2.2. Основные понятия
Рецепторная концепция действия токсикантов на клетку или орган предполагает, что в его основе лежит реакция вещества с определенной биологической структурой - рецептором (см. раздел "Механизм действия"). Наиболее глубоко эти представления развивались в ходе исследований на моделях взаимодействия ксенобиотиков с селективными рецепторами эндогенных биорегуляторов (нейромедиаторов, гормонов и др.). Именно в такого рода опытах установлены базовые закономерности, лежащие в основе зависимости "доза - эффект". Общепризнанно, что процесс образования комплекса вещества с рецептором подчиняется закону действующих масс. Однако гипотетичными до настоящего времени остаются представления, позволяющие связать количественные и качественные характеристики этой первичной реакции и выраженность эффекта со стороны целостной биологической системы. Для преодоления возникающих сложностей принято выделять две токсикометрические характеристики ксенобиотика:
1. Афинность - отражает степень сродства токсиканта к рецептору данного типа;
2. Эффективность - характеризует способность веществ вызывать определенный эффект после взаимодействия с рецептором. При этом ксенобиотики, имитирующие действие эндогенного биорегулятора, называются его агонистами. Вещества, блокирующие действие агонистов, называются антагонистами.
2.3. Афинность
Измерение афинности токсиканта к рецептору, по сути, представляет собой экспериментальное изучение зависимости между количеством вещества, добавляемого в инкубационную среду, и количеством образующегося в результате взаимодействия токсикант-рецепторного комплекса. Обычный методический прием - радиолигандные исследования (см. выше).
При использовании закона действующих масс для определения афинности необходимо учитывать, что исследователю известны количественные характеристики содержания в среде только одного из участников процесса - токсиканта [P]. Количество рецепторов [R]T, участвующих в реакции, всегда не известно. Существуют методические приемы и допущения, позволяющие в ходе эксперимента и на этапе анализа обработки полученных результатов преодолеть эту сложность.
2.3.1. Описание взаимодействия "токсикант-рецептор" в соответствии с законом действующих масс
В простейшем случае для описания процесса образования комплекса вещества и рецептора применяют кинетические характеристики реакции второго порядка.
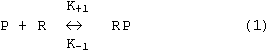
В соответствии с законом действующих масс:
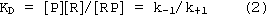
KD - константа диссоциации комплекса "токсикант-рецептор".
1/KD - константа ассоциативного процесса, является мерой сродства токсиканта к рецептору.
Поскольку общее количество рецепторов в изучаемой системе (культура клеток, изолированный орган и т.д.) есть сумма свободных [R] и вступивших во взаимодействие с веществом [RP] рецепторов, то:
[R]T = [RP] + [R] (3)
С учетом уравнений (2) и (3), имеем
[RP]/[R]T = y = [P]/([P] + KD) (4)
Степень насыщения рецептора токсикантом "у" есть отношение связавшегося с веществом рецептора к общему количеству рецепторов. Поскольку количество образовавшегося комплекса [RP] может быть определено экспериментально появляется возможность рассчитать значение КD в соответствии с уравнением (4). В графическом представлении зависимость насыщения рецептора от концентрации токсиканта в среде имеет вид гиперболы, что также может быть использовано для определения значения константы диссоциации.
2.3.2. Более сложные модели взаимодействия "токсикант-рецептор"
Экспериментально получаемые кривые связывания токсиканта на рецепторах не редко более крутые или более пологие, чем следует ожидать, исходя из закона действующих масс. Иногда выявляются кривые со сложной зависимостью степени насыщения рецептора токсикантом от его концентрации. Эти отклонения обычно объясняют тремя обстоятельствами:
1. Реакция между веществом и рецептором не является бимолекулярной. В этом случае требуется иная форма задания зависимости, чем представленная уравнением (4):
y = [P]n/([P]n + KD) (5)
где n (константа Хила) - формально отражает число молекул токсиканта, принимающих участие в образовании одного комплекса "токсикант-рецептор".
2. Популяция рецептора, с которым взаимодействует токсикант, гетерогенна. Так, если в биологическом объекте в равных количествах содержатся два подтипа рецептора, различающихся в 3 раза величиной константы ассоциации комплекса "токсикант-рецептор", то суммарное значение константы Хила, исследуемой зависимости будет равно 0,94. При больших различиях значений констант ассоциации интегральная её величина в ещё большей степени будет отличаться от 1,0.
3. Определенное влияние на процесс образования комплекса "токсикант-рецептор" оказывают такие явления, как изменение конформации рецептора, кооперативности его отдельных субъединиц, различные аллостерические эффекты. Так, нередко кривая связывания токсиканта с рецептором имеет S-образный вид. Это свидетельствует о взаимном влиянии соседних участков связывания токсиканта с макромолекулой (например, образование комплекса с одной субъединицей рецептора приводит к изменению его сродства к другим, свободным субъединицам). Подобный эффект наблюдается при изучении связывания ацетилхолина препаратом тканевых мембран, содержащих холинорецептор. Увеличение концентрации свободного [3Н]-ацетилхолина в инкубационной среде сопровождается возрастанием афинности вещества к рецепторным протеинам (рисунок 1). Местный анестетик прилокаин при добавлении в инкубационную среду нарушает явление кооперативности рецепторов и, тем самым, ограничивает увеличение сродства к ним ацетилхолина. Об этом свидетельствует изменение формы кривой зависимости "связывание - концентрация токсиканта" и превращение её из S-образной в обычную гиперболическую.
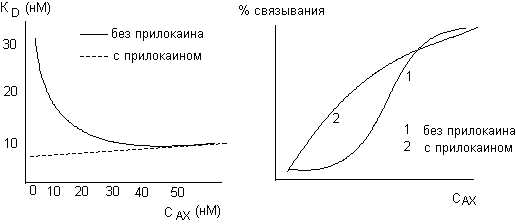
Рисунок 1. Влияние прилокаина на процесс связывания ацетилхолина с холинорацептором (J.B. Cohen et al., 1974)
2.4. Эффективность
В многочисленных опытах показано, что между способностью вещества образовывать комплекс с рецептором определенного вида и выраженностью формирующегося при этом биологического эффекта (например, сокращение гладкомышечных волокон стенки кишечника, изменение сердечного ритма, выделение секрета железой и т.д.) далеко не всегда прослеживается прямая зависимость. Для описания результатов экспериментальных исследований, в которых эта зависимость изучалась, предложен ряд теорий.
Как указывалось ранее, все токсиканты, взаимодействующие с рецептором условно могут быть подразделены на агонисты и антагонисты. В этой связи ниже, при обозначении концентрации токсиканта в среде, будут использоваться соответственно символы: [А] - концентрация агониста; [В] - концентрация антагониста.
2.4.1. Оккупационные теории
Самая первая из предложенных теорий принадлежала Кларку (1926), который предположил, что выраженность наблюдаемого эффекта линейно связана с количеством рецепторов, оккупированных токсикантом ([RP]/[R]).
Как следует из уравнения (4)
[RA]/[R]T = [A]/([A] + KA) = EA/EM (6)
где ЕА - выраженность эффекта от действия агониста в примененной концентрации;
ЕМ - максимально возможный эффект со стороны исследуемой биологической системы;
КА - константа диссоциации комплекса "агонист-рецептор".
Согласно теории Кларка 50% выраженности эффект развивается при такой дозе агониста, при которой оккупировано 50% рецепторов ([А]50). Эта доза вещества называется среднеэффективной (ЕД50).
Аналогично, в соответствии с законом действия масс, с рецептором взаимодействует и антагонист, не вызывая при этом эффекта
КВ = [В][R]/[ВR] (8)
где КВ - константа диссоциации комплекса "рецептор-антагонист".
Если агонист и антагонист действуют на рецептор одновременно, то, естественно, количество рецепторов, способных связаться с агонистом понижается. Общее количество рецепторов в биообъекте может быть обозначено как
[R]T = [R] + [RA] + [RB] (9)
В соответствии с рассматриваемой теорией токсикант может быть либо агонистом, либо антагонистом. Однако результаты многочисленных исследований указывают на то, что подобная классификация веществ оказывается недостаточной для описания наблюдаемых эффектов. Так установлено, что максимальный эффект, вызываемый различными агонистами, действующими на одну и туже рецепторную систему, не одинаков.
Для преодоления этого противоречия Стефенсоном (1956) были предложены три допущения:
- максимальный эффект может быть вызван агонистом даже в том случае, если оккупирована лишь незначительная часть рецепторов;
- развивающийся эффект не линейно связан с количеством оккупированных рецепторов;
- токсиканты обладают неодинаковой эффективностью (относительной возбуждающей активностью), т.е. способностью вызывать эффект, взаимодействуя с рецептором. Следовательно, вещества с различной эффективностью для того, чтобы вызвать одинаковый по выраженности эффект, должны оккупировать различное количество рецепторов.
В соответствии с этими представлениями сила эффекта зависит не только от числа занятых рецепторов, но и от величины некоего стимула "S", формирующегося при образовании комплекса "токсикант-рецептор":
ЕА/ЕМ =  (S) = (S) =  (e[RA]/[R]T) = (e[RA]/[R]T) =  (eyA) (10) (eyA) (10)
где е - безразмерная величина, характеризующая эффективность агониста. По Стефенсону - это мера способности токсиканта вызывать эффект, при образовании комплекса с рецептором. Количественно Стефенсон определил е = 1, при условии, что максимальный эффект от действия вещества на биосистему составляет 50% от теоретически возможной ответной реакции этой биосистемы на возбуждающий стимул.
Фурхготт (1964) предположил, что значение "е" прямо зависит от общей концентрации рецепторов в биологической системе [R]Т, и ввел дополнительное понятие "внутренняя эффективность" вещества ( ), величина которой обратно пропорциональна концентрации рецепторов в системе ), величина которой обратно пропорциональна концентрации рецепторов в системе
 = е/[R]Т (11) = е/[R]Т (11)
Как следует из уравнения (10)
ЕА/ЕМ =  ( ( [R]ТуА) (12) [R]ТуА) (12)
Подстановка выражения (6) в уравнение (12) приводит к
ЕА/ЕМ =  (е[А]/([А] + К)) (13) (е[А]/([А] + К)) (13)
Если концентрация готовых к взаимодействию с агонистом рецепторов уменьшается в q раз (при необратимой блокаде рецепторов антагонистом), то реальная эффективность изучаемого вещества становится равной qе, тогда уравнение (13) принимает вид
ЕА*/ЕМ* =  (qe[A*]/([A*] + K)) (14) (qe[A*]/([A*] + K)) (14)
Данная закономерность графически представлена на рисунке 2.
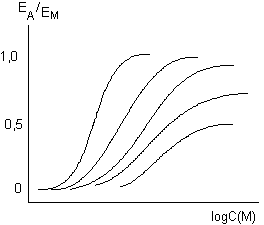
Рисунок 2. Действие гистамина на препарат тонкой кишки морской свинки в условиях возрастающей блокады рецепторов дибенамином (ЕД50 = 0,24мкМ; КА = 10мкМ; е = 21) (R.F. Furchgott, 1966)
Еще одна концепция, позволяющая описать зависимость между действующей концентрацией вещества и выраженностью развивающегося эффекта, предложена Ариенсом (1954). Автор предлагает характеризовать исследуемое вещество величиной, обозначаемой как "внутренняя активность" (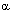 Е) Е)
(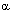 Е) = ЕА.MAX/EM (15) Е) = ЕА.MAX/EM (15)
Поскольку теоретически возможный максимальный эффект можно определить в эксперименте лишь при использовании сильного агониста, обычно значение 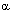 Е для большинства веществ лежит в интервале 0< Е для большинства веществ лежит в интервале 0< 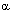 Е <1. Для полного агониста Е <1. Для полного агониста 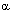 Е = 1, Е = 1,  Е антагониста равна 0. Е антагониста равна 0.
Таким образом, максимально возможный биологический эффект может развиться при оккупации токсикантом части рецепторов. В этом случае необратимое связывание некоторого количества рецепторов должно приводить лишь к смещению кривой "доза-эффект" вправо, без снижения величины максимального эффекта. Только при переходе определенной границы связывания рецепторов с антагонистом начинает снижаться и величина максимального эффекта.
Обычно в ходе исследований зависимости "доза-эффект" с позиций оккупационных теорий для характеристики токсикантов определяют следующие параметры:
1. КА - константу ассоциации комплекса "агонист-рецептор" (рКА = -lgКА). Так как значение этой величины часто оценивают непрямым методом (т.е не по количеству образовавшегося комплекса "токсикант-рецептор", а по величине развившегося эффекта при добавлении в среду определенного количества токсиканта) на основании концепции "стимулов", лучше говорить о "кажущейся" константе ассоциации.
2. ЕС50 или ЕД50 - такие концентрации или дозы токсиканта, при действии которых формируется ответная реакция биологического объекта равная по интенсивности 50% от максимально возможной (рД2 = -lgЕД50).
3. КВ - константу диссоциации комплекса "рецептор-антагонист". Сила действия конкурентного антагониста может быть выражена лишь с помощью одного параметра - сродства к рецептору. Этот параметр оценивается при обязательном внесении в инкубационную среду агониста.
2.4.2. Теория "скорости взаимодействия"
Для объяснения данных, выявляемых в процессе изучения зависимости "доза-эффект", которые не могут быть поняты с позиций оккупационной теории, Пэтоном (1961) была предложена теория "скорости взаимодействия".
Пэтон предположил, что выраженность ответной реакции биологической системы на действие вещества определяется не только числом оккупированных им рецепторов, но и скоростью, с которой вещество вступает во взаимодействие с рецептором, а затем отсоединяется от него. Автором было использовано такое сравнение: рецептор, это не клавиша органа, на которую чем дольше нажимаешь, тем дольше извлекаешь звук, но это клавиша фортепиано - здесь звук извлекается в момент удара, а затем, даже если долго держишь клавишу нажатой, звук все равно затухает.
В соответствии с теорией Пэтона, сильные агонисты - это вещества, быстро оккупирующие и быстро покидающие рецептор; антагонисты - это вещества, на долго связывающие рецептор.
2.4.3. Теории конформационных изменений рецептора
Для многих веществ кривая "доза-эффект" существенно отклоняется от гиперболической функциональной зависимости. Коэффициент Хила для этих кривых не равен 1 (см. выше). Как уже указывалось, эти особенности, а также S-образный характер кривых "доза-эффект" иногда может быть объяснен явлением кооперативного взаимодействия рецепторных белков. Показано также, что многочисленные химические модификаторы рецепторов (например дитиотреитол - восстановитель сульфгидрильных групп), необратимые блокаторы холинорецепторов (например  -галогеналкиламины), другие антихолинергические препараты (атропин), конкурентные миорелаксанты, местные анестетики и многие другие вещества, изменяют вид кривой "доза-эффект" для агонистов, превращая её из S-образной в гиперболическую. -галогеналкиламины), другие антихолинергические препараты (атропин), конкурентные миорелаксанты, местные анестетики и многие другие вещества, изменяют вид кривой "доза-эффект" для агонистов, превращая её из S-образной в гиперболическую.
Для объяснения этих и других феноменов, трудно интерпретируемых с позиций оккупационных теорий (сенсибилизация и десенсибилизация рецепторов при действии агонистов), Катцем и Теслефом еще в 1957 году, на примере изучения действия миорелаксантов, была выдвинута циклическая (конформационная) модель взаимодействия токсиканта с рецептором.
В основе модели лежит представление, согласно которому как рецептор [R], так и комплекс "токсикант-рецептор" [RP] могут находиться в активном (RA, RPA) и неактивном состоянии (RI, RPI). Схематически это представлено на рисунке 3.
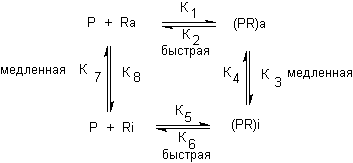
Рисунок 3. Схема взаимодействия токсиканта с рецептором в соответствии с моделью Катца - Теслефа.
Эта модель позволяет объяснить действие на рецептор агонистов и конкурентных антагонистов.
Агонист, например ацетилхолин, взаимодействует с RA, поскольку имеет более высокое сродство к RA, чем к RI, при этом образуется комплекс RPA. Равновесие между RPA и RPI сдвинуто в сторону RPA, так как RI имеет низкое сродство к агонисту, а комплекс RPI диссоциирует с образованием свободного RI. Развитие эффекта формируется на этапе конформационного превращения RPA в RPI. Интенсивность стимула, возникающего в биологической системе, зависит от количества таких превращений в единицу времени. Конкурентные антагонисты, например d-тубокурарин, имеют большее сродство к RA и снижают эффект агониста, выключая часть рецепторов из процесса взаимодействия с последним.
Основываясь на этой модели, практически не возможно экспериментально определить значение соответствующих констант превращений или внутреннюю активность агонистов. Поэтому до настоящего времени в эксперименте по-прежнему широко используют оккупационные модели.
3. Зависимость "доза-эффект" на уровне организма
3.1. Предварительные замечания
Биологическими системами, в отношении которых в токсикологии изучается зависимость "доза-эффект" являются ткани, органы, целостный организм. Чувствительность различных органов и систем организма к токсиканту не одинакова. Вот почему этот этап исследований необходим для развернутой характеристики токсичности исследуемого вещества.
Изучение изолированных органов в искусственных условиях, моделирующих естественную среду, имеют большое значение для выяснения механизмов взаимодействия токсиканта и организма. Описанные выше теории рецепторного действия токсикантов сформулированы, в основном, на основе данных, полученных в опытах именно на изолированных органах. Не удивительно, что и в настоящее время исследования на этих объектах занимают важное место в токсикологии.
3.2. Кривая "доза-эффект"
В общем виде можно предположить, что кривая "доза-эффект" агониста в полулогарифмических координатах (логарифм дозы - выраженность эффекта) принимает S-образную форму не зависимо от целого ряда качественных и количественных особенностей оцениваемой функции. Метод, с помощью которого изучается зависимость, то ли постепенное добавление токсиканта в инкубат, то ли однократное действие вещества на биообъект в возрастающих концентрациях, не оказывают существенного влияния на результат, если эффект не оценивается в абсолютных значениях, а выражается в процентах от максимально возможного (100%). Применение относительных величин целесообразно хотя бы потому, что любой биологический препарат, при самом тщательном приготовлении, уникален во всех своих свойствах, в том числе и по чувствительности к химическим веществам. Кроме того, в ходе эксперимента реакционная способность препарата падает. Эти обстоятельства и предполагают обязательную стандартизацию объекта перед исследованием. Графическое представление кривой "доза-эффект" токсиканта Р в сравнении с кривой для некоего стандартного вещества дает всю необходимую информацию о действии Р, включая его токсикометрические характеристики.
Поскольку непосредственное сравнение кривых, получаемых в ходе эксперимента, осуществлять технически сложно, чаще сравнивают важнейшие параметры кривых.
3.2.1. Среднеэффективная доза (ЕД50)
Основным параметром зависимости "доза-эффект" для определенного токсиканта и биологического объекта является величина среднеэффективной дозы (ЕД50), т.е. такая доза вещества, при действии которой на объект развивается эффект, равный 50% от максимально возможного. При работе на изолированных органах обычно используют величину ЕС50 (среднеэффективная концентрация вещества в пробе). Эффективные дозы обычно измеряют в единицах массы токсиканта на единицу массы биологического объекта (например, мг/кг); эффективные концентрации - в единицах массы токсиканта на единицу объема используемой среды (например, г/литр; М/литр). Вместо величины ЕД50 иногда используют её отрицательный логарифм: -log ED50 = pD2 (таблица 3).
Таблица 3. Величины рД2 для некоторых токсикантов, полученных в эксперименте на изолированном органе (оцениваемый эффект - сокращение мышечных волокон препарата) (J.M. Van Rossumm, 1966)
| Вещество
| Изолированный орган
| рД2
| | ацетилхолин ареколин пилокарпин
| кишка крысы -,, - -,, -
| 6,5 6,3 4,8
|
3.2.2. Относительная активность
Другим параметром зависимости "доза-эффект" является относительная активность токсиканта, величина, определяемая как отношение эффекта, вызываемого токсикантом в данной дозе, к максимально возможному эффекту, развивающемуся при действии на биосистему. Это характеристика определяется, как указывалось выше, величиной внутренней активности вещества (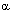 Е). Е).
В узком смысле слова это понятие описывает феномен различия свойств агонистов, с учетом четко очерченных представлений о механизме их токсического действия. Однако в настоящее время его не редко трактуют в расширенном смысле, как показатель сравнения активности веществ, обладающих определенными свойствами, без учета механизмов, посредством которых они инициируют наблюдаемый эффект. На рисунке 4 представлены кривые "доза-эффект" серии веществ, различающихся значением величин 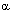 Е и, соответственно, ЕД50, действующих на парасимпатический отдел вегетативной нервной системы. Е и, соответственно, ЕД50, действующих на парасимпатический отдел вегетативной нервной системы.
Рисунок 4. Кривые "доза-эффект" серии парасимпатомиметиков (0 < 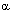 Е < 1,0), полученные на препарате изолированной тонкой кишки крысы. (J.M. Van Rossumm, 1966) Е < 1,0), полученные на препарате изолированной тонкой кишки крысы. (J.M. Van Rossumm, 1966)
3.3. Биологическая изменчивость
Уже указывалось, что на одном и том же биологическом объекте можно поставить ограниченное количество токсикологических экспериментов (в простейших случаях - ввести животному дозу вещества; добавить в инкубационную среду, содержащую изолированный орган, вещество в возрастающей концентрации и т.д.). Поиск зависимости "доза-эффект" для одного, и тем более, нескольких токсикантов требует постановки множества экспериментов, что предполагает использование большого количества биологических объектов. В этой связи исследователь сталкивается с явлением биологической изменчивости. Даже при тщательном отборе встречаются объекты, как чрезвычайно чувствительные, так и малочувствительные к действию химических веществ, что приводит к известной вариабельности получаемых результатов. Необходимо иметь в виду, что способ учета этого феномена в ходе анализа экспериментальных данных часто оказывает влияние на итоговые значения изучаемых характеристик токсикантов.
В основе учета феномена биологической изменчивости лежит метод усреднения полученных данных. При установлении величины ЕД50, оказывается безразличным проведено ли усреднение доз, вызывающих одинаковый эффект на нескольких биообъектах, либо значений эффектов, полученных при действии определенных доз токсиканта (рисунок 5). Если же поставлена задача получить результирующую кривую "доза-эффект", то усреднению подлежат только дозы, вызывающие со стороны биообъекта эффекты определенной выраженности. При ином подходе (усреднение эффектов) наблюдается существенное снижение крутизны итоговой кривой "доза-эффект" в сравнении исходными данными.
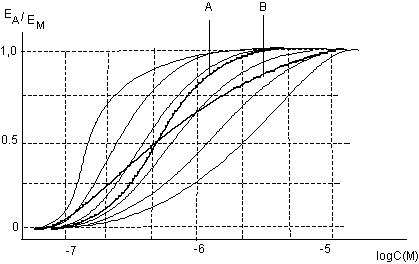
Рисунок 5. Построение усредненной кривой доза-эффект с использованием данных, полученных на нескольких биопрепаратах с различной чувствительностью к исследуемому токсиканту. Использование метода усреднения доз, вызывающих одинаковые эффекты (А) дает правильный результат. Метод усреднения эффектов (В) приводит к "уплощенной" результирующей кривой.
3.4. Совместное действие нескольких токсикантов на биообъект
При совместном действии на биообъект агонистов и антагонистов возможны различные модификации зависимости "доза-эффект" (не связанные с различного рода химическими и физико-химическими взаимодействиями ксенобиотиков). Наиболее часто регистрируются такие изменения как:
- параллельный сдвиг кривой "доза-эффект";
- снижение максимальных значений кривой "доза-эффект";
- параллельный сдвиг с одновременным снижением максимальных значений.
В настоящее время для объяснения наблюдаемых эффектов наиболее часто применяют представления оккупационной теории взаимодействия "токсикант-рецептор".
3.4.1. Параллельный сдвиг кривой "доза-эффект"
Главное и наиболее часто используемое объяснение параллельного сдвига кривой "доза-эффект" для вещества (А) при одновременном действии на биопрепарат (внесение в инкубационную среду) вещества (В) с внутренней активностью 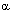 Е = 0, базируется на допущении, что (В) является конкурентным антагонистом (А). Е = 0, базируется на допущении, что (В) является конкурентным антагонистом (А).
При сравнении на основе оккупационной теории равноэффективных концентраций агониста в отсутствии ([А]) и при добавлении антагониста ([А*]) в определенной концентрации [В], имеем
[А*]/[А] = 1 + [В]/КВ (16)
Поскольку координаты, в которых регистрируются эффекты, и наблюдается параллельный сдвиг, полулогарифмические, при логарифмировании обеих частей уравнения (16) имеем
log[A*] - log[A] = log(1 + [B]/KB) = S (17)
или
-logKB = log([A*]/[A] - 1) - log[B] (18)
Из уравнения (17) видно, что величина сдвига кривой (S) зависит только от концентрации [В] и величины константы диссоциации комплекса антагонист-рецептор КВ (рисунок 6). Соотношение между величиной стимула, вызываемого агонистом, и эффектом со стороны биосистемы не играет никакой роли. Часто для характеристики сродства антагониста к рецептору используют величину рА2 = -logКВ.
Из уравнений (16) и (17) следует, что рА2 численно равна отрицательному десятичному логарифму концентрации конкурентного антагониста, при которой необходимо удвоить содержание в среде агониста чтобы получить эффект, регистрируемый в отсутствии антагониста.
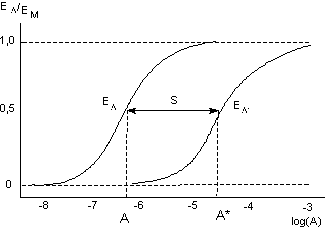
Рисунок 6. Теоретические кривые доза-эффект для агониста при отсутствии (А) и наличии (А*) в инкубационной среде антагониста в определенной концентрации [В]. В приведенном примере сдвиг S равен 1,3 и определяется как S = log[A*] - log[A]. Исходя из того, что S = log(1 + [B]/KD), КВ может быть определено экспериментально.
3.4.2. Снижение максимальных значений кривой "доза-эффект"
В ряде случаев при изучении зависимости "доза-эффект" для агониста (А*) в присутствии антагониста выявляется, что максимальный наблюдаемый эффект существенно слабее, чем наблюдавшийся от действия того же вещества в отсутствии антагониста (А). Это снижение максимального эффекта, которое может быть оценено в процентах, с позиции оккупационной теории трактуется следующим образом.
Неконкурентный антагонист (В*) реагирует с рецептором (R*) биосистемы, не являющимся рецептором R для агониста (А), при этом образование комплекса [R*B*] приводит к понижению эффективности комплекса [RA] понижается. Это приводит к некоему кажущемуся снижению внутренней активности 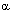 Е агониста, зависящему от [В*]. Е агониста, зависящему от [В*].
Снижение максимальных значений кривой "доза-эффект" может быть объяснено и необратимым ингибированием рецептора для агониста конкурентным антагонистом (В).
Для количественной характеристики активности неконкурентного антагониста используют величину отрицательного логарифма константы диссоциации комплекса антагонист-рецептор
-logKB* = pD*2
Для расчета этой величины необходимо экспериментально определить максимально возможное снижение эффекта агониста в присутствии насыщающей концентрации антагониста (ЕАВ*М). Тогда
pD*2 = -log[B*] - log[(ЕАВ*М - ЕА)/(ЕАВ* - ЕА) - 1] (21)
С учетом (21) рD2 можно рассматривать как отрицательный логарифм концентрации неконкурентного антагониста, при которой эффект агониста снижается на половину максимально достижимого уровня. В этом случае (ЕАВ*М - ЕА)/(ЕАВ* - ЕА) = 2. Обычно для упрощения расчетов вместо эффекта ЕА используют максимальные эффекты, развивающиеся при действии А в разных условиях: ЕАМ, ЕАМВ, ЕАМВМ.
Если с помощью неконкурентного антагониста возможно полностью заблокировать эффект агониста, то величину рD*2 можно рассчитать по более простой формуле
pD*2 = -log[B*] + log(EA/EAB* -1) (22)
3.4.3. Параллельный сдвиг с одновременным снижением максимальных значений
На практике чрезвычайно редко приходится сталкиваться с веществами (антагонистами), вызывающими либо только параллельный сдвиг, либо только снижение максимальных значений кривой "доза-эффект" для агониста. Как правило, выявляются оба эффекта. В этой связи становиться понятным, что деление многих ксенобиотиков на группы конкурентных и неконкурентных антагонистов ряда рецепторов носит во многом механистический характер. Тем не менее и в данном случае имеется необходимость количественной характеристики действия вещества.
рD2 рассчитывается в соответствии с уравнением (22), в которое вместо значений эффектов ЕА и ЕАВ подставляют значения ЕАМ и ЕАМВ (рисунок 7).
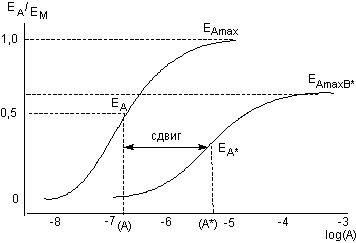
Рисунок 7. Теоретические кривые зависимости относительной эффективности агониста [А] от его концентрации в присутствии в инкубационной среде антагониста [В]. Для расчета величины рД2 следует использовать отношение условно равноэффективных доз [А] и [А*], после определения соответствующих ЕАМ и ЕАМВ*. Расчет осуществляется в соответствии с уравнением (23), после подтверждения факта, что неконкурентный антагонист является полным.
3.5. Определение кажущихся констант диссоциации комплекса "агонист-рецептор"
В то время, как прямая связь между значениями величин рА2 и рD*2 антагонистов с одной стороны и констант диссоциации комплекса антагонист-рецептор с другой признается хотя бы теоретически, связь между рD2 и КА агониста таковой, в строгом смысле не является, поскольку между этапом образования комплекса "агонист-рецептор" и этапом формирования эффекта лежит цепь промежуточных звеньев биохимических и физиологических реакций, как правило далеко не изученных (см. выше). Из этого следует, что непосредственно определить сродство токсиканта к рецептору (т.е. величину константы диссоциации комплекса "токсикант-рецептор") исходя из зависимости "доза-эффект", выстраиваемой в процессе эксперимента, не возможно. Для преодоления этой сложности предлагается определять величину кажущейся константы диссоциации. Классическим является метод с использованием необратимого конкурентного антагониста.
В 1956 году Nickerson установил, что алкилирующие соединения типа  -галогеналкиламинов, например дибенамин и феноксибензамин, могут вступать в необратимое взаимодействие с рецепторами различных типов. Связываются рецепторы к ацетилхолину, гистамину, серотонину, -галогеналкиламинов, например дибенамин и феноксибензамин, могут вступать в необратимое взаимодействие с рецепторами различных типов. Связываются рецепторы к ацетилхолину, гистамину, серотонину, 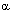 -адренорецепторам. Изучая совместное взаимодействие ингибиторов и агонистов с биопрепаратами, удалось: -адренорецепторам. Изучая совместное взаимодействие ингибиторов и агонистов с биопрепаратами, удалось:
- установить специфический характер действия галогеналкиламинов на агонист-связывающую область рецепторов;
- уточнить классификацию рецепторов в соответствии с их сродством к эндогенным агонистам.
Furchgott предложил метод, основанный на сравнении эквиэффективных доз агониста, действующего на интактный биопрепарат и препарат, обработанный предварительно ингибитором рецепторов (уменьшение [R]T на величину q[R]T).
Эффект, связанный с действием агониста до блокады рецепторов описывается уравнением (13), после блокады - уравнением (14). Одинаковый по выраженности эффект в этих условиях развивается при одинаковой величине стимула S. Если S = S*, то ЕА/ЕМ = ЕА*/ЕМ*, и тогда, комбинируя уравнения 13 и 14, получаем
1/[A] = 1/q 1/[A] + (1-q)/qKA (23)
Выстраивая зависимость в координатах 1/[А] и 1/[А*] получаем прямую с углом наклона 1/q и отрезок на оси 1/[А], равный (1-q)/qKA. Для практического определения КА можно использовать выражение
KA = (наклон - 1)/отрезок
Процесс подготовки данных представлен на рисунке 8:
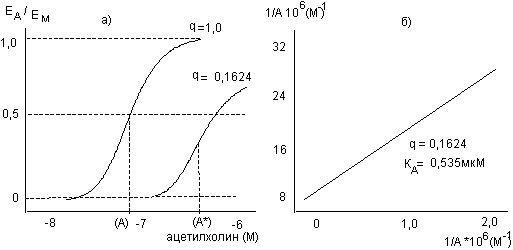
Рисунок 8. Определение величины кажущейся константы диссоциации агонистов на мускариночувствительный рецептор продольной мышцы тонкой кишки морской свинки.
а). Кривая зависимости доза-эффект ацетилхолина для интактного препарата (q = 1), и препарата, обработанного в течение 20 минут фенокисбензамином (5мкМ) (q = 0,1624).
б). Построение графика соотношения равноэффективных доз для интактного и обработанного препарата в координатах 1/[А] и 1/[А*] приводит к прямой, на основе которой (а также уравнения 23) можно вычислить значения константы диссоциации.
4. Зависимость "доза-эффект" в группе
4.1. Зависимость "доза-эффект" для одного токсиканта
При изучении зависимости "доза-эффект" в группе, состоящей из большого количества особей, можно исходить из представлений, развитых при изучении зависимости на уровне отдельного организма. Дополнительным фактором, влияющим на получаемый результат, является индивидуальная изменчивость.
Однако хотя реакция отдельных людей или животных в группе на токсикант не одинакова, по мере увеличения действующей дозы тем не менее будет увеличиваться и выраженность эффекта и количество индивидов (особей), у которых развивается оцениваемый эффект. Например, если на кожу испытуемых апплицировать вещество, вызывающее раздражение (ирритант), то по мере увеличения количества наносимого токсиканта будут отмечаться: - увеличение числа испытуемых, у которых разовьется реакция раздражения; - увеличится выраженность явления раздражения у испытуемых. Из этого следует, что получаемые в ходе работы величины должны определяться с учетом статистических закономерностей.
При изучении действия токсиканта на организм следует различать эффекты, выраженность которых градуально зависит от действующей дозы (например, понижение артериального давления) и эффекты типа "все или ничего" (пал/выжил). При этом следует учитывать, что эффекты первого типа можно практически всегда преобразовать в форму, пригодную для оценки эффектов второго типа. Для определения зависимости "доза-эффект" в группе обычно прибегают к двум типам построения эксперимента:
- с образованием подгрупп исследуемых животных;
- без образования подгрупп.
4.1.1. Анализ зависимости "доза-эффект" методом формирования подгрупп
Наиболее распространенный способ определения зависимости "доза-эффект" в группе состоит в формировании в этой группе подгрупп. Животным, входящим в подгруппу токсикант вводят в одинаковой дозе, а в каждой последующей подгруппе доза увеличивается. Формирование подгрупп должно осуществляться методом случайных выборок. С увеличением дозы будет увеличиваться часть животных в каждой из подгрупп, у которых развился оцениваемый эффект. Получаемую при этом зависимость можно представить в виде кумулятивной кривой частот распределения, где количество животных с положительной реакцией на токсикант (часть общего количества животных в подгруппе) является функцией дозы (рис. 9)
Рисунок 9. Типичная кривая доза - эффект для группы животных, симметричная относительно средней точки (50% ответ). Основные значения ответа группы на токсикант сосредоточены вокруг среднего значения.
В большинстве случаев график представляет собой S-образную кривую log-нормального распределения, симметричную относительно средней точки. Можно выделить ряд важных характеристик этой кривой, которые целесообразно учитывать при интерпретации получаемых результатов.
1. Центральная точка кривой (значение 50% ответа) или средняя эффективная доза (ЕД50) - удобный способ характеристики токсичности вещества. Если оцениваемый эффект - летальность животных в группе, эта точка обозначается, как среднесмертельная доза (см. ниже). Эта величина является наиболее точной количественной характеристикой токсичности, поскольку значение 95% доверительного интервала здесь минимальны.
2. Чувствительность большинства животных в популяции близка среднему значению. Интервал доз, включающий основную часть кривой вокруг центральной точки, иногда обозначается как "потенция" препарата.
3. Небольшая часть популяции в левой части кривой "доза-эффект" реагирует на малые дозы токсиканта. Это группа сверхчувствительных или гиперреактивных особей. Другая часть популяции в правой части кривой реагирует лишь на очень большие дозы токсиканта. Это малочувствительные, гипореактивные или резистентные особи.
4. Наклон кривой "доза-эффект", особенно в близи среднего значения, характеризует разброс доз, вызывающих эффект. Эта величина указывает, как велико будет изменение реакции популяции на действие токсиканта с изменением действующей дозы. Крутой наклон указывает на то, что большая часть популяции будет реагировать на токсикант примерно одинаково в узком диапазоне доз, в то время как пологий наклон свидетельствует о существенных различиях в чувствительности особей к токсиканту.
Форма кривой и её экстремальные точки зависят от целого ряда внешних и внутренних факторов, таких как состояние механизмов репарации повреждений, обратимость вызываемых эффектов и т.д. Так, токсический процесс может не развиваться до тех пор пока не истощатся механизмы защиты организма от действующего токсиканта, не наступит насыщение процессов биохимической детоксикации. Точно также насыщение процессов образования токсичных метаболитов из исходного ксенобиотика может явиться причиной выхода кривой "доза-эффект" на плато.
Важным вариантом кривой "доза-эффект" является зависимость, прослеживаемая в генетически гетерогенной группе. Так, в популяции с необычайно высоким количеством особей, у которых генетически закреплена повышенная чувствительность к токсиканту, возможно зарегистрировать в левой части кривой отклонения от типичной S-образной формы (Рис. 10).
 доза доза
Рисунок 10. Вариант кумулятивной кривой "доза-эффект" с выраженным гиперреактивным компонентом
Кривая "доза-эффект" часто преобразуется в линейную зависимость путем её построения в координатах log - пробит (доза токсиканта представляется в логарифмах, выраженность ответной реакции - в пробитах). Это преобразование позволяет исследователю подвергнуть результаты математическому анализу (например, рассчитать доверительный интервал, крутизну наклона кривой и т.д.) (рис. 11).
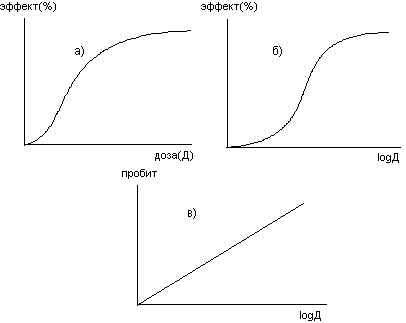
Рисунок 11. Преобразование экспериментальных данных определения зависимости "ДОЗА - ЭФФЕКТ": а) зависимость "ЭФФЕКТ - ДОЗА"; б) зависимость "ЭФФЕКТ - log ДОЗЫ"; в) зависимость "ПРОБИТ ЭФФЕКТА - log ДОЗЫ".
Методом формирования подгрупп можно определить зависимость выраженности оцениваемого эффекта (например, степень падения артериального давления, снижения двигательной активности и т.д.) от действующей дозы токсикант. В этом случае, на основе полученных данных определяют среднюю величину эффекта, развившегося в подгруппе испытуемых на вещество в веденной дозе, и определяют доверительный интервал показателя в каждой точке. Затем строят график зависимости величины эффекта от введенной дозы, путем нахождения аппроксимационной кривой через "облако" точек (рисунок 12).
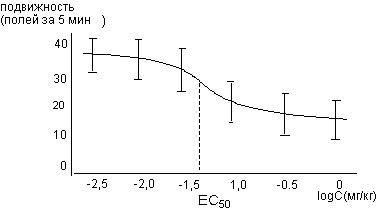
Рисунок 12. Кривая "доза-эффект" для оценки обездвиживающего действия нейролептика пимозида при внутрибрюшинном введении крысам. Каждая точка на графике получена путем регистрации эффектов, полученных у 10 - 20 животных.
4.1.2. Анализ зависимости "доза-эффект" без формирования подгрупп
При изучении действия быстро распределяющихся, но медленно выводящихся из организма веществ можно обеспечить их постепенное внутривенное введение лабораторному животному, до наступления вполне определенного по выраженности токсического эффекта (например, снижение частоты дыхания на 40%). Таким образом, появляется возможность для каждого отдельного организма определить дозу вещества, вызывающую желаемый эффект. Исследование проводится на достаточно большой группе животных. Если построить график зависимости числа животных, у которых эффект развился от величины использованных доз, то получим уже известную S-образную кривую, анализ которой осуществляется по общим правилам.
4.1.3. Зависимость "доза-эффект" по показателю летальность
4.1.3.1. Общие представления
Поскольку смертельный исход после действия токсиканта - альтернативная реакция, реализующаяся по принципу "все или ничего", этот эффект считают наиболее удобным для определения токсичности веществ, его используют для определения величины среднесмертельной дозы (ЛД50).
Определение острой токсичности по показателю "летальность" проводится методом формирования подгрупп (см. выше). Введение токсиканта осуществляется одним из возможных способов (энтерально, парентерально) при контролируемых условиях. При этом необходимо учитывать, что способ введения вещества самым существенным образом сказывается на величине токсичности (таблица 4).
Таблица 4. Влияние способа введения на токсичность зарина и атропина для лабораторных животных
| Токсикант
| Животное
| Способ введения
| Смертельная доза (мг/кг)
| | Зарин
| Крысы
| Подкожно Внутримышечно Внутривенно через рот
| 0,12 0,17 0,05 0,6
| | Атропин
| Мыши
| Внутривенно через рот
| 800 90
| Используются животные одного пола, возраста, веса, содержащихся на определенной диете, при необходимых условиях размещения, температуре, влажности и т.д. Исследования повторяют на нескольких видах лабораторных животных. После введения тестируемого химического соединения проводят наблюдения, определяя количество павших животных, как правило за период 14 суток. В случае нанесения вещества на кожу, совершенно необходимо регистрировать время контакта, а также оговаривать условия аппликации (из замкнутого или открытого пространства осуществлялось воздействие). Очевидно, что степень поражения кожи и выраженность резорбтивного действия являются функцией как количества нанесенного материала, так и продолжительности его контакта с кожей. При всех, помимо ингаляционного, способах воздействия экспозиционная доза обычно выражается как масса (или объем) тестируемого вещества на единицу массы тела (мг/кг; мл/кг).
Для ингаляционного воздействия экспозиционная доза выражается как количество тестируемого вещества, присутствующего в единице объема воздуха: мг/м3 или части на миллион (ppm - parts per million). При этом способе воздействия очень важно учитывать время экспозиции. Чем продолжительней воздействие, тем выше экспозиционная доза, выше потенциал неблагоприятного действия. Получаемая информация о зависимости "доза-эффект" для различных концентраций вещества во вдыхаемом воздухе должна быть получена при одинаковом времени экспозиции. Эксперимент может быть построен и иначе, а именно различные группы экспериментальных животных ингалируют вещество в одинаковой концентрации, но в течение различного времени.
Для приблизительной оценки токсичности ингаляционно действующих веществ, одновременно учитывающей и концентрацию токсиканта и время его экспозиции, принято использовать величину "токсодоза", рассчитываемую по формуле, предложенной Габером в начале века:
W = C t, где
W - токсодоза (мг мин/м3)
С - концентрация токсиканта (мг/м3)
t - время экспозиции (мин)
Предполагается, что при непродолжительной ингаляции веществ одинаковый эффект (гибель лабораторных животных) будет достигаться как при краткой экспозиции высоких доз, так и более продолжительном воздействии веществ в меньших концентрациях, при этом произведение времени на концентрацию для вещества остается неизменным. Наиболее часто к определению токсодоз веществ, прибегали для характеристики боевых отравляющих веществ. Величины токсичности некоторых ОВ представлены на таблице 5.
Таблица 5. Токсодозы отравляющих веществ (при ингаляционном воздействии)
| Вещества
| LCT50 (мг мин/м3)
| | 1. Удушающего действия - хлор - фосген - дифосген - хлорпикрин 2. Общеядовитого действия - мышьяковистый водород - синильная кислота - хлорциан 3. Кожно-нарывного действия а. Соединения мышьяка: - метиларсиндихлорид - этиларсиндихлорид - фениларсиндихлорид - 2-хлорвиниларсиндихлорид б. Иприты: - дихлор-диэтилсульфид - трихлор-триэтиламин 4. Нервно-паралитического действия (ФОВ) - табун - зарин - зоман - Vx
| 19000 3200 3200 800 5000 2000 7000 3000 3000 - 5000 2600 1200 - 1500 1500 1500 400 70 100 100
| (M. Kruger, 1991)
Кривая "доза-летальность" как правило, аналогична по форме кривой распределения кумулятивной частоты эффекта для других зависимостей "доза-эффект" (см. выше). Для целей сравнения получаемых данных и статистической их обработки кривую преобразуют в форму линейной зависимости, используя систему координат "log D - пробит".
Токсичность по показателю "летальность", как правило, устанавливается по определенному уровню гибели животных в группе. Наиболее часто в качестве контрольного уровня используется 50% гибель животных, так как это соответствует медиане кривой распределения дозы, вокруг которой симметрично концентрируется большинство позитивных ответных реакций (см. выше). Эта величина и получила название - среднелетальная доза (концентрация). По определению вещество, действуя в этой дозе, вызывает гибель половины популяции животных.
Концепция определения ЛД50 веществ была впервые сформулирована Trevan в 1927 году. С этого момента начинается становление токсикологии как настоящей науки, оперирующей количественными характеристиками исследуемого свойства (величина токсичности).
В качестве других уровней смертности, подлежащих определению, могут быть выбраны величины ЛД5, ЛД95, которые согласно законам статистики близки соответственно к порогу и максимуму токсического действия и являются границами дозового интервала, в рамках которого, в основном, и реализуется эффект.
По этическим и экономическим соображениям в опыт для определения ЛД50 стараются брать минимальное количество лабораторных животных. В этой связи определение искомой величины всегда сопряжено с фактором неопределенности. Эта неопределенность учитывается путем нахождения 95% доверительного интервала определяемой величины. Дозы, попадающие в этот интервал, не являются среднесмертельными лишь с вероятностью менее 5%. Доверительный интервал величины ЛД50 значительно меньше, чем доверительные интервалы доз других уровней летальности, что является дополнительным аргументом в пользу именно этой характеристики параметров острой токсичности.
Как уже указывалось важной характеристикой любой кривой "доза-эффект" является её крутизна. Так, если два вещества имеют статистически не различимые значения величин ЛД50 и одинаковую крутизну кривой токсичности "доза-эффект" (т.е. статистически не различимые величины значений соответственно ЛД16 и ЛД84), они, по показателю летальность - эквитоксичны в широком диапазоне доз (вещества А и В на рис. 13). Однако вещества, имеющие близкие значения величин ЛД50, но различную крутизну кривой токсичности существенно отличаются по своим токсическим свойствам (вещество С на рис. 13).
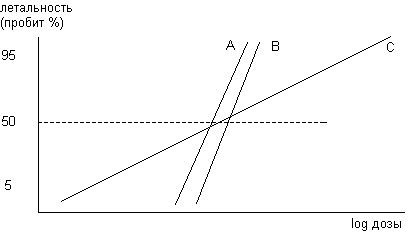
Рисунок 13. Зависимости "доза-эффект" токсикантов с близкими значениями величин ЛД50, но различной крутизной наклона
Вещества с пологой зависимостью "доза-эффект" представляют большую опасность для лиц с выраженной гиперчувствительностью к токсикантам. Вещества с высокой крутизной зависимости более опасны для всего населения, поскольку даже несущественное увеличение доза по сравнению с минимально действующей приводит к развитию эффекта у большинства популяции.
4.1.3.2. Определение безопасных доз действия токсикантов
В ряде случаев возникает необходимость количественно определить величину максимальной недействующей (безопасной) дозы токсикантов.
Методика решения этой задачи предложена Годдам. Исследование строится на установлении зависимости "доза-эффект" в группе животных. Желательно, чтобы оцениваемый эффект был достаточно чувствительным и оценивался не в альтернативной форме (например снижение активности энзима, подъем артериального давления, замедление роста, нарушение кроветворения и т.д.). График зависимости строится в координатах "логарифм дозы - выраженность эффекта". Анализ кривой позволяет оценить ряд показателей. Поскольку кривая, как правило, имеет S-образную форму, вычленяют участок, в пределах которого зависимость носит линейный характер. Определяют крутизну прямой (b). Пороговый эффект (yS) определяют по формуле: yS = tS, где t - коэффициент Стьюдента, определяемый по соответствующим таблицам; S - величина стандартного отклонения, определяемая из данных опта. Пороговая доза (DS) - это такая доза, действуя в которой вещество вызывает пороговый эффект. Для безопасной дозы (DI) имеем
log DI = log DS - 6(S/b)
Пример, представленный на рисунке 14, комментирует определение безопасной дозы.

Рисунок 14. Графический метод определения порога безопасного действия ксенобиотика.
Пример. В течение нескольких недель крысам в корм добавляли систокс (инсектицид) в различных концентрациях (части на миллион по массе). Эффект оценивали по степени угнетения активности холинэстеразы крови. Каждая точка на графике представляет собой среднюю величину из 6 - 12 наблюдений. На графике рисунка 14 по оси "у" представлены данные о различии активности энзима у интактных и экспериментальных животных (в относительных единицах от 0 до 1,0); по оси "х" - логарифм концентрации токсиканта. Как следует из полученных данных, начиная с определенной дозы (концентрации) зависимость приобретает линейный характер. Крутизна прямой (b) равна - 0,66; среднее значение всех стандартных отклонений в отдельных группах S = 0,097; t - 2. Отсюда пороговый эффект yS = 2 х 0,097 = 0,194. Соответствующее значение DS, как следует из графика, равно 0,42. Тогда имеем: log DI = 0,42 - 6(0,097/0,66) = -0,462. Таким образом, безопасное (недействующее) содержание систокса в пище составляет 0,34 части на миллион.
4.1.3.3. Интерпретация и практическое использование результатов
Как правило, основной вывод, который делает токсиколог при установлении позитивной зависимости "доза-эффект", состоит в том, что между воздействием исследуемого вещества и развитием токсического процесса существует причинно-следственная связь. Однако информация о зависимости должна интерпретироваться только относительно условий, в которых она получена. Большое количество факторов влияет на её характер, причем специфично для каждого вещества и биологического вида, на представителей которого вещество действует. В этой связи необходимо учитывать ряд обстоятельств:
1. Точность количественной характеристики значения ЛД50 достигается путем тщательного проведения эксперимента и адекватной статистической обработки получаемых результатов. Если при повторении эксперимента по определению токсичности получают количественные данные, отличные от ранее полученных, это может быть следствием вариабильности свойств использованного биологического объекта и условий окружающей среды.
2. Важнейшей характеристикой опасности вещества является время наступления смерти после воздействия токсиканта. Так, вещества с одинаковым значением ЛД50, но разным временем наступления смерти могут представлять различную опасность. Быстро действующие вещества часто рассматриваются как более опасные. Однако вещества "замедленного действия" с очень продолжительным скрытым периодом часто склонны к кумуляции в организме и в силу этого также чрезвычайно опасны. К числу быстро действующих токсикантов относятся боевые отравляющие вещества (ФОВ, синильная кислота, вещества раздражающего действия и т.д.). Вещества замедленного действия - это полигалогенированные полициклические углеводороды (галогенированные диоксины, дибензофураны и т.д.), некоторые металлы (кадмий, талий, ртуть и т.д.) и многие другие.
3. Более полная интерпретация полученных результатов по оценке токсичности, помимо определения количественных характеристик, требует детального изучения причин смерти (см. соответствующий раздел). Если вещество может вызвать различные потенциально смертельные эффекты (остановка дыхания, остановка сердечной деятельности, коллапс и т.д.), необходимо представлять какой из эффектов является ведущим, а также может ли этот феномен стать причиной усложнения зависимости "доза-эффект". Например, различные биологические эффекты могут быть причиной гибели в острой и отставленной фазе интоксикации. Так, интоксикация дихлорэтаном уже в первые часы может привести экспериментальное животное к гибели вследствие угнетения ЦНС (наркотический, неэлектролитный эффект). В поздние периоды интоксикации животное погибает от острой почечной и печеночной недостаточности (цитотоксический эффект). Очевидно это имеет значение и при определении количественных характеристик токсичности. Так, трет-бутилнитрит при внутрибрюшинном введении мышам и регистрации смертельного эффекта в течение 30 минут имеет величину ЛД50 равную 613 мг/кг; при регистрации смертельных случаев в течение 7 суток, ЛД50 составляет 187 мг/кг. Смерть в первые минут, по-видимому, наступает в результате ослабления тонуса сосудов и метгемоглобинообразования, в позднем периоде, от поражения печени.
4. Величина ЛД50, полученная в остром опыте, не является характеристикой токсичности вещества при его многократном подостром или хроническом воздействии. Так, для веществ с высокой способностью к кумуляции, значение смертельной концентрации токсиканта в среде, определенное при однократном введении, может оказаться существенно выше концентрации, вызывающей смерть при длительном воздействии. Для слабо кумулирующих веществ эти различия могут быть не столь существенными.
На практике данные о зависимости "доза-эффект" и значения величин ЛД50 часто используют в следующих ситуациях:
1. Для характеристики острой токсичности веществ в ходе рутинных токсикологических исследований и сравнения токсичности нескольких химических соединений.
На основе полученных характеристик ксенобиотик может быть отнесен к одному из четырех классов токсичности (Таблица 6).
Таблица 6. Классификация ксенобиотиков по степени токсичности
| Степень токсичности
| Энтеральное введение
| Ингаляционное введение
| |
| ЛД50 (мг/кг)
| ЛК50 (мг/л)
| ПДК (мг/м3)
| | Чрезвычайно токсичные Высокотоксичные Умеренно токсичные Малотоксичные
| менее 15 15 - 150 151 - 1500 более 1500
| Менее 1 1 - 10 11 - 40 более 40
| менее 1 10 100 более 100
| (Заугольников С.Д. и соавт., 1967)
Отнесение веществ к мало- или высокотоксичным во многом носит субъективный характер. Так, Hodg G. и Gleason S. (1975) предлагают иную шкалу токсичности ксенобиотиков (таблица 7).
Таблица 7. Шкала токсичности (смертельное действие) веществ, при их поступлении через рот (По Hodg G., Gleason S., 1975)
| Степень токсичности
| Сухое вещество (мг/кг)
| Жидкое вещество (на человека)
| | Сверхтоксичные Высокотоксичные Токсичные Умеренно токсичные Малотоксичные Нетоксичные
| менее 5 5 - 50 50 - 500 500 - 5000 5000 - 15000 более 15000
| менее 7 капель 7 капель - ложка ложка - рюмка (30 мл) 30 мл - 0,5 л 0,5 л - 2 л более 2 л
| В настоящее время в России химические вещества принято разделять на 4 класса опасности (таблица 8).
Таблица 8. Классификация химических веществ по степени опасности (ГОСТ 12.1.007-76)
| Показатели
| Класс опасности
| |
|
|
|
|
| | ПДК мг/м3
| <0,1
| 0,1-1,0
| 1,1-10,0
| >10,0
| | ЛД50 p/o мг/кг
| <15
| 15-150
| 151-5000
| <5000
| | ЛД50 р/cut мг/кг
| <100
| 100-500
| 501-2500
| <2500
| | ЛК50/2 час мг/м3
| <500
| 500-5000
| 5001-50000
| <50000
| | КВИО*
| >300
| 300-30
| 29-3
| >3
| · КВИО - коэффициент возможности ингаляционного отравления. Определяют, как отношение максимально возможной концентрации токсиканта (пара) в воздухе, к среднесмертельной концентрации
2. Для определения уровней безопасного воздействия токсиканта. Для большинства веществ можно определить дозы, при уменьшении которых, вещества утрачивают способность инициировать токсический процесс. Доза, ниже которой современными методами исследования не выявляется действие химического вещества на биологический объект (организм), называется "пороговой дозой". Концепция пороговости полезна тем, что на её основе с помощью специальных методов определяют, а затем оценивают и юридически утверждают дозы веществ, признаваемые безопасными для человека в условиях повседневной жизни, производства, специальных ситуаций (аварии) - ПДК, МДК, ОБУВ и т.д.
На основе экспериментальных данных по определению зависимости "доза-эффект" также устанавливаются (с учетом представлений о допустимом риске)(см. ниже) пределы допустимого воздействия токсикантов, способных вызывать "беспороговые" эффекты.
3. Для первичной характеристики эффективности специфических противоядий. В ходе подобных исследований обычно устанавливают соотношение параметров кривых зависимости "доза-эффект", полученных в условиях изолированного действия токсиканта и на фоне примененного противоядия (см. ниже).
Дата добавления: 2015-02-06 | Просмотры: 1301 | Нарушение авторских прав
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | 119 | 120 | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 | 173 | 174 | 175 | 176 | 177 | 178 | 179 | 180 | 181 | 182 | 183 | 184 | 185 | 186 | 187 | 188 | 189 | 190 | 191 | 192 | 193 | 194 | 195 | 196 | 197 | 198 | 199 | 200 | 201 | 202 | 203 | 204 | 205 | 206 | 207 | 208 | 209 | 210 | 211 | 212 | 213 | 214 | 215 | 216 | 217 | 218 | 219 | 220 | 221 | 222 | 223 | 224 | 225 | 226 | 227 | 228 | 229 | 230 | 231 | 232 | 233 | 234 | 235 | 236 | 237 | 238 | 239 | 240 | 241 | 242 | 243 | 244 | 245 | 246 | 247 | 248 | 249 | 250 | 251 | 252 | 253 | 254 | 255 | 256 | 257 | 258 | 259 | 260 | 261 | 262 | 263 | 264 | 265 | 266 | 267 | 268 | 269 | 270 | 271 | 272 | 273 | 274 | 275 | 276 | 277 | 278 | 279 | 280 | 281 | 282 | 283 | 284 | 285 | 286 | 287 | 288 | 289 | 290 | 291 | 292 | 293 | 294 | 295 | 296 | 297 | 298 | 299 | 300 | 301 | 302 | 303 | 304 | 305 | 306 | 307 | 308 | 309 | 310 | 311 | 312 | 313 | 314 | 315 | 316 | 317 | 318 | 319 | 320 | 321 | 322 | 323 | 324 | 325 | 326 | 327 | 328 | 329 | 330 | 331 | 332 | 333 | 334 | 335 | 336 | 337 | 338 | 339 | 340 | 341 | 342 | 343 | 344 | 345 | 346 | 347 | 348 | 349 | 350 | 351 | 352 | 353 | 354 | 355 | 356 | 357 | 358 | 359 | 360 | 361 | 362 | 363 | 364 | 365 | 366 | 367 | 368 | 369 | 370 | 371 | 372 | 373 | 374 | 375 | 376 | 377 | 378 | 379 | 380 | 381 | 382 | 383 | 384 | 385 | 386 | 387 | 388 | 389 | 390 | 391 | 392 | 393 | 394 | 395 | 396 | 397 | 398 | 399 | 400 | 401 | 402 | 403 | 404 | 405 | 406 | 407 | 408 | 409 | 410 | 411 |
|

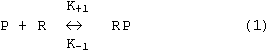
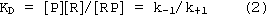

 (S) =
(S) =  ), величина которой обратно пропорциональна концентрации рецепторов в системе
), величина которой обратно пропорциональна концентрации рецепторов в системе
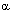 Е)
Е) -галогеналкиламины), другие антихолинергические препараты (атропин), конкурентные миорелаксанты, местные анестетики и многие другие вещества, изменяют вид кривой "доза-эффект" для агонистов, превращая её из S-образной в гиперболическую.
-галогеналкиламины), другие антихолинергические препараты (атропин), конкурентные миорелаксанты, местные анестетики и многие другие вещества, изменяют вид кривой "доза-эффект" для агонистов, превращая её из S-образной в гиперболическую.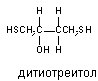







 доза
доза


