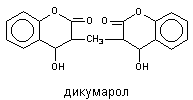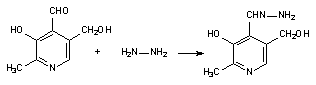|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Угнетение каталитической активностиСнижение активности энзимов при действии токсикантов может быть следствием трех эффектов: подавления процессов синтеза апофермента и кофакторов, активации разрушения, угнетения специфической активности. К числу наиболее распространенных кофакторов, помимо металлов, относятся железопорфирины, флавины, никотинамид-адениндинуклеотид (НАД), пиридоксальфосфат, тиаминпирофосфат и др. Отчасти эти вещества синтезируются в организме животных и человека, отчасти попадают с пищей в форме витаминов. Некоторые вещества являются конкурентами кофакторов энзимов. Так, дикумарол конкурентно препятствует утилизации печенью витамина К, необходимого для синтеза протромбина, поэтому через 24 - 96 ч после поступления вещества в организм в токсических дозах возможно развитие кровотечений угрожающих жизни.
Некоторые токсиканты нарушают образование коферментов, предшественники которых поступают в организм с пищей. Так, гидразин и его производные, взаимодействуя с пиридоксалем, содержащимся в клетках, образуют пиридоксальгидразоны (рисунок 2), которые, в свою очередь, угнетают активность пиридоксалькиназы и блокируют тем самым синтез в организме пиридоксальфосфата. В итоге понижается активность большого числа энзимов, кофактором которых является пиридоксальфосфат (декарбоксилазы, трансаминазы и т.д.).
Рисунок 2. Взаимодействие гидразина с пиридоксалем с образованием пиродоксальгидразона К числу полностью синтезируемых в организме кофакторов относятся железопорфирины. Блокада их синтеза приводит к тяжелым последствиям. Так, хроническое отравление свинцом сопровождается нарушением синтеза гема, вследствие чего развивается дефицит гемопротеинов (гемоглобина, миоглобина, гем-содержащих энзимов). Активация процесса разрушения энзимов токсикантами, как механизм их токсического действия, встречается редко. Катаболизм некоторых энзимов усиливается на фоне хронической интоксикации стероидными препаратами и их аналогами. Наиболее часто в основе интоксикации лежит угнетение токсикантом специфической активности энзимов. Выделяют следующие механизмы ингибиторного действия ксенобиотиков: 1. Конкурентное ингибирование. В основе взаимодействия лежит конкуренция токсиканта с субстратом за активный центр энзима. При этом реализуются две возможности: а) токсикант вступает в превращение вместо субстрата (конкурентные субстраты). Так, некоторые эфиры холина (пропионилхолин, бутирилхолин и др.) гидролизуются ацетилхолинэстеразой вместо ацетилхолина. Конкурентным ингибитором аконитазы, одного из энзимов цикла трикарбоновых кислот, участвующих в превращении лимонной кислоты в аконитовую, является фторлимонная кислота, образующаяся в процессе метаболических превращений опасного токсиканта фторуксусной кислоты (рисунок 3);
Рисунок 3. Превращение фторуксусной кислоты во фторлимонную в процессе метаболизма в цикле трикарбоновых кислот (ЦТК) б) взаимодействие токсиканта с активным центром не приводит к его метаболизму (стабильные ингибиторы). Примерами таких токсикантов являются карбаматы - ингибиторы холинэстеразы. Конкурентный тип ингибирования развивается также при образовании прочных ковалентных связей между токсикантами и активными центрами некоторых энзимов. Этот вид ингибирования приводит к полному прекращению ферментативной активности. Таким способом фосфорорганические соединения взаимодействуют с ацетилхолинэстеразой. Часто, конкурентные ингибиторы энзимов структурно напоминают их субстраты. 2. Неконкурентное ингибирование. В данном случае токсикант взаимодействует с добавочным, аллостерическим, центром энзима, изменяя при этом конформацию активного центра и снижая, тем самым, его сродство к субстрату. Таким способом упомянутая выше фторлимонная кислота угнетает активность транслоказы, фермента, обеспечивающего активный транспорт цитрата через мембраны митохондрий, а мышьяк и его соединения - SH-содержащие энзимы. 3. Прочие. Для осуществления ферментативной активности энзимы нуждаются в присутствии в среде ионов металлов: Mg2+, Ca2+, K+, Mn2+, Zn2+, Co2+ и др. Связывание этих металлов токсикантами приводит к угнетению активности. Таков механизм токсического действия комплексообразователей (ЭДТА, ДТПА, дитизона и др.), салициловой кислоты и др. Особое токсикологическое значение имеют вещества, взаимодействующие с железом, кобальтом, медью, входящими в структуру более сложных простетических групп энзимов (гем-содержащие энзимы, цитохромы, каталаза, пероксидаза, гемоглобин, миоглобин). К числу подобных токсикантов относятся цианиды, сульфиды, азиды, монооксид углерода и др. Некоторые энзимы находятся под постоянным контролем специальных кооперационных систем. Так, система GSH/GSSG (восстановленный/окисленный глутатион) регулирует активность SH-энзимов (пирофосфатаза, фосфоглицеральдегид-дегидрогеназа, гемоглобин-редуктаза и др.). Токсиканты, понижающие содержание восстановленного глютатиона в тканях, такие как гидроксиламин, фенилгидразин, дихлорэтан и др., подавляют активность этих ферментов. Одна из патохимических классификаций преимущественно ферментных ядов разработана А.А. Покровским (1962) (таблица 2). Таблица 2. Патохимическая классификация ядов
Дата добавления: 2015-02-06 | Просмотры: 1612 | Нарушение авторских прав |