 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Селективные рецепторы клеточных мембранСелективные рецепторы клеточных мембран - это протеины, встроенные в липидные бислои. Гидрофобный участок - формирующие ионные каналы; - связанные с G-протеинами; - обладающие тирозинкиназной активностью; - образующие межрецепторные сети. 1. Рецепторы формирующие ионные каналы. Эти рецепторы участвуют в передаче нервных импульсов в центральной нервной системе и на периферии. Обычно рецепторы данного типа состоят из нескольких субъединиц пронизывающих всю толщу биологической мембраны. Одна - две из этих субъединиц представляют собой собственно рецепторную область, связывающуюся с лигандом. Другие субъединицы после взаимодействия рецепторной области с лигандом изменяют свою конформацию и участвуют тем самым в формировании ионного канала. К числу известных каналобразующих рецепторов относятся никотинчувствительный рецептор ацетилхолина (Н-холинорецептор), ГАМК-ергический, глицинергический рецепторы. Первый из упомянутых является каналом для ионов Na+, два других - для ионов Cl-. Известно большое количество веществ, действующих на эти рецепторы. Например, курарин, никотин, анабазин (действуют на холинорецепторы), бициклофосфаты, норборнан, пикротоксинин (действуют на ГАМК-рецепторы), стрихнин (действует на рецепторы к глицину). К этой же группе рецепторов можно отнести Na+-, К+, Ca2+- каналы возбудимых мембран, для которых пока не найдены эндогенные химические агонисты. Тем не менее, ионные каналы имеют рецепторную область связывания высокотоксичных ядов животного происхождения, таких как тетродотоксин, сакситоксин, батрахотоксин и др. Первым из достаточно изученных каналобразующих рецепторов был никотинчувствительный рецептор ацетилхолина. Этот рецептор состоит из четырех типов субъединиц, из которых ацетилхолинсвязывающая Клонирование и секвенирование генов, ответственных за синтез субъединиц никотинового рецептора, выделенного из различных органов животных одного вида и органов разных видов, позволили высказать предположение об эволюционной близости их происхождения. Об этом же свидетельствует и то обстоятельство, что не смотря на имеющиеся различия строения рецепторной области Н-холинорецепторов, выделенных из разных органов и тканей животных различных видов, их чувствительность к ацетилхолину, его агонистами и антагонистам различается несущественно. 2. Рецепторы, связанные с G-протеинами. Особый вариант передачи регуляторных сигналов представлен механизмом взаимодействия эндогенных лигандов с рецепторами, ассоциированными с G-протеинами (регуляторными протеинами). В этом случае сигналы, вызванные действием лиганда, приводят к конформационным изменениям рецепторного белка, затем переносятся на белки сопряжения, которые в свою очередь, уже или стимулирует или угнетает эффекторную систему в целом. Белки сопряжения в ходе передачи сигнала связывают молекулу гуанозинтрифосфата (ГТФ) и расщепляют её не гуанозиндифосфат и фосфат (отсюда название - G-протеины). Стимулирующие G-протеины (GS), активируют в ходе передачи сигнала аденилатциклазу клеток-эффекторов, а ингибиторные (GI) - угнетают этот энзим. Поскольку G-протеины расщепляют ГТФ, они называются также ГТФ-азами. К числу рецепторов такого типа относятся в частности мускаринчувствительные холинэргические рецепторы (М-холинорецепторы), Комплекс G-протеинов состоит из трех субъединиц. Наибольшая, с молекулярной массой 40000, называется Функционирование системы передачи сигнала с помощью G-протеинов наилучшим образом изучено на примере
Рисунок 5. Схема проведения сигнала, через систему рецептора связанного с G-протеинами В невозбужденном состоянии Токсиканты могут модифицировать описанный процесс на любом из этапов проведения сигнала. Например, холерный и коклюшный токсины вызывают АДФ-рибозилирование GS-протеина после его связывания с молекулой ГТФ. В итоге развивается стойкая активация аденилатциклазы и перевозбуждение соответствующих клеток слизистых оболочек. В настоящее время известно огромное количество веществ синтетических и естественного происхождения, избирательно взаимодействующих с рецепторами данного типа. Среди них многочисленные лекарственные средства (действующие на холинэргические, катехоламинергические, серотонинергические синапсы), интоксикация которыми развивается как при перевозбуждении, так и блокаде рецепторов (см. курс фармакологии). Сюда же относится большая группа веществ, обладающих психодислептической активностью (диэтиламид лизергиновой кислоты, псилоцин, псилоцибин, буфотенин, мескалин, хинуклидинилбензилат - BZ и т.д.). 3. Рецепторы с тирозинкиназной активностью. К рецепторам данного типа относятся, в частности, рецепторы к инсулину и гормону роста. Эти рецепторы состоят из одной или двух белковых субъединиц, закрепленных в липидном бислое с помощью пептидной После взаимодействия с лигандом рецепторная молекула частично погружается в клетку. При этом активируется тирозинкиназная активность специальной субъединицы рецептора, либо энзима, тесно связанного с ним. Пусковым сигналом процессов, приводящих к активации клетки, является фосфорилирование внутриклеточных белков (по молекуле тирозина). Токсиканты, избирательно действующие на данный тип рецепторов, пока не известны. 4. Рецепторы, образующие межрецепторные сети. В отличии от других мембраносвязанных рецепторов, связывание с лигандом в данном случае не приводит непосредственно к передаче сигнала на эффекторную систему. Процесс восприятия сигнала связан с образованием межрецепторных цепей на поверхности клеток. Наилучшим образом в группе рецепторов данного типа изучены рецепторы к Fc-фрагменту (fragment crystalline) антител (иммуноглобулинов). Эти рецепторы представляют собой агрегаты двух или более белковых субъединиц, молекулярная масса которых составляет около 30000 - 50000. Особое патофизиологическое значение имеет образование межрецепторных сетей IgE-Fc-рецепторов, поскольку это явление, наступающее вследствие связывания антигена с молекулами фиксированных на мембранах тучных клеток антител, приводит к взрывоподобному экзоцитозу гистамин-содержащих гранул. Экзоцитоз биологически активных веществ, и в частности, гистамина из тучных клеток - основа анафилактических реакций (см. ниже). Дата добавления: 2015-02-06 | Просмотры: 1259 | Нарушение авторских прав |
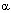 -спирали белков обеспечивает их прочную связь с мембраной. Гидрофильный участок располагается за пределами липидного бислоя. Именно этот фрагмент белка обеспечивает связь рецептора с лигандом, то есть формирует собственно рецепторную область. Выделяют следующие типы селективных рецепторов мембран:
-спирали белков обеспечивает их прочную связь с мембраной. Гидрофильный участок располагается за пределами липидного бислоя. Именно этот фрагмент белка обеспечивает связь рецептора с лигандом, то есть формирует собственно рецепторную область. Выделяют следующие типы селективных рецепторов мембран: -адренорецепторы и т.д. Гены, контролирующие синтез белковых субъединиц этих рецепторов клонированы и секвенированы. Мускаринергический и адренергический рецепторы образованы белковой молекулой, закрепленной в клеточной мембране с помощью 7 трансмембранных участков пептидной
-адренорецепторы и т.д. Гены, контролирующие синтез белковых субъединиц этих рецепторов клонированы и секвенированы. Мускаринергический и адренергический рецепторы образованы белковой молекулой, закрепленной в клеточной мембране с помощью 7 трансмембранных участков пептидной  -субъединицы (ММ около 10000) практически ничего не известно.
-субъединицы (ММ около 10000) практически ничего не известно.