|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
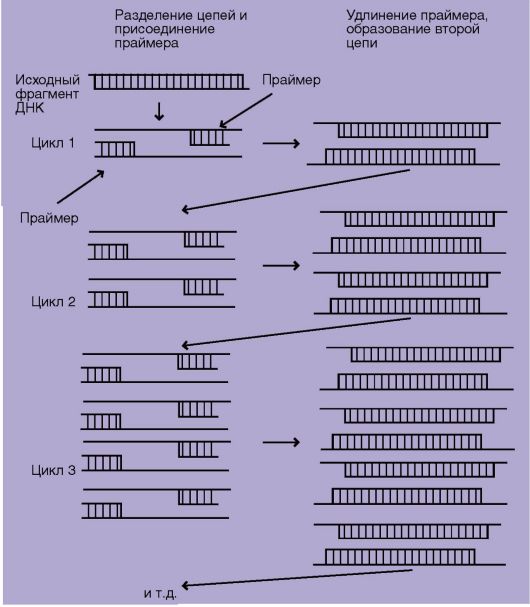
Полимеразная цепная реакцияВ генетических исследованиях в ряде случаев необходимо изучить небольшой фрагмент ДНК. Для этого должно быть достаточное количество копий фрагмента, т.е. фрагмент необходимо «размножить», или амплифицировать. Полимеразная цепная реакция (ПЦР) (рис. 2) - метод амплификации фрагментов ДНК in vitro, позволяющий получить огромное число копий за счет постоянно повторяющихся циклов синтеза исследуемого фрагмента ДНК.
Рис. 2. Схема полимеразной цепной реакции (ПЦР) [Mullis K., 1990] Для проведения ПЦР необходимы: исследуемый фрагмент ДНК, два искусственно синтезированных праймера - олигонуклеотидных последовательностей ДНК длиной до 30 нуклеотидов, четыре вида дезоксирибонуклеотидов и термостабильная ДНК-полимераза, сохраняющая свою активность при температуре 94 °С. ПЦР состоит из повторяющихся циклов, в каждом из которых выделяют три этапа. На первом этапе исходный фрагмент молекулы ДНК нагревают до температуры 94 °С. В результате водородные связи, соединяющие комплементарные цепи, разрушаются и образуются одноцепочечные формы. На втором этапе реакционную смесь охлаждают до температуры 37-68 °С в присутствии двух праймеров. Один праймер комплементарен участку ДНК слева от изучаемого фрагмента, второй - участку другой нити справа от изучаемого фрагмента. Праймеры ориентированы З'-концами навстречу друг другу. Длина амплифицируемого фрагмента определяется расстоянием между праймерами. На третьем этапе при участии ДНК-полимеразы происходит синтез последовательности, комплементарной матричной ДНК при температуре 72 °С. В следующем цикле реакционную смесь с полученными нитями ДНК вновь прогревают, и синтезированные нити ДНК используют в качестве матрицы. Новые праймеры гибридизируются с соответствующими участками, и происходит синтез новых цепей. При последующем изучении амплифицированных фрагментов ДНК путем электрофореза в агарозном или акриламидном геле возможно выявление мутаций. Электрофорез позволяет разделить фрагменты ДНК с разной молекулярной массой. Небольшие по размеру и молекулярной массе фрагменты продвигаются легче сквозь поры в геле, и длина пробега у них будет больше по сравнению с крупными. Если происходит мутация, связанная с изменением длины фрагмента ДНК - делеция или инсерция, то на электрофореграмме выявляется изменение положения фрагмента по сравнению с нормой (рис. 3).
Рис. 3. Схема опыта по анализу фрагментов ДНК: М - маркер молекулярной массы фрагментов ДНК; 1 - нормальный образец ДНК; 2 - изучаемый мутантный образец ДНК Дата добавления: 2014-12-11 | Просмотры: 983 | Нарушение авторских прав |