ОБЩАЯ ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ
ПОВРЕЖДЕНИЕ
В патологии под повреждением, или альтерацией (от лат. altera-
tio — изменение), понимают изменения структуры клеток, межклеточного ве-
щества, тканей и органов, которые сопровождаются нарушением их жизнедея-
тельности. Альтеративные изменения в органах и тканях как филогенетически
наиболее древний вид реактивных процессов встречаются на самых ранних
этапах развития человеческого зародыша.
Повреждение способны вызывать самые разнообразные причины. Они мо-
гут действовать на клеточные и тканевые структуры непосредственно или
опосредованно (через гуморальные и рефлекторные влияния), причем харак-
тер и степень повреждения зависят от силы и природы патогенного фактора,
структурно-функциональных особенностей органа или ткани, а также от реак-
тивности организма. В одних случаях возникают поверхностные и обратимые
изменения, касающиеся обычно лишь ультраструктур, в других — глубокие
и необратимые, которые могут завершиться гибелью не только клеток и тка-
ней, но и целых органов.
Повреждение может быть представлено двумя патологическими процесса-
ми — дистрофией и некрозом, которые нередко являются последовательными
стадиями.
ДИСТРОФИЯ
ОБЩИЕ СВЕДЕНИЯ
Дистрофия (от греч. dys — нарушение и trophe — питаю) — сложный
патологический процесс, в основе которого лежит нарушение тканевого (кле-
точного) метаболизма, ведущее к структурным изменениям Поэтому дистро-
фии рассматриваются как один из видов повреждения. Употреблявшийся ра-
нее для обозначения дистрофического процесса термин «дегенерация» (от лат.
degenerare — перерождение) не отражает его сущности.
Под трофикой понимают совокупность механизмов, определяющих мета-
болизм и структурную организацию ткани (клетки), которые необходимы для
отправления специализированной функции. Среди этих механизмов выделяют
клеточные и внеклеточные (рис. 1). Клеточные механизмы обеспечи-
ваются структурной организацией клетки и ее ауторегуляцией. Это значит,
что трофика клетки в значительной мере является свойством самой клетки
как сложной саморегулирующейся системы. Жизнедеятельность клетки обес-
печивается «окружающей средой» и регулируется с помощью ряда систем ор-
ганизма. Поэтому внеклеточные механизмы трофики располагают транс-
портными (кровь, лимфа, микроциркуляторное русло) и интегративными
(нейроэндокринные, нейрогуморальные) системами ее регуляции.
Из сказанного становится понятным, что непосредственной причинойразви-
тия дистрофий могут служить нарушения как клеточных, так и внеклеточных
механизмов, обеспечивающих трофику.
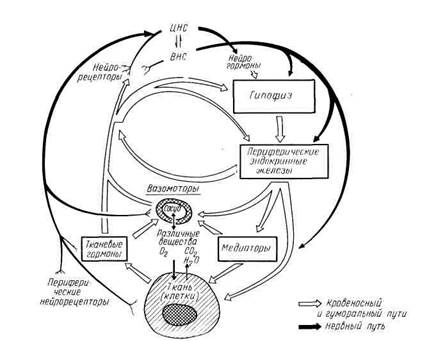
Рис. I. Механизмы регуляции трофики (по М. Г. Балш).
1. Расстройства ауторегуляции клетки, которые могут быть
вызваны различными факторами (гиперфункция, токсические вещества, радиа-
ция, наследственная недостаточность или отсутствие фермента и т. д.), ведут
к энергетическому ее дефициту и к нарушению фермента-
тивных процессов в клетке. Ферментопатия, или энзимопатия
(приобретенная или наследственная), становится основным патогенетическим
звеном и выражением дистрофии при нарушениях клеточных механизмов
трофики.
Концепция наследственных ферментопатий принадлежит французскому исследователю Гар-
ро, который рассматривал наследственные нарушения обмена как состояния, при которых из-за
отсутствия определенного фермента блокируется соответствующее звено реакции, составляющей
часть метаболического пути. В результате этого продукты обмена, образовавшиеся до блокиро-
ванной реакции, накапливаются в клетках и тканях, а метаболиты, которые должны были бы
образоваться на последующих этапах, не образуются.
В настоящее время известно много процессов и болезней, относящихся к наследственным
ферментопатиям и называемых болезнями накопления, или тезаурисмозами
(от греч. tesauros — запас). Вместе с тем природа нарушений, лежащих в основе ферментопатий не-
однозначна. В одних случаях механизм заключается в синтезе ферментного белка с измененной
структурой, каталитические свойства которого нарушены, в других — в синтезе варианта фер-
мента, который нестоек и быстро распадается, в третьих — может иметь место полное прекра-
щение синтеза ферментного белка.
2. Нарушения работы транспортных систем, обеспечиваю-
щих метаболизм и структурную сохранность тканей (клеток), вызывает ги-
поксию, которая является ведущей в патогенезе дисциркуляторных
дистрофий.
З.При расстройствах эндокринной регуляции трофики
(тиреотоксикоз, диабет, гиперпаратиреоз и т. д.) можно говорить об эндо-
кринных, а при нарушении нервной регуляции трофики (нарушен-
ная иннервация, опухоль головного мозга и т. д.) — о нервных, или цере-
бральных, дистрофиях.
Особенности патогенеза внутриутробных дистрофий опреде-
ляются непосредственной связью их с болезнями матери. В исходе при гибели
части зачатка органа или ткани может развиться необратимый порок
развития.
При дистрофиях в клетках и (или) межклеточном веществе накапливаются
различные продукты' обмена (белки, жиры, углеводы, минералы, вода), ко-
торые характеризуются количественными или качественными изменениями
в результате нарушения ферментативных процессов.
Среди морфогенетических механизмов, ведущих к развитию характерных
для дистрофий изменений, различают инфильтрацию, декомпозицию (фане-
роз), извращенный синтез и трансформацию. Инфильтрация — избыточ-
ное проникновение продуктов обмена из крови и лимфы в клетки или межкле-
точное вещество с последующим их накоплением в связи с недостаточностью
ферментных систем, метаболизирующих эти продукты. Таковы, например, ин-
фильтрация грубодисперсным белком эпителия проксимальных канальцев
почек при нефротическом синдроме, инфильтрация холестерином, его эфи-
рами и липопротеидами интимы аорты и крупных артерий при атеро-
склерозе.
Декомпозиция (фанероз) — распад ультраструктур клеток и меж-
клеточного вещества, ведущий к нарушению тканевого (клеточного) метабо-
лизма и накоплению продуктов нарушенного обмена в ткани (клетке). Таковы
жировая дистрофия кардиомиоцитов при дифтерийной интоксикации, фибри-
ноидное набухание соединительной ткани при ревматических болезнях.
Извращенный синтез — это синтез в клетках или в тканях веществ,
не встречающихся в них в норме. К ним относятся: синтез аномального белка
амилоида в клетке и аномальных белково-полисахаридных комплексов ами-
лоида в межклеточном веществе; синтез белка алкогольного гиалина гепато-
цитом; синтез гликогена в эпителии узкого сегмента нефрона при сахарном
диабете.
Трансформация — образование продуктов одного вида обмена из об-
щих исходных продуктов, которые идут на построение белков, жиров, и угле-
водов. Гакова, например, трансформация компонентов жиров и углеводов
в белки, усиленная полимеризация глюкозы в гликоген и др.
Инфильтрация и декомпозиция — ведущие морфогенетические механизмы
дистрофий — часто являются последовательными стадиями в их развитии. Од-
нако в некоторых органах и тканях в связи со структурно-функциональными
их особенностями преобладает какой-либо один из морфогенетических меха-
низмов (инфильтрация — в эпителии почечных канальцев, декомпозиция — в
клетках миокарда), что позволяет говорить об ортологии (от греч. ort-
hos — прямой, типичный) дистрофий.
Морфологическая специфика дистрофий при изучении их на разных уров-
нях — ультраструктурном, клеточном, тканевом, органном — проявляется не-
однозначно. Ультраструктурная морфология дистрофий не
имеет какой-либо специфики, однако возможность выявления ряда продуктов
обмена (липиды, гликоген, ферритин) позволяет говорить об" ультраструк-
турных изменениях, характерных для того или иного вида дистрофий.
Это связано с тем, что изменения органелл клеток различных органов и тканей при разных
воздействиях однотипны. Правда, степень этих изменений в одной клетке и особенно в группах
соседних клеток неодинакова (мозаичность изменений ультраструктур), а чувствительность раз-
ных органелл клетки к воздействию различна (наиболее чувствительны митохондрии и эндо-
плазматическая сеть). К тому же ультраструктурная морфология дистрофий отражает не только
повреждение органелл, но и их репарацию (внутриклеточная регенерация). Таким образом, ста-
новятся понятными общность и разнообразие ультраструктурных изменений при разных
дистрофиях.
Характерная морфология дистрофий выявляется, как правило, на кле-
точном и тканевом уровнях, хотя для доказательства связи дистро-
фии с нарушениями того или иного вида обмена требуется применение гисто-
химических методов. Без установления качества продукта нарушенного
обмена нельзя верифицировать тканевую дистрофию, т. е. отнести ее к бел-
ковым, жировым, углеводным или другим. Изменения органа при ди-
строфии (размер, цвет, консистенция, структура на разрезе) в одних случаях
представлены исключительно ярко, в других отсутствуют, и лишь микроско-
пическое исследование позволяет выявить их специфичность. В ряде случаев
можно говорить осистемномхарактере изменений при дистрофии (си-
стемный гемосидероз, системный мезенхимальный амилоидоз, системный
липоидоз).
В классификации дистрофий придерживаются нескольких принципов.
I. В зависимости от преобладания морфологических изменений в специа-
лизированных элементах паренхимы или строме и сосудах: 1) паренхима-
тозные; 2) мезенхимальные; 3) смешанные.
II. По преобладанию нарушений того или иного вида обмена: 1) бел-
ковые; 2.) жировые; 3) углеводные; 4) минеральные.
III. В зависимости от влияния генетических факторов: 1) приобретенные;
2) наследственные.
IV. По распространенности процесса: 1) общие; 2) местные.
ПАРЕНХИМАТОЗНЫЕ ДИСТРОФИИ
Паренхиматозные дистрофии — проявления нарушений обмена
в высокоспециализированных в функциональном отношении клетках.
Клетка представляет собой сложную гетерогенную саморегулирующуюся систему, в кото-
рой многие процессы осуществляются по типу разветвленных цепных реакций. Эти процессы на-
правлены на выполнение специализированной функции. При этом элементы клетки выполняют
строго определенные функции: мембранная система осуществляет транспорт веществ, эндоплаз-
матическая сеть и рибосомы синтезируют «полуфабрикаты», комплекс Гольджи секретирует
окончательный продукт, лизосомы осуществляют клеточное пищеварение, митохондрии — выра-
ботку энергии, ядро и ядрышко — генетическое кодирование специфической функции и сохран-
ность клеточной популяции. Однако эти элементы строго координированы в своей деятельно-
сти, причем координация в выработке специфического продукта клетки подчинена закону
«внутриклеточного конвейера», который осуществляет взаимосвязь между структурными компо-
нентами клетки (главным образом эндоплазматической сетью, комплексом Гольджи и лизосо-
мами) и протекающими в ней процессами обмена. В итоге образуются те или иные вещества,
определяющие функциональную специфику клетки. Большую роль в ауторегуляции клетки при-
дают генам-репрессорам, осуществляющим «координационное торможение» функций различных
ультрастуктур.
В зависимости от нарушений того или иного вида обмена паренхима-
тозные дистрофии делят на белковые (диспротеинозы), жировые (липи-
дозы) и углеводные.
Паренхиматозные белковые дистрофии (диспротеинозы)
Большая часть белков цитоплазмы (простых и сложных) находится в
соединении с липидами, образуя липопротеидные комплексы. Эти комп-
лексы составляют основу мембран митохондрий, эндоплазматической сети,
комплекса Гольджи и других структур. Помимо связанных белков, в цито-
плазме содержатся и свободные. Многие из последних обладают функцией
ферментов.
Сущность паренхиматозных диспротеинозов состоит в том, что изменяют-
ся физико-химические и морфологические свойства белков клетки — они под-
вергаются денатурации и коагуляции или, наоборот, колликвации, что ведет
к гидратации цитоплазмы. В тех случаях, когда нарушаются связи белков
с липидами, возникает деструкция мембранных структур клетки.
К паренхиматозным диспротеинозам относят зернистую, гиалиново-ка-
пельную, гидропическую и роговую дистрофии. Эти дистрофии нередко пред-
ставляют собой последовательные этапы нарушений метаболизма белков ци-
топлазмы в зависимости от преобладания денатурации и коагуляции, или
гидратации и колликвации цитоплазмы. В исходе этих нарушений может раз-
виться коагуляционныи (сухой) или колликвационный (влажный)
некроз (схема I).
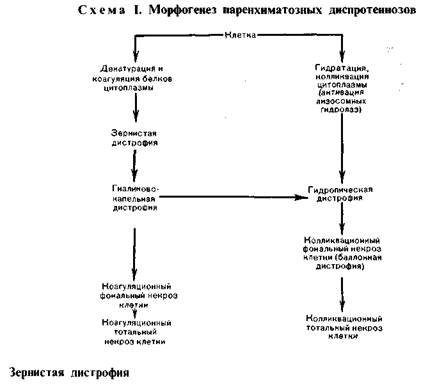
Зернистая дистрофия характеризуется появлением в цитоплазме
большого числа зерен белковой природы. Это самый частый вид дистрофии
среди диспротеинозов. Процесс бывает наиболее ярко выражен в печени,
почках и сердце.
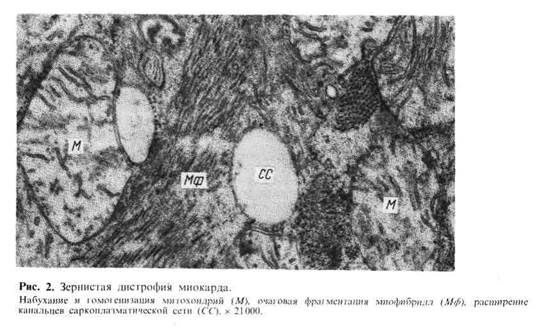
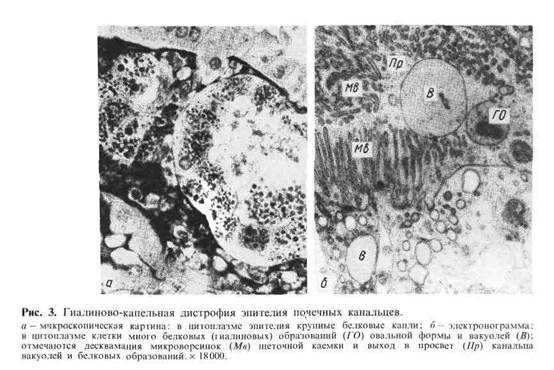
Микроскопическая картина: клетки печени, эпителия извитых канальцев по-
чек, мышечных волокон сердца изменяются. Они увеличиваются, набухают,
цитоплазма их становится мутной, богатой белковыми гранулами или капля-
ми, хорошо выявляемыми гистохимическими методами (реакции Даниелли
и Милона) и с помощью электронного микроскопа. Электронно-микроскопи-
ческое исследование позволяет выявить в таких случаях набухание или вакуо-
лизацию митохондрий (рис. 2), а также расширенные цистерны эндоплазмати-
ческой сети, в которых определяются скопления белков; отмечается
деструкция мембран.
Внешний вид органов при зернистой дистрофии весьма характерен: они не-
сколько увеличены, имеют дряблую консистенцию, на разрезе ткань выбухает,
лишена обычного блеска, тусклая, мутная. На основании этих признаков го-
ворят о тусклом, или мутном, набухании органов.
Следует иметь в виду, что картина, сходная с мутным набуханием, может быть результатом
трупных изменений. О прижизненное™ процесса в таких случаях можно судить по увеличению
размеров клеток, которое нехарактерно для трупных изменений.
Причины зернистой дистрофии разнообразны: расстройства кровообраще-
ния (застойное полнокровие, стазы и др.) и лимфообращения, инфекции
(тифы, скарлатина, дифтерия и др.), интоксикации и другие факторы, которые
могут вести к снижению интенсивности окислительных процессов, энергетиче-
скому дефициту клетки, накоплению в ней кислых продуктов и денатурации
белков цитоплазмы.
Механизм появления белковых зерен в цитоплазме сложен и связан с мно-
гими процессами, значение которых различно.
Появление белковых зерен в цитоплазме не всегда позволяет рассматривать этот процесс
как дистрофический, он может отражать как структурно-функциональные особен-
ности клетки в физиологических условиях (образование секреторных гранул, например,
клетками островков поджелудочной железы, передней доли гипофиза, юкстагломерулярного ап-
парата; физиологическую резорбцию белков, например, эпителием проксимальных канальцев
почек, слизистой оболочки тонкой кишки и т. д.), так и усиление белоксинтезирую-
щ е й функции (синтез белков гепатоцитами, секреторными клетками поджелудочной железы).
Накопление гранул белков в клетке как выражение дистрофии мо-
жет быть связано с механизмами инфильтрации (инфильтрация эпителия
проксимальных и дистальных канальцев почек), декомпозиции — при де-
струкции мембранных структур клетки (например, в миокарде), трансфор-
мации компонентов исходных продуктов углеводов и жиров в белки (напри-
мер, в гепатоцитах).
Важно подчеркнуть, что при декомпозиции нарушается обмен не только
белков, но и липидов. В связи с этим иногда трудно провести четкую грань
между белковой (зернистой) и жировой дистрофией; нередко вторая сменяет
первую.
Исход зернистой дистрофии различный. В большинстве случаев она обра-
тима, но если вызвавшие ее причины не устранены, возможен ее переход
в гиалиново-капельную, гидропическую или жировую дистрофию.
Функциональное значение зернистой дистрофии невелико и может про-
являться в изменении, в частности некотором ослаблении функции пора-
женных органов.
Дата добавления: 2015-11-26 | Просмотры: 779 | Нарушение авторских прав
|




